Kinetika kimia Shinta Rosalia Dewi Pendahuluan Pendahuluan cont























![Reaksi orde satu (cont’) Apabila dibuat grafik ln [A] versus t akan diperoleh slope Reaksi orde satu (cont’) Apabila dibuat grafik ln [A] versus t akan diperoleh slope](https://slidetodoc.com/presentation_image_h2/5526351336402beaa7e0d40f9b8350cf/image-24.jpg)


![A + B P, maka persamaan lajunya : [A]0 – [A] = [B]0 – A + B P, maka persamaan lajunya : [A]0 – [A] = [B]0 –](https://slidetodoc.com/presentation_image_h2/5526351336402beaa7e0d40f9b8350cf/image-27.jpg)
![Jika [B] disubstitusi ke persamaan, maka : Jika [B] disubstitusi ke persamaan, maka :](https://slidetodoc.com/presentation_image_h2/5526351336402beaa7e0d40f9b8350cf/image-28.jpg)











- Slides: 41

Kinetika kimia Shinta Rosalia Dewi

Pendahuluan

Pendahuluan (cont’) • Kinetika reaksi adalah studi tentang laju reaksi, perubahan konsentrasi reaktan (atau produk) sebagai fungsi dari waktu • Reaksi dapat berlangsung dengan laju yang bervariasi, ada yang serta merta, perlu cukup waktu (pembakaran) atau waktu yang sangat lama seperti penuaan, pembentukan batubara dan beberapa reaksi peluruhan radioaktif

Pendahuluan (cont’) • Laju reaksi dinyatakan sebagai laju berkurangnya konsentrasi pereaksi atau bertambahnya konsentrasi produk per satuan waktu. • Laju reaksi mempunyai satuan mol per liter per detik (mol. L-1. s-1 atau M. s-1). • Laju pengurangan reaktan dinyatakan sebagai -r, sedangkan laju pembentukan produk dinyatakan sebagai +r.

Mengekspresikan Laju Reaksi

Ekspresi Laju dalam Konsentrasi Reaktan dan Produk

Soal latihan Laju pembentukan NO(g) pada reaksi 2 NOBr(g) 2 NO(g) + Br 2(g) adalah sebesar 1, 6 x 10 -4 M/s. berapa laju konsumsi NOBr?


Soal Latihan Karena menghasilkan produk gas non polusi, hidrogen digunakan sebagai bahan bakar roket dan sumber energi masa depan: 2 H 2(g) + O 2(g) 2 H 2 O(g) 1. Tuliskan laju reaksi ini dalam bentuk perubahan [H 2], [O 2] dan [H 2 O] terhadap waktu 2. Saat O 2 turun pada 0, 23 mol/L. s berapa kenaikan terbentuknya H 2 O?


Slide Tambahan • Apabila diberikan satu komponen reaksi, i, dan laju perubahan jumlah mol komponen i adalah d. Ni/dt, maka laju reaksi dalam berbagai bentuk dapat ditulis dengan : Didasarkan pada unit volume reaksi fluida : Didasarkan pada unit masa padatan dalam system padat-fluida :

Slide Tambahan Didasarkan pada unit volume padatan dalam system gas-padat : Didasarkan pada unit volume reaktor :

Slide Tambahan Seorang perempuan dengan berat 60 kg mengkonsumsi sekitar 6000 k. J energi dari makanan. Dan asumsikan bahwa seluruh makanannya adalah glukosa dan reaksi keseluruhannya adalah sebagai berikut : C 6 H 12 O 6 + 6 O 2 6 CO 2 + 6 H 2 O ∆HR = -2816 k. J Tentukan laju metabolik perempuan tersebut dalam mol oksigen per m 3 tubuh per detik! (densitas = 1000 kg/m 3)

Slide Tambahan Untuk setiap mol glukosa yang dikonsumsi, digunakan 6 mol O 2 dan melepas 2816 k. J energi.

Orde reaksi • Orde reaksi (tingkat reaksi) adalah jumlah eksponen faktor konsentrasi yang terdapat dalam persamaan laju. • Orde reaksi menyatakan besarnya pengaruh konsentrasi pereaksi terhadap laju reaksi.

Orde reaksi (cont’) Misalnya reaksi : a. A + b. B +. . . + d. D P a + b +. . . + d = n Jadi reaksi tingkat a terhadap A, tingkat b terhadap B dan tingkat n terhadap keseluruhan reaksi. Dimana nilai : a. b, . . . , d tidak harus selalu sama dengan koefisien stoikiometri.

• Reaksi yang harga orde reaksi terhadap suatu komponen sama dengan koefisien reaksi komponennya disebut reaksi elementer Orde reaksi total = 2

• Reaksi yang harga orde reaksinya tidak sama dengan koefisien stoikhiometri komponennya disebut reaksi non elementer. 5 Br- + Br. O 3 - + 6 H+ 3 Br 2 + 3 H 2 O, orde reaksi total = 4

Latihan Tabel di bawah ini merupakan data dari reaksi P + Q →R + S [P]awal (M) a 2 a 3 a a a [Q]awal (M) B b b 2 b 3 b Laju reaksi (M/s) V 4 v 9 v v v Dari data tersebut, tentukan: 1. orde reaksi P 2. orde reaksi Q 3. orde reaksi total 4. persamaan laju reaksi

Latihan • Salah satu reaksi gas yang terjadi dalam kendaraan adalah: NO 2(g) + CO(g) NO(g) + CO 2(g) Laju = k[NO 2]m[CO]n • Jika diketahui data sebagai berikut, tentukan orde reaksi keseluruhan Eksperimen Laju awal (mol/L. s) [NO 2] awal (mol/L) [CO] awal (mol/L) 1 2 3 0, 0050 0, 080 0, 0050 0, 10 0, 40 0, 10 0, 20

Reaksi orde nol Misalnya diberikan reaksi sederhana : R P Reaksi orde nol adalah reaksi yang laju reaksinya dapat ditulis sebagai : di mana k adalah konstanta laju reaksi orde nol dan [R] adalah konsentrasi reaktan.

Reaksi orde nol (cont’) atau

Reaksi orde satu Misalnya diberikan reaksi sederhana : A P
![Reaksi orde satu cont Apabila dibuat grafik ln A versus t akan diperoleh slope Reaksi orde satu (cont’) Apabila dibuat grafik ln [A] versus t akan diperoleh slope](https://slidetodoc.com/presentation_image_h2/5526351336402beaa7e0d40f9b8350cf/image-24.jpg)
Reaksi orde satu (cont’) Apabila dibuat grafik ln [A] versus t akan diperoleh slope = -k. Konstanta laju reaksi juga dapat ditentukan dengan rumus :

Reaksi orde dua • Pada reaksi orde dua, laju reaksi berbanding langsung dengan kuadrat konsentrasi dari satu reaktan atau dengan hasil kali konsentrasi yang meningkat sampai pangkat satu atau dua dari reaktan. • Misalkan pada reaksi orde dua : 2 A P, maka persamaan lajunya :

Reaksi orde dua (cont’)
![A B P maka persamaan lajunya A0 A B0 A + B P, maka persamaan lajunya : [A]0 – [A] = [B]0 –](https://slidetodoc.com/presentation_image_h2/5526351336402beaa7e0d40f9b8350cf/image-27.jpg)
A + B P, maka persamaan lajunya : [A]0 – [A] = [B]0 – [B] sehingga [B] = [B]0 – [A]0 + [A], dengan [A] dan [B] adalah konsentrasi reaktan dan [A]0 dan [B]0 adalah konsentrasi awal reaktan.
![Jika B disubstitusi ke persamaan maka Jika [B] disubstitusi ke persamaan, maka :](https://slidetodoc.com/presentation_image_h2/5526351336402beaa7e0d40f9b8350cf/image-28.jpg)
Jika [B] disubstitusi ke persamaan, maka :

Jenis reaksi Berdasarkan banyaknya fase yang terlibat dalam sistem reaksi • Reaksi homogen : sistem reaksi dengan fase tunggal (fasa yang sama). Berupa reaksi homogen fase gas atau reaksi homogen fase cair. Reaksi terjadi di seluruh bagian fase • Reaksi heterogen : sistem reaksi yang mengandung lebih dari 1 (satu) fase sedikitnya dua fasa pereaksi supaya reaksi dapat berlangsung. Reaksi terjadi di permukaan antar fase

Jenis reaksi (cont’) Berdasarkan keberadaan atau penggunaan katalis • Reaksi katalitik : sistem reaksi yang menggunakan peran katalis atau katalisator. Ada 2 macam : 1. reaksi katalitik homogen (jika fase katalis = fase reaksi) 2. reaksi katalitik heterogen (jika fase katalis ≠ fase reaksi). • Reaksi non-katalitik : sistem reaksi yang tidak menggunakan peran katalis.

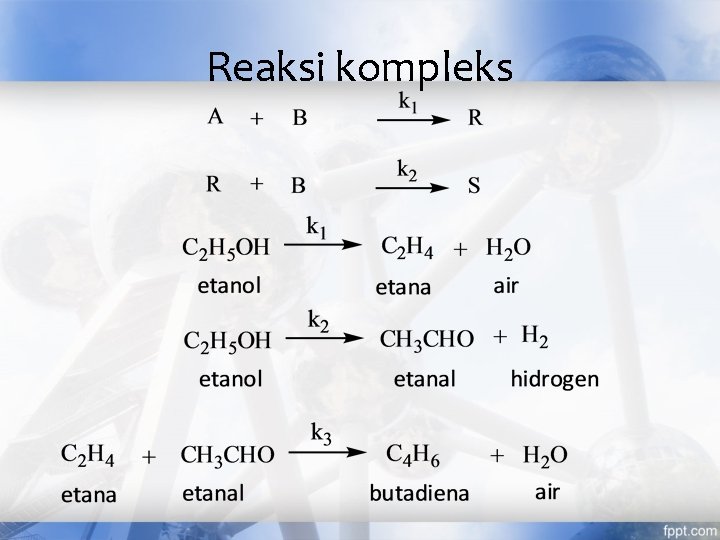
Jenis reaksi (cont’) Berdasarkan mekanisme atau kompleksitasnya • Reaksi tunggal (single reaction) : reaksi yang mempunyai satu persamaan stoikiometri dan satu persamaan laju yang bertanggung jawab pada jalannya reaksi. • Reaksi kompleks / ganda (multiple reaction) : reaksi yang mempunyai lebih dari satu persamaan stoikiometri dan kinetika reaksi yang bertanggung jawab pada jalannya reaksi.

Reaksi kompleks • Reaksi seri • Reaksi paralel

Reaksi kompleks

Reaksi kompleks

Jenis reaksi (cont’) Berdasarkan arah reaksinya • Reaksi reversibel (bolak-balik) : reaksi reversibel merupakan reaksi bolak-balik; dalam hal ini terjadi kesetimbangan. • Reaksi ireversibel (searah) : reaksi ireversibel merupakan reaksi satu arah atau tak dapat balik; tidak ada keadaan setimbang.

Faktor yang Mempengaruhi Laju Reaksi • Pada kondisi tertentu masing-masing reaksi memiliki karakteristik laju masing-masing yang ditentukan oleh sifat kimia reaktan • Pada suhu kamar: H 2(g) + F 2(g) 2 HF(g) sangat cepat 3 H 2(g) + N 2(g) 2 NH 3(g) sangat lambat

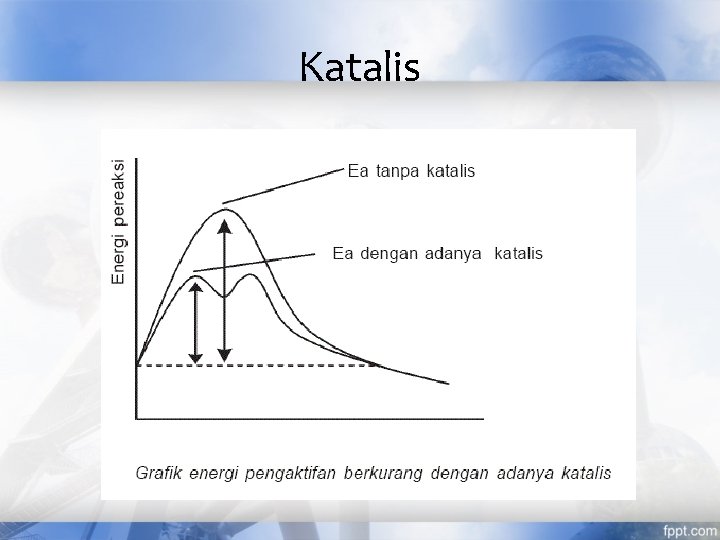
Faktor yang Mempengaruhi Laju Reaksi • Konsentrasi: molekul-molekul harus bertumbukan agar terjadi reaksi dalam konteks ini laju reaksi proporsional dengan konsentrasi reaktan • Luas permukaan : semakin besar luas permukaan, laju reaksi semakin cepat • Temperatur: molekul harus bertumbukan dengan energi yang cukup untuk bereaksi • Katalis : penggunaan katalis akan mempercepat laju reaksi N 2(g) + 3 H 2(g) ⇄ 2 NH 3(g) ∆H = -92, 4 Kj Pada 25 o. C : Kp = 6, 2× 105

Katalis

Contoh Persamaan kecepatan reaksi H 2 + I 2 → 2 HI V = k [H 2][I 2]. Jika konsentrasi H 2 dinaikkan 2 x dan I 2 dinaikkan 3 x, maka laju reaksi menjadi?

• Reaksi antara NO(g) dan O 2 (g) adalah reaksi berorde dua terhadap NO(g) dan berorde dua untuk O 2 (g). Jika konsentrasi kedua pereaksi dijadikan 3 kali konsentrasi semula. Tentukan laju reaksinya dibandingkan dengan laju semula menjadi!

Home work Siklobutana (C 4 H 8) terdekomposisi pada 1000 o. C menjadi dua molekul etilen (C 2 H 4) dengan konstanta laju reaksi orde satu 87 s-1 1. Jika konsentrasi awal siklobutana 2, 00 M berapa konsentrasinya setelah 0, 010 s? 2. Berapa fraksi siklobutana terdekomposisi pada waktu tersebut
 Kinetika kimia
Kinetika kimia Cont or cont'd
Cont or cont'd Cont or cont'd
Cont or cont'd Shinta rahmani
Shinta rahmani Shinta rahmani
Shinta rahmani Language planning
Language planning Agustina shinta
Agustina shinta Brzina hemijske reakcije
Brzina hemijske reakcije Znakoplavka
Znakoplavka Rosalia di nardo
Rosalia di nardo Franziska schwaninger
Franziska schwaninger Rosalia lombardo
Rosalia lombardo Alejandro casona rosalia martin bravo
Alejandro casona rosalia martin bravo Dewa dewi prediktor lll
Dewa dewi prediktor lll Indri kusuma dewi
Indri kusuma dewi Dewi irawaty
Dewi irawaty Mandiri dewi sri
Mandiri dewi sri Jarak rumah rina ke rumah dewi adalah 27 km
Jarak rumah rina ke rumah dewi adalah 27 km Ica puspita dewi anggraini
Ica puspita dewi anggraini Dewi ayu larasati
Dewi ayu larasati Dewi kurniasih
Dewi kurniasih Dewi setianingsih
Dewi setianingsih Amelia sri kusuma dewi sh. m.kn
Amelia sri kusuma dewi sh. m.kn Nama lain dewi gayatri
Nama lain dewi gayatri Ica puspita dewi anggraini
Ica puspita dewi anggraini Dewa dewi predictor
Dewa dewi predictor Dewi xxx
Dewi xxx Ica puspita dewi anggraini
Ica puspita dewi anggraini Ika atsari dewi
Ika atsari dewi Dewi retno suminar
Dewi retno suminar Pendekatan ekologi
Pendekatan ekologi Dewi kurniasih
Dewi kurniasih Amelia sri kusuma dewi sh. m.kn
Amelia sri kusuma dewi sh. m.kn Dewi kurniasih
Dewi kurniasih Syscall
Syscall Map of cont
Map of cont File sharing management system
File sharing management system Rm
Rm Cont de car parking
Cont de car parking Efts cont
Efts cont Plusnet data
Plusnet data Edf cont
Edf cont