Kaynaklar Analitik Kimya Temel lkeler Cilt 1 Enstrumental
















- Slides: 21

Kaynaklar Analitik Kimya, Temel İlkeler, Cilt 1 Enstrumental Analiz (Prof. Dr. Turgut Gündüz) Enstrumental Analiz Temel İlkeleri (Skoog-Holler-Nieman) 26. 10. 2021 1

BÖLÜM 15 Karmaşık asit-baz sistemleri 26. 10. 2021 2

Kuvvetli asit ve zayıf asitlerin veya kuvvetli ve zayıf bazlar bir arada ise zayıf asit ve bazların iyonlaşma sabitleri 10 -4 den biraz daha küçük ise, bu karışımdaki bileşenlerin her birinin derişimleri tayin edilebilir. 26. 10. 2021 3

• Zayıf ve kuvvetli asitlerin bir karışımı için titrasyon eğrisinin şekli, zayıf asidin kuvvetine bağlıdır. 26. 10. 2021 4

Poliprotik asitler ve bazlar Fosforik asit tipik bir poliprotik asittir. Üç iyonlaşma dengesi vardır. Ardışık iki denge toplandığında elde edilen toplu reaksiyonun denge sabiti iki sabitin çarpımına eşittir. 26. 10. 2021 5

Poliprotik asitlerin tampon çözeltileri • Bir zayıf dibazik asit ve onun tuzundan iki tampon sistemi hazırlanabilir. Biri H 2 A asidi ve onun konjuge bazı olan Na. HA’dan oluşur. İkincisi ise Na. HA asidi ile konjuge bazı Na 2 A’dan oluşur • İkinci sistemin p. H’sı birincisinden daha yüksektir. . 26. 10. 2021 6

Poliprotik asitler için titrasyon eğrileri: • İki veya daha fazla asidik grup içeren bileşiklerin asitlik kuvvetleri farklı ise titrasyonda birden fazla dönüm noktası gözlenir. • Ka 1/Ka 2 oranı 103 den büyük ise bu asitler için titrasyon eğrileri türetilebilir. 26. 10. 2021 7

Örnek: 25 m. L 0, 1 M maleik asitin 0, 1 M Na. OH ile titrasyon eğrisini çiziniz Çözüm için ip ucu: Ka 1/Ka 2 oranı 2 x 104 olduğu için titrasyon eğrisi çizilebilir. • Başlangıç p. H: Sadece birinci iyonlaşma dikkate alınır. • Birinci tampon bölgesi: H 2 M/Na. HM tamponu oluşur. • Birinci eşdeğerlik noktası: Amfiprotik bileşik oluşur. • İkinci tampon bölgesi: HM-/M 2 - den oluşan tampon meydana gelir. 26. 10. 2021 8

• İkinci eşdeğerlik noktası: Na 2 M bileşiği oluşur. • İkinci eşdeğerlik noktasından sonra: Ortama ilave edilen Na. OH den hesaplama yapılır. 26. 10. 2021 9

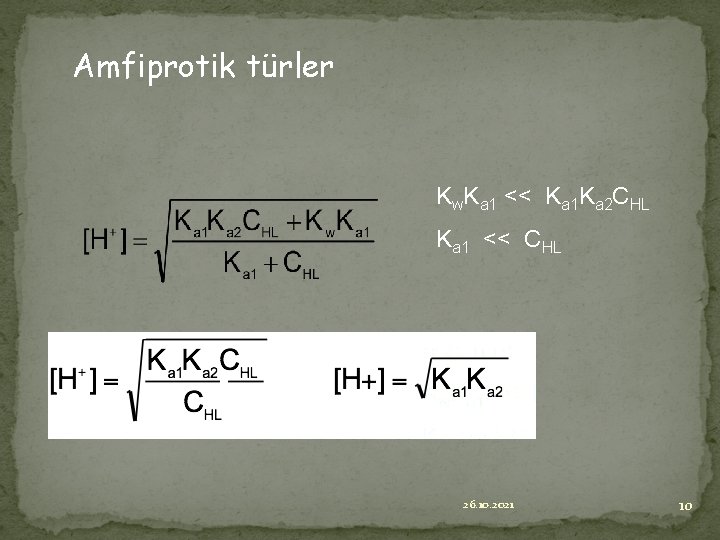
Amfiprotik türler Kw. Ka 1 << Ka 1 Ka 2 CHL Ka 1 << CHL 26. 10. 2021 10

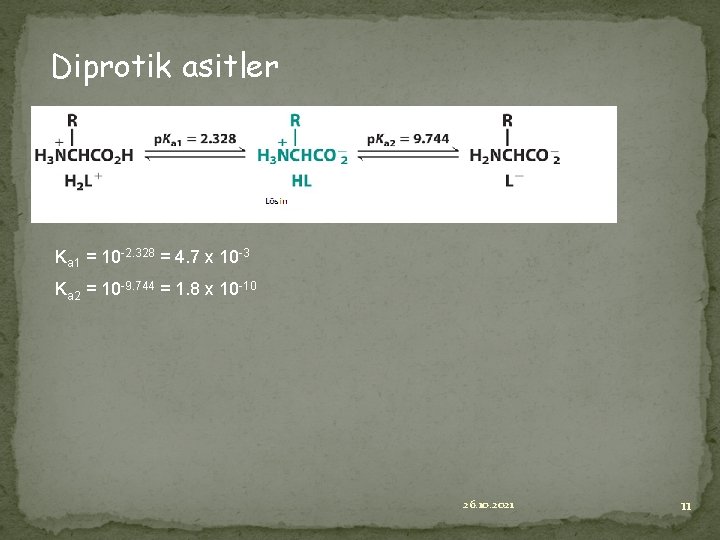
Diprotik asitler Ka 1 = 10 -2. 328 = 4. 7 x 10 -3 Ka 2 = 10 -9. 744 = 1. 8 x 10 -10 26. 10. 2021 11

Ka 1 = 10 -2. 328 = 4. 7 x 10 -3 Ka 2 = 10 -9. 744 = 1. 8 x 10 -10 Örnek sodyum lösinatın p. H ‘ı kaçtır. 26. 10. 2021 12

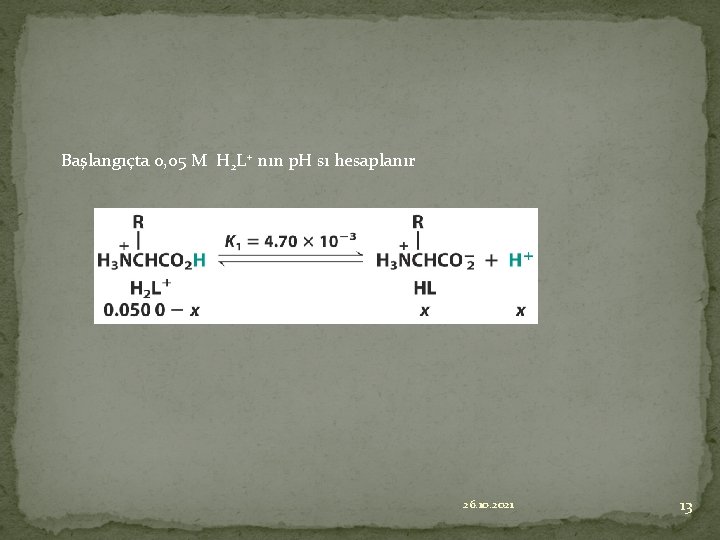
Başlangıçta 0, 05 M H 2 L+ nın p. H sı hesaplanır 26. 10. 2021 13

2. Bazik L_ formu Ka 1 = 10 -2. 328 = 4. 7 x 10 -3 Ka 2 = 10 -9. 744 = 1. 8 x 10 -10 26. 10. 2021 14

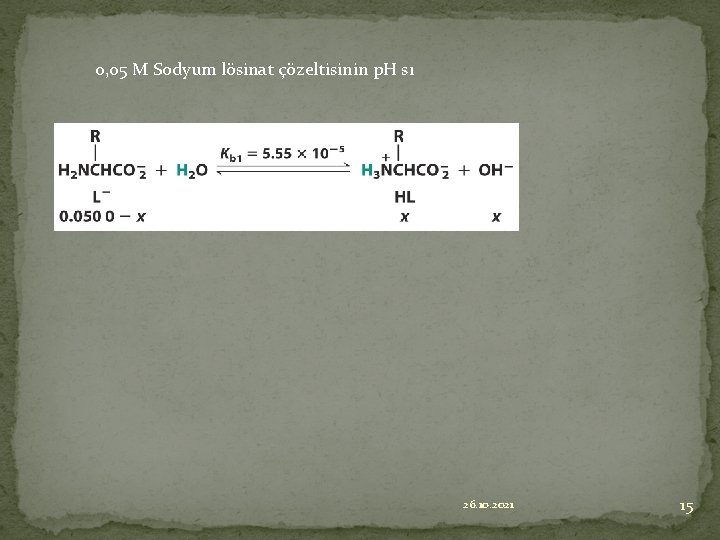
0, 05 M Sodyum lösinat çözeltisinin p. H sı 26. 10. 2021 15

Poliprotik bazlar için titrasyon eğrileri • Asitler için geçerli olan prensip burada da geçerlidir. Örneğin sodyum karbonet çözeltisinin hidroklorik asitle titrasyonu verilebilir. • Karbonat iyonunun su ile reaksiyonu çözeltinin başlangıç p. H sını belirler. Asit ilave edildiğinde, karbonat/hidrojen karbonat tamponu oluşur. Bu bölgede p. H kb 1 den hesaplama yapılabilir. Veya ka 2 den hesaplama yapılabilir. 16

• Birinci eşdeğerlik noktası: Sodyum hidrojen karbonat bileşği oluşur. Amfiprotik türden hesaplama yapılır. • Birinci eşdeğerlik noktası sonrası: Sodyumhidrojen karbonat/karbonik asit tamponu oluşur. • İkinci eşdeğerlik noktası: Çözelti karbondioksit ve sodyumklorür çözeltisinden ibarettir. Zayıf bir asit gibi düşünülebilir. 26. 10. 2021 17

Amfiprotik türler için titrasyon eğrileri • Amfiprotik türler asitler karşısında baz, bazlar karşısında asit özelliği gösteren türlerdir. • Maddenin asidik veya bazik özelliğinden hangisi baskınsa, buna göre kuvvetli baz veya asitle titrasyonu mümkündür. Örnek: Sodyumdihidrojen fosfat çözeltisi 26. 10. 2021 18

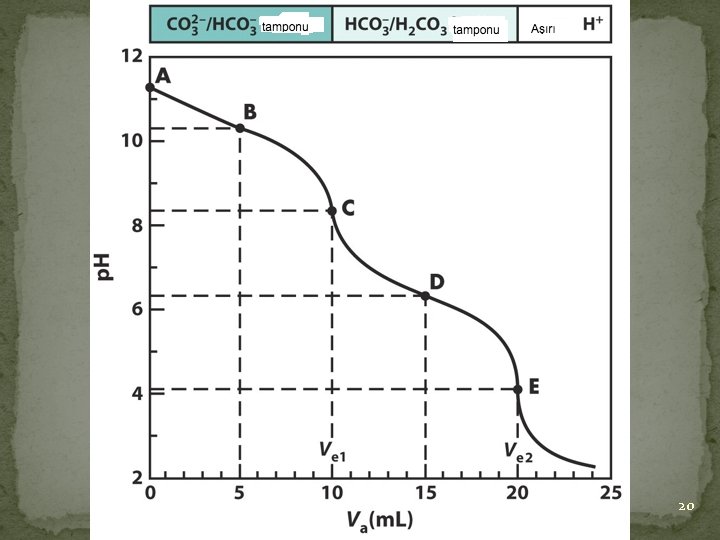
Örnek: 50 m. L 0, 02 M Na 2 CO 3 ın 0, 1 M HCl ile titrasyonu 26. 10. 2021 19

26. 10. 2021 20

Poliprotik asit çözeltilerinim p. Hnın fonksiyonu olarak bileşimi Poliprotik asitler ve bazlar için de monoprotik zayıf asitler ve bazlar için türetilen alfa değerleri türetilebilir. Maleik asit için alfa 0, alfa 1 ve alfa 2 değerleri hangi türün hangi p. H var olduğu hakkında bilgi verir 26. 10. 2021 21
 Analitik kimya nedir
Analitik kimya nedir Bürete
Bürete Lkeler
Lkeler Uzlaşımsallık
Uzlaşımsallık Set seçimsiz menü nedir
Set seçimsiz menü nedir Cilt ireland
Cilt ireland Mesleki cilt hastalığına neden olan fiziksel faktörler
Mesleki cilt hastalığına neden olan fiziksel faktörler Mha kaç cilt
Mha kaç cilt Tersiyer bütil
Tersiyer bütil Vadel
Vadel Personel bulmada kullanılan işletme dışı kaynaklar
Personel bulmada kullanılan işletme dışı kaynaklar Istihsam
Istihsam Yardımcı kaynaklar hukuk
Yardımcı kaynaklar hukuk Sınırlı kaynaklar ve teknoloji düzeyi eğrisi
Sınırlı kaynaklar ve teknoloji düzeyi eğrisi Maddi kaynaklar
Maddi kaynaklar Giriş gelişme sonuç örnekleri
Giriş gelişme sonuç örnekleri Www.nedir.org
Www.nedir.org Vergi hukuku asli kaynaklar
Vergi hukuku asli kaynaklar Sınırlı kaynaklar ve teknoloji düzeyi eğrisi
Sınırlı kaynaklar ve teknoloji düzeyi eğrisi Doğal kaynaklar nelerdir
Doğal kaynaklar nelerdir Iş hukukunun yardımcı kaynakları
Iş hukukunun yardımcı kaynakları Normlar hiyerarşisi
Normlar hiyerarşisi