Kapitel 2 Vannmolekylets kjemiske egenskaper Vann utgjr 70
















- Slides: 27

Kapitel 2: Vannmolekylets kjemiske egenskaper

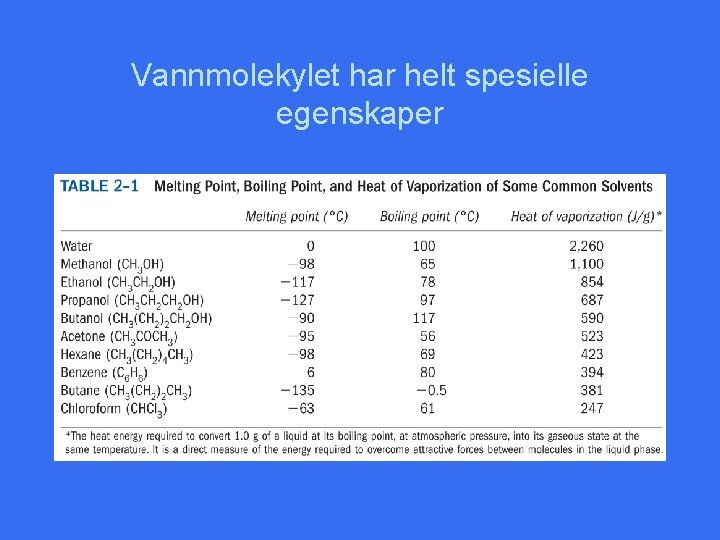
Vann utgjør 70% eller mer av de fleste organismers vekt • • Er cellens løsningsmiddel Deltar i cellens kjemiske reaksjoner Fungerer som temperaturbuffer Vann er både det løsningsmidlet hvor metabolske reaksjoner finner sted og en deltaker i disse reaksjoner

Vannmolekylet har helt spesielle egenskaper


Vannmolekylet er en dipol • Tetrahedrisk orientering på – Bindingene til hydrogen – To elektronpar • Bindingsvinkel 104, 5 o • H 2 O danner en dipol fordi oksygen er mere elektronegativ enn hydrogen => – Positiv delladning ved hydrogen – Negativ delladning ved oksygen

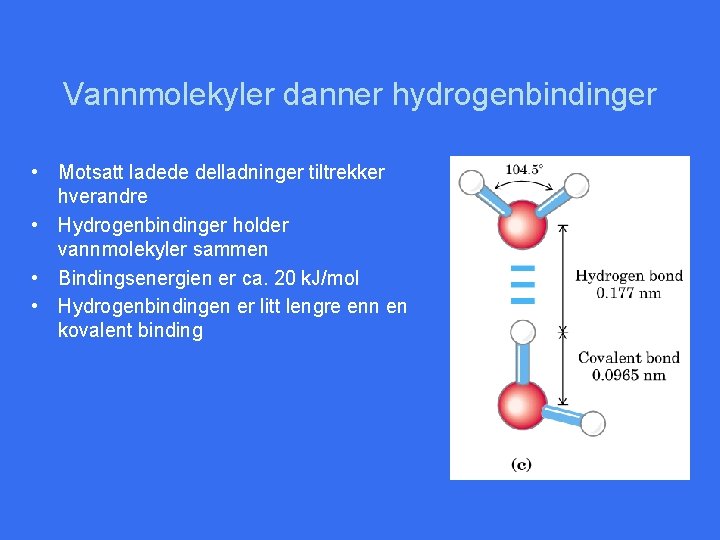
Vannmolekyler danner hydrogenbindinger • Motsatt ladede delladninger tiltrekker hverandre • Hydrogenbindinger holder vannmolekyler sammen • Bindingsenergien er ca. 20 k. J/mol • Hydrogenbindingen er litt lengre enn en kovalent binding

Generell definisjon av hydrogenbinding • • Hydrogenbindingen kan beskrives ved D H A D H er en svakt sur donorgruppe (f. eks. -O-H, -N-H, -S-H) A er et svakt basisk mottaker atom (f. eks. O, N, S) Hydrogenbindingen er karakterisert ved at avstanden er minst 0, 5 Å mindre enn van der Waals avstanden Fig 2 -2, s 24 Voet & Voet


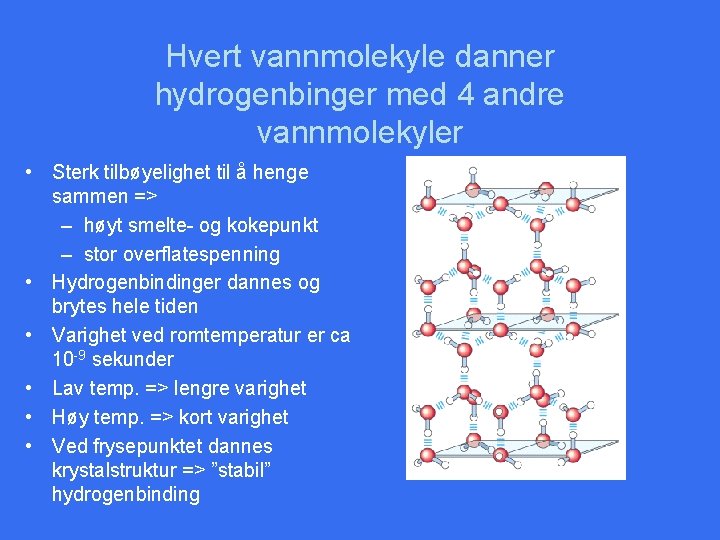
Hvert vannmolekyle danner hydrogenbinger med 4 andre vannmolekyler • Sterk tilbøyelighet til å henge sammen => – høyt smelte- og kokepunkt – stor overflatespenning • Hydrogenbindinger dannes og brytes hele tiden • Varighet ved romtemperatur er ca 10 -9 sekunder • Lav temp. => lengre varighet • Høy temp. => kort varighet • Ved frysepunktet dannes krystalstruktur => ”stabil” hydrogenbinding

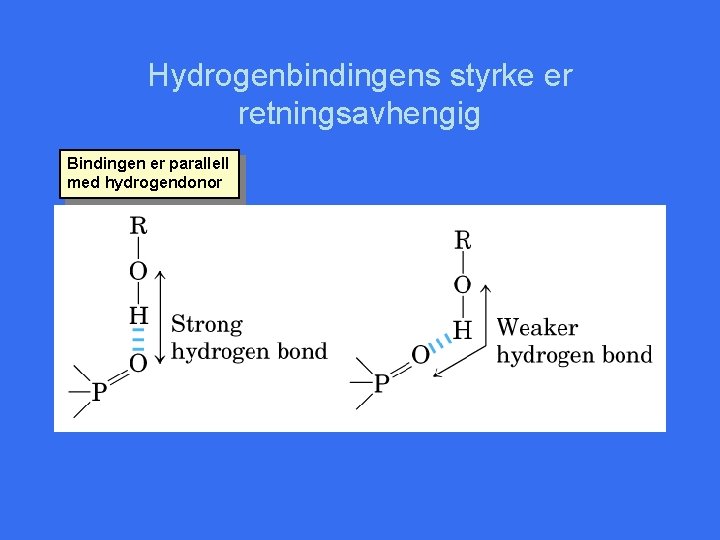
Hydrogenbindingens styrke er retningsavhengig Bindingen er parallell med hydrogendonor

Vann: et løsemiddel i særklasse • Molekyl A er løselig dersom løsemiddelmolekylene interagerer bedre med A enn med seg selv. • Vann er et løsemiddel i særklasse • Vann kan løse flere typer molekyler i større konsentrasjoner enn noe annet løsemiddel vi kjenner • Polare og ladete forbindelser som lett løser seg i vann kalles ”hydrofile” – Alkoholer, aldehyder, ketoner – Salte, syrer, baser, aminer • Upolare forbindelser som løser seg dårlig i vann kalles ”hydrofobe” – Lipider, vokser Fig 2 -6, s 26 Voet & Voet


Vanns hydrofile egenskaper • Hvorfor løser salter seg i vann? • Et polart løsningsmiddel som vann svekker tiltrekningskraften mellom motsatt ladete ioner og holder dem adskilt. • Uladete, polare molekylers dipoler interagerer med vann på samme måte som salter • Løste ioner/polare molekyler hydratiseres dvs. dekkes av en vannkappe => oppløsing av krystallstrukturen • Høy dielektrisitetskonstant, vann ved 25 O har e = 78, 5 • F er styrken i ioners interaksjon • F = Qer 12 Q 2 •

Hydrofobe forbindelser løser seg dårlig i vann • Hydrofobi = vannskrekk • Ikke vannløselige • Kan ikke danne hydrogenbindinger med vann • Hindrer vannmolekylenes interaksjon, reduserer entropien Fig 2 -8, s 28 Voet & Voet

Amfipatiske forbindelser • De fleste biomolekyler har både en ladet/ polar del og en upolar del - de er amfipatiske • Polar/ladet del interagerer med vann, upolar del unngår kontakt med vann • Danner miceller og ”bilayers” • Reduserer interaksjon med vann til et minimum hydrofob interaksjon • For eks. : proteiner, pigmenter, visse vitaminer, steroler, fosfolipider • Danner stabile overganger mellom hydrofile og hydrofobe miljøer • Eksempler på slike viktige strukturer: biologiske membraner, 3 D proteinstrukturer

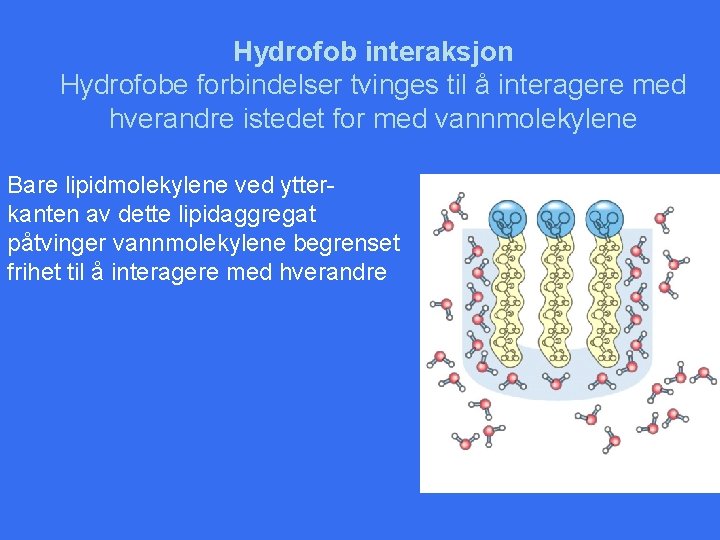
Hydrofob interaksjon Hydrofobe forbindelser tvinges til å interagere med hverandre istedet for med vannmolekylene Bare lipidmolekylene ved ytterkanten av dette lipidaggregat påtvinger vannmolekylene begrenset frihet til å interagere med hverandre

Miceller Ingen hydrofobe deler av molekylene er i kontakt med vannmolekyler Minimal begrensing av vannmolekylenes interaksjon Maksimal entropi

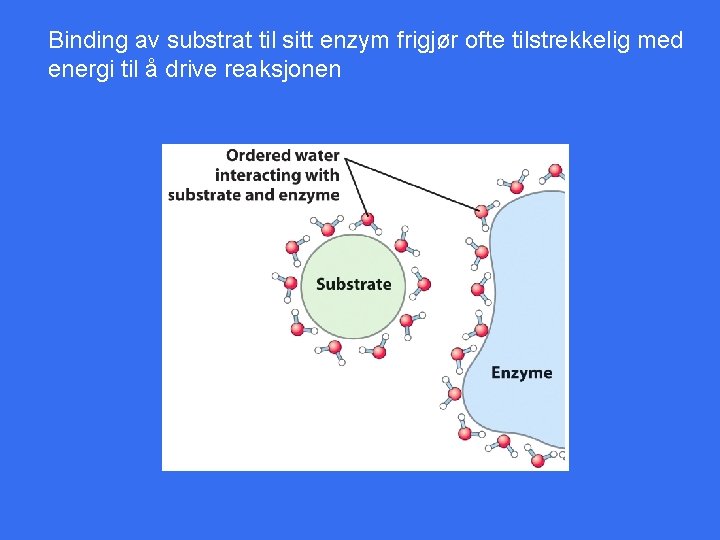
Binding av substrat til sitt enzym frigjør ofte tilstrekkelig med energi til å drive reaksjonen

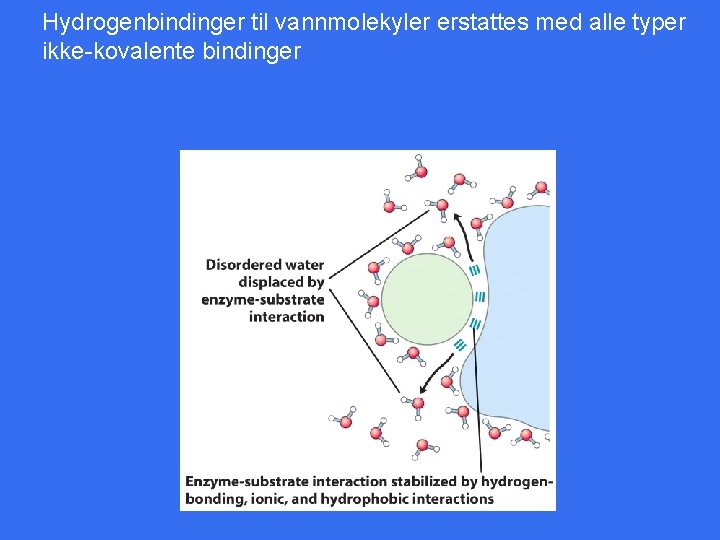
Hydrogenbindinger til vannmolekyler erstattes med alle typer ikke-kovalente bindinger

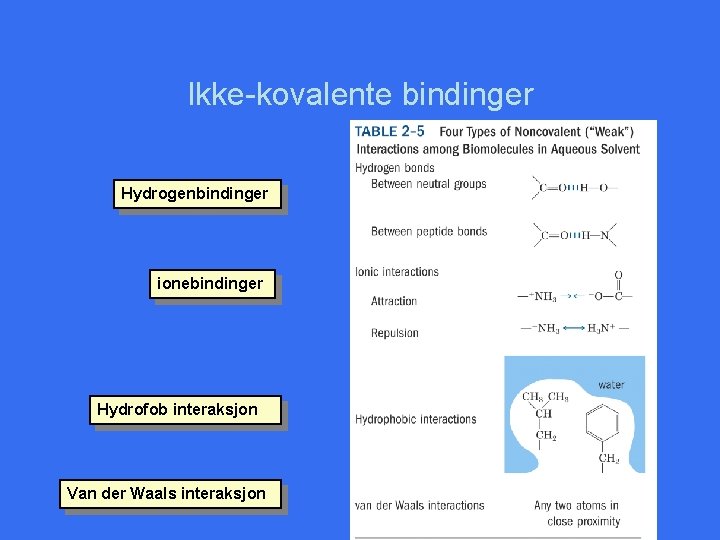
Ikke-kovalente bindinger Hydrogenbindinger ionebindinger Hydrofob interaksjon Van der Waals interaksjon

Ikke-kovalente bindinger • • • Svake bindinger: 30 - 4 k. J/mol Bindingsstyrke varierer noe avhengig av omgivelsene Kortvarige, dannes og brytes hele tiden Gir fleksible, dynamiske strukturer Et stort antall ikke-kovalente bindinger utgjør stor stabiliserende kraft – glidlås • Nativ konformasjon i makromolekyler innebærer dannelse av et maksimalt antall ikke-kovalente bindinger

Osmose • Vann søker alltid å være tilstede i like stor konsentrasjon på begge sider av en semipermeabel barriere – F. eks plasmamembranen • Osmose = diffusjon av vannmolekyler over semipermeabel membran, drivkraften er forskjell i osmotisk trykk

Osmotisk trykk • En løsnings osmotiske trykk er det trykket som må legges på løsningen for å hindre at vannmolekyler vandrer dit. • Osmotisk trykk P = ic. RT – R = gasskonstanten – T = absolutt temperatur (o. K) – c = molar konsentrasjon av oppløst forbindelse – i = van’t Hoff faktor (avspeiler antall ioner en forbindelse løses i)

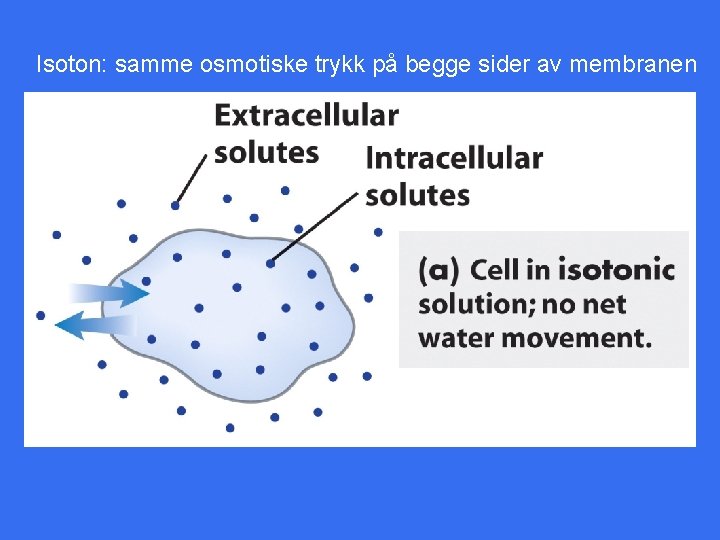
Isoton: samme osmotiske trykk på begge sider av membranen

En hyperton løsning har høyere osmotisk trykk enn den løsning den sammenliknes med

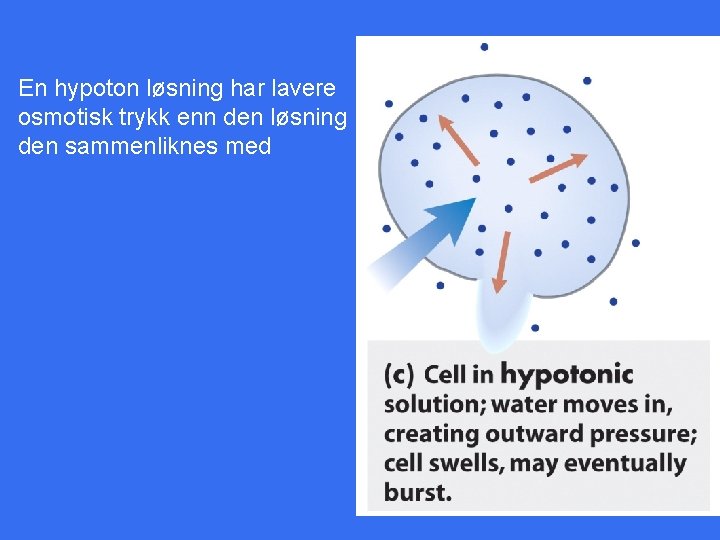
En hypoton løsning har lavere osmotisk trykk enn den løsning den sammenliknes med

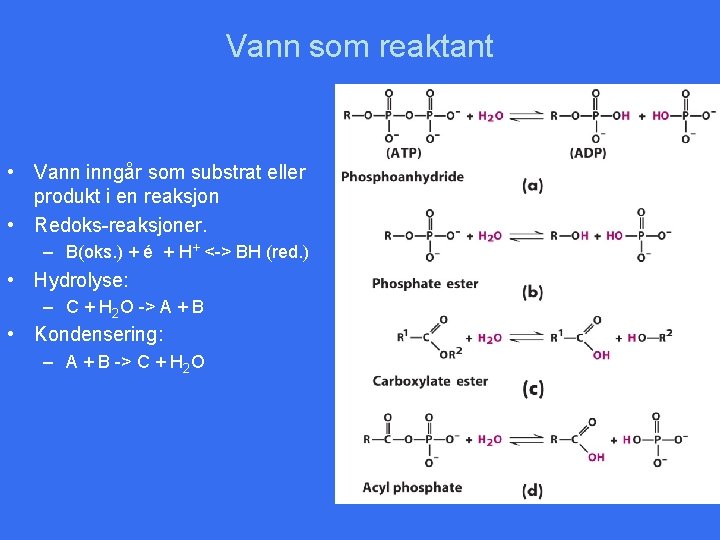
Vann som reaktant • Vann inngår som substrat eller produkt i en reaksjon • Redoks-reaksjoner. – B(oks. ) + é + H+ <-> BH (red. ) • Hydrolyse: – C + H 2 O -> A + B • Kondensering: – A + B -> C + H 2 O
 Hur fungerar metallbindning
Hur fungerar metallbindning Newton kjemiske reaksjoner
Newton kjemiske reaksjoner Kjemiske reaksjoner i dagliglivet
Kjemiske reaksjoner i dagliglivet Egenskaper eksempler
Egenskaper eksempler Clage vannvarmer
Clage vannvarmer Trykkforsterker vann
Trykkforsterker vann Kontinuitetsligningen
Kontinuitetsligningen Vattnets olika faser
Vattnets olika faser Ljudets egenskaper
Ljudets egenskaper Matematisk modellering eksempel
Matematisk modellering eksempel Lättmetall ti
Lättmetall ti Positiva egenskaper
Positiva egenskaper Karboxylsyra egenskaper
Karboxylsyra egenskaper Polärdiagram
Polärdiagram Guder hinduismen
Guder hinduismen Adjektiv ord
Adjektiv ord Markusevangelium kapitel 10
Markusevangelium kapitel 10 Elischka
Elischka Hiob kapitel 42
Hiob kapitel 42 Markus kapitel 16
Markus kapitel 16 Kapitel
Kapitel Das doppelte lottchen zusammenfassung
Das doppelte lottchen zusammenfassung Wie viele wörter sind das
Wie viele wörter sind das Lgr 11 kap 4
Lgr 11 kap 4 Perfekt 1 kapitel 4
Perfekt 1 kapitel 4 Emil und die detektive kapitel 12 zusammenfassung
Emil und die detektive kapitel 12 zusammenfassung Brief an die galater kapitel 6
Brief an die galater kapitel 6 Kapitel 5 lektion a answers
Kapitel 5 lektion a answers
















































