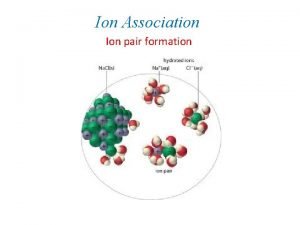
Interactions dorigine lectromagntique Ion diple permanent Ion diple



- Slides: 11

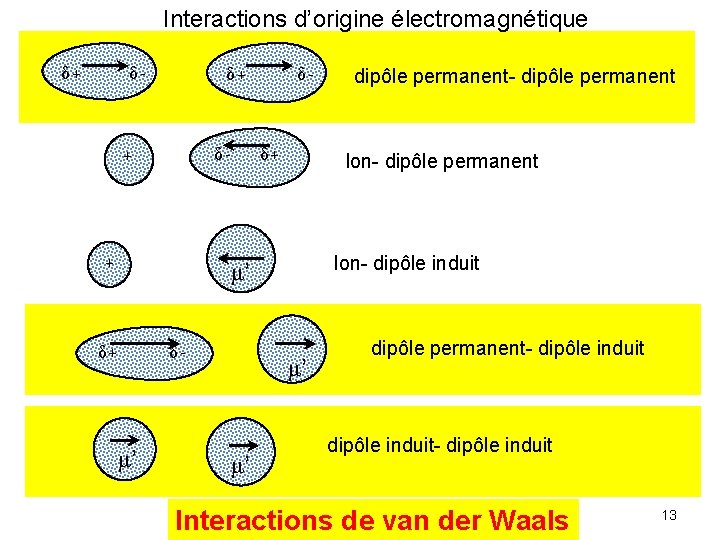
Interactions d’origine électromagnétique δ+ δ- + + δ- δ+ Ion- dipôle permanent Ion- dipôle induit μ’ δ+ δ- μ’ μ’ μ’ dipôle permanent- dipôle induit- dipôle induit Interactions de van der Waals 13

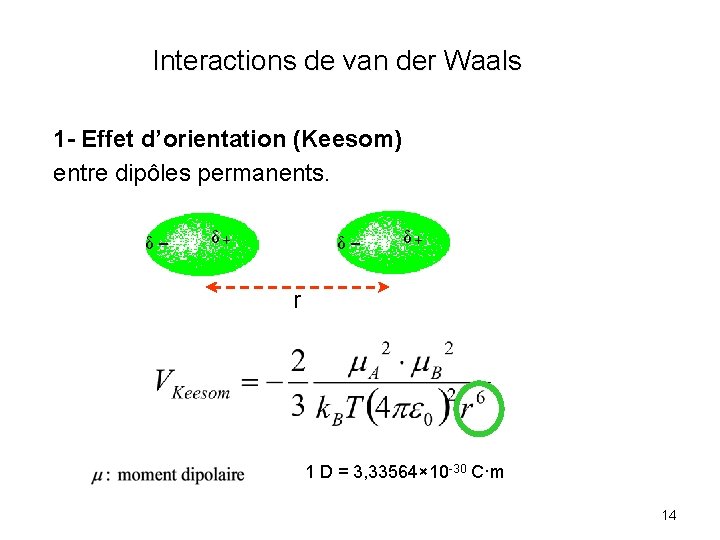
Interactions de van der Waals 1 - Effet d’orientation (Keesom) entre dipôles permanents. δ - δ+ r 1 D = 3, 33564× 10 -30 C·m 14

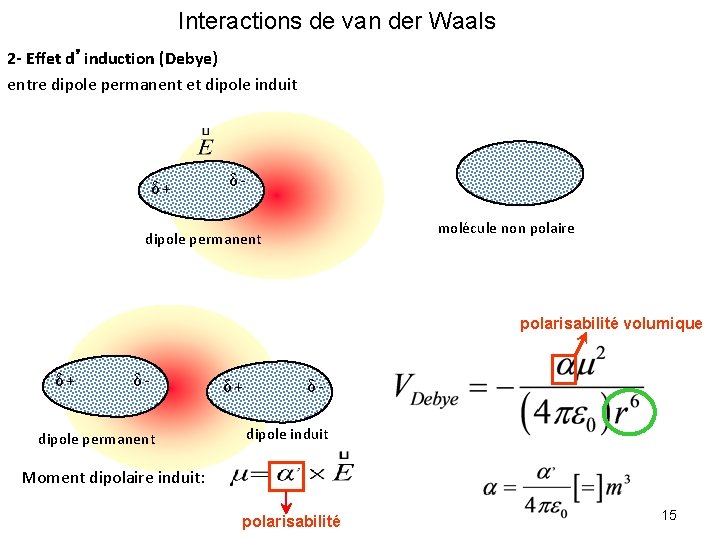
Interactions de van der Waals 2 - Effet d’induction (Debye) entre dipole permanent et dipole induit δ+ δmolécule non polaire dipole permanent polarisabilité volumique δ+ δ- dipole permanent δ+ δdipole induit Moment dipolaire induit: polarisabilité 15

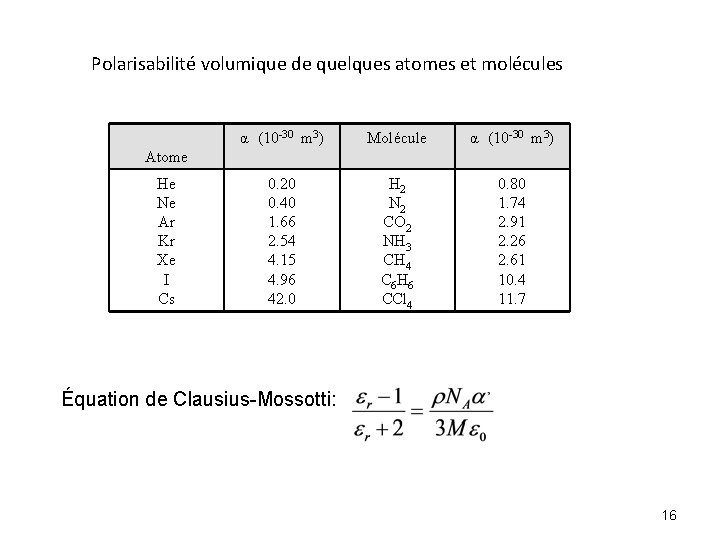
Polarisabilité volumique de quelques atomes et molécules α (10 -30 m 3) Molécule α (10 -30 m 3) 0. 20 0. 40 1. 66 2. 54 4. 15 4. 96 42. 0 H 2 N 2 CO 2 NH 3 CH 4 C 6 H 6 CCl 4 0. 80 1. 74 2. 91 2. 26 2. 61 10. 4 11. 7 Atome He Ne Ar Kr Xe I Cs Équation de Clausius-Mossotti: 16

Interactions de van der Waals 3 - L’effet de dispersion (London) Effet quantique Énergie de dispersion entre molécules non polaires (A et B) 17

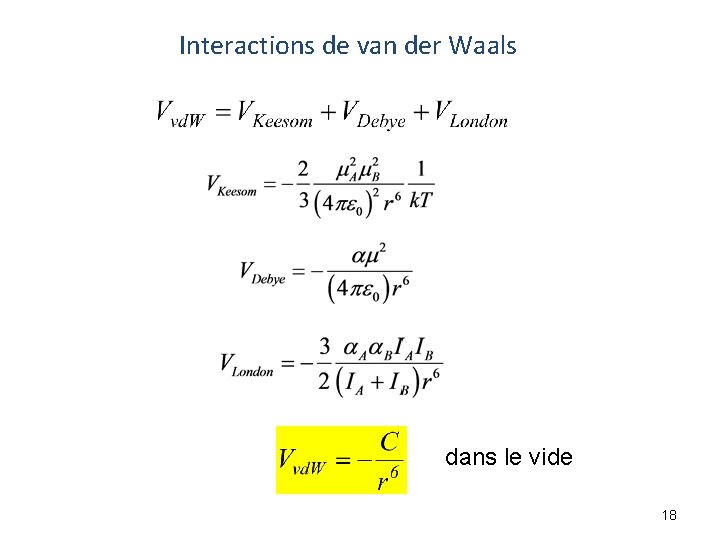
Interactions de van der Waals dans le vide 18

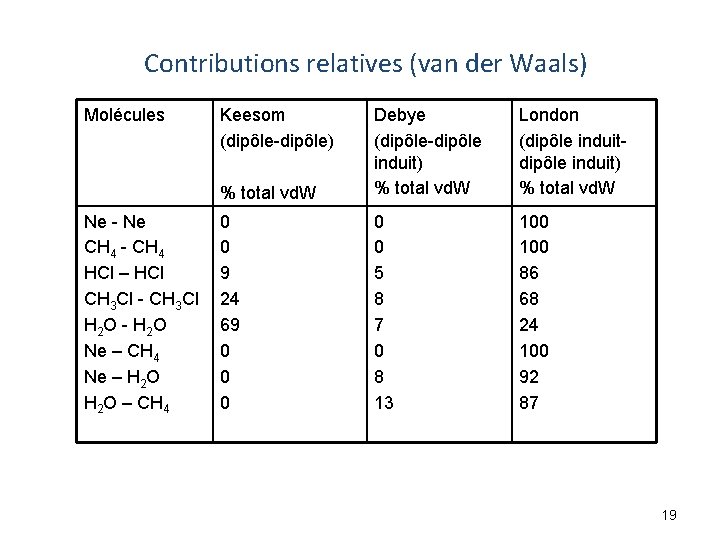
Contributions relatives (van der Waals) Molécules Ne - Ne CH 4 - CH 4 HCl – HCl CH 3 Cl - CH 3 Cl H 2 O - H 2 O Ne – CH 4 Ne – H 2 O – CH 4 Keesom (dipôle-dipôle) % total vd. W Debye (dipôle-dipôle induit) % total vd. W London (dipôle induit) % total vd. W 0 0 9 24 69 0 0 0 5 8 7 0 8 13 100 86 68 24 100 92 87 19

Pour une molécule ou atome 1 interagissant avec une molécule ou atome 2 dans un milieu 3 Théorie de Mc. Lachlan (voir Intermolecular and Surface Forces, Israelachvili) valide pour r>>a (rayon de la molécule) : fréquence d’absorption électronique (la même pour 1, 2 et 3) 20

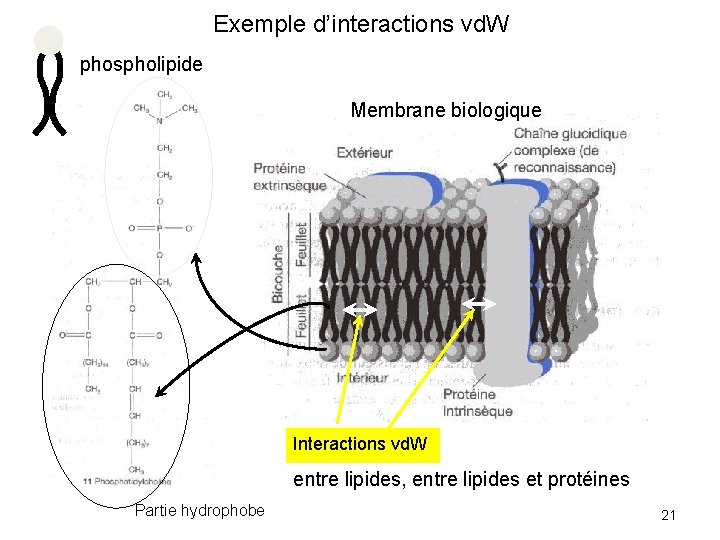
Exemple d’interactions vd. W phospholipide Membrane biologique Interactions vd. W entre lipides, entre lipides et protéines Partie hydrophobe 21

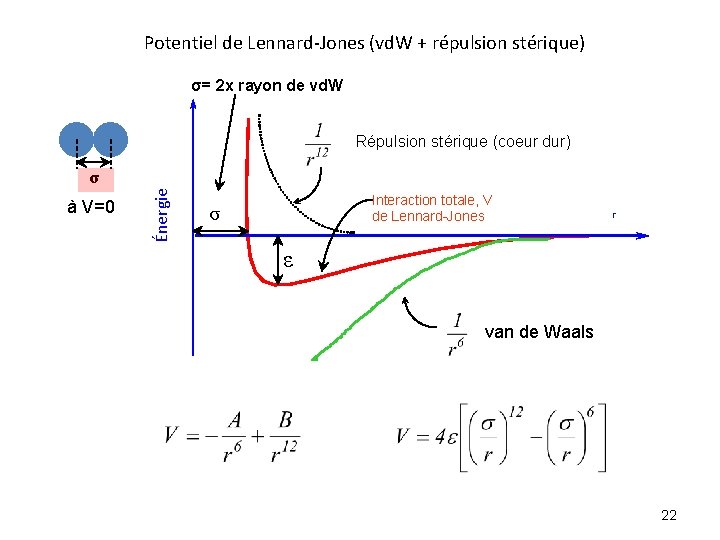
Potentiel de Lennard-Jones (vd. W + répulsion stérique) σ= 2 x rayon de vd. W Répulsion stérique (coeur dur) à V=0 Énergie σ Interaction totale, V de Lennard-Jones σ r ε van de Waals 22

Rayon de van der Waals Atome Rayon (Å) σ/2 H C N O P S F Cl Br I -CH 3 1. 2 1. 5 1. 4 1. 9 1. 85 1. 35 1. 8 1. 95 2. 2 2. 0 distance qui mesure la moitié de la distance internucléaire entre deux atomes non liés (pour une interaction nulle) 23
 Diple microscope
Diple microscope London dispersion
London dispersion Ejemplo de fuerza ion ion
Ejemplo de fuerza ion ion Dipolo dipolo inducido
Dipolo dipolo inducido Que son fuerzas intramoleculares
Que son fuerzas intramoleculares Protein binding interactions
Protein binding interactions Unit 5 macroeconomics lesson 2 activity 45
Unit 5 macroeconomics lesson 2 activity 45 Special interactions
Special interactions Regional and transregional interactions
Regional and transregional interactions Examples of integral product architecture
Examples of integral product architecture Reciprocal recessive epistasis
Reciprocal recessive epistasis Geosphere and biosphere interactions
Geosphere and biosphere interactions