I Unidad Disoluciones segunda parte Profesor Oscar Rozas















- Slides: 16

I Unidad: Disoluciones (segunda parte) Profesor: Oscar Rozas Paredes Curso: 2° medio Asignatura: Química Calama 24 de marzo 2020

importante • Estimado estudiante, desarrolle el presente trabajo, en el cuaderno, no olvide registrar cada calculo que avale su respuesta. Una vez finalizado el trabajo, debe enviar una fotografía de cada resolución a los siguientes correos: orozas@cldv. cl Oscar. rozas 81@gmail. com Fecha de entrega: martes 31 de marzo

Objetivos • Identificar soluto y solvente. • Reconocer disoluciones de acuerdo a la cantidad de soluto • Calcular %m/m y %v/v a distintas disoluciones.

Disoluciones Disolución es una mezcla homogénea y uniforme formada por varias sustancias puras en proporciones variables. Disolvente Soluto El disolvente es la sustancia componente de una disolución, en la que se disuelve el soluto, y que generalmente se encuentra en mayor proporción. Soluto o solutos es la sustancia o sustancias que se disuelven y que generalmente están en menor cantidad.

Clasificación de las disoluciones según estado físico

Clasificación de soluciones de acuerdo a cantidad de soluto Diluida Contiene poca cantidad de soluto respecto a la que podría contener. Concentrada En menor o mayor medida, es la que contiene progresivamente mayor cantidad de soluto. Saturada Contiene todo el soluto que puede disolver a una temperatura determinada. Sobresaturada Contiene más soluto del que corresponde a esa temperatura.

Concentración de una disolución Es la cantidad de soluto disuelta en una cantidad determinada de disolvente o de disolución. Expresiones de la concentración Porcentaje en masa (%m/m) % m/m = porcentaje en volumen (%V/V) % v/v = Concentración en masa (%m/V) % m/v = · 100

Ejemplo: 1 -. ¿Cuál es el porcentaje en volumen del HCl en una disolución que contiene 20 ml de HCl en 50 ml de disolución? Datos: m. L soluto: 20 m. L HCl m. L solución: 50 m. L solución %v/v : ? Desarrollo: %v/v = ml soluto x 100 / ml solución %v/v = 20 x 100 / 50 = 40 % v/v

2 -. Calcular el porcentaje en masa (%m/m) de una solución preparada con 30 gr de HI y 40 gr de agua. Datos: masa soluto: 30 gr HI masa solvente: 40 gr agua %m/m : ? Desarrollo: recordar que soluto + solvente = solución %m/m = g soluto x 100 / g solución %m/m = 30 x 100 / (40 + 30) = 42, 8 %m/m

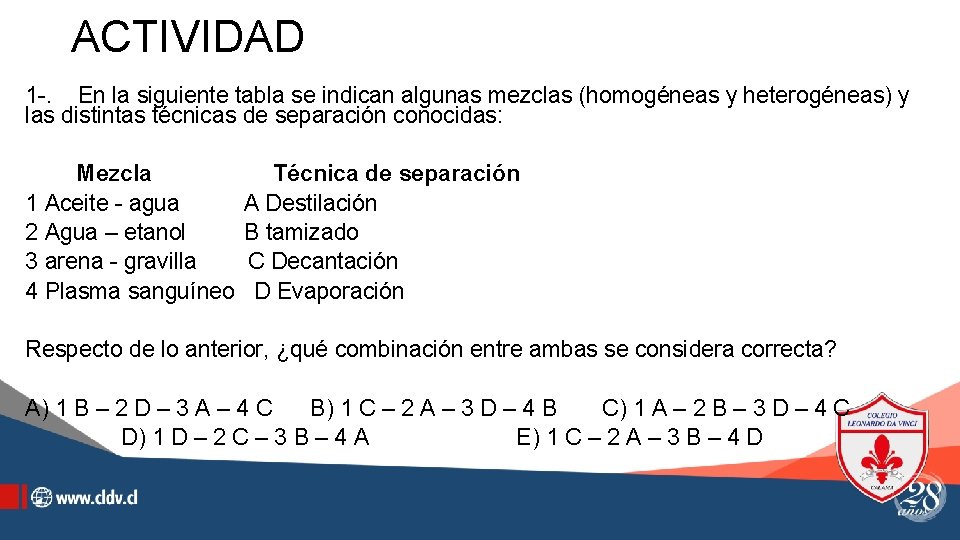
ACTIVIDAD 1 -. En la siguiente tabla se indican algunas mezclas (homogéneas y heterogéneas) y las distintas técnicas de separación conocidas: Mezcla 1 Aceite - agua 2 Agua – etanol 3 arena - gravilla 4 Plasma sanguíneo Técnica de separación A Destilación B tamizado C Decantación D Evaporación Respecto de lo anterior, ¿qué combinación entre ambas se considera correcta? A) 1 B – 2 D – 3 A – 4 C B) 1 C – 2 A – 3 D – 4 B C) 1 A – 2 B – 3 D – 4 C D) 1 D – 2 C – 3 B – 4 A E) 1 C – 2 A – 3 B – 4 D

2 -. Si se disuelven 50 g de sal común en un cuarto de litro (250 g) de agua, ¿cuál es el porcentaje en masa de la sal? A) 5, 6 B) 16, 6 C) 1, 6 D) 8, 6 E) 27, 6 3 -. ¿Cuál es el porcentaje en volúmen del ácido acético en una disolución de un limpiador de vidrios que contiene 40 ml de ácido acético en 650 ml de disolución? A) 2, 4 B) 3, 6 C) 6, 1 D) 8, 2 E) 7, 6

4 -. Calcular el porcentaje en masa (%m/m) de una solución preparada con 20 gr de HCl y 60 gr de agua. A) 20 % B) 25 % C) 30 % D) 33 % E) 40 % 5 -. ¿Cuántos m. L de acetona se debe agregar a 250 m. L de agua para que la solución resulte al 15 % v/v? A) D) 212, 5 m. L 287, 5 m. L B) E) 27, 7 m. L C) 37, 5 m. L otro resultado

6 -. Calcular el porcentaje en volumen (% v/v) de una solución preparada con 4 ml de HBr y 6 ml de agua. A) 10 % B) 15 % C) 20 % D) 30 % E) 40 % 7 -. Una solución solido-liquido se ve ejemplificada por: I Aire A) Solo I II agua mineral B) Solo II III jugo C) Solo III D) I y II E) I y III

8. ¿Cuántos gramos de soluto existen en 20 g de solución para darnos una solución al 25 % m/m? A) 5 g B) 25 g C)15 g D) 9 g E) otro resultado 9 -. A un vaso de agua se le añade una cucharadita de sal y se revuelve hasta su completa disolución. En este caso, el agua se comporta como: A) Un solvente D) Un ácido B) Un soluto E) Neutra C) Una solución

10 -. ¿Qué significa que una preparación de una solución sea del 30% p/p? I indica que la cantidad de solvente es 30 grs II indica que la cantidad de soluto es 30 grs III indica que la cantidad de solvente es 70 grs A) Solo I B) Solo II C) I y II D) II y III E) I, II y III

Autoevaluación. Responda en breves líneas lo siguiente: ¿qué aprendí hoy?
 Segunda unidad en ingles
Segunda unidad en ingles Planificacion social
Planificacion social Rozas
Rozas Sandra ortiz de rozas
Sandra ortiz de rozas Gredos san diego las rozas
Gredos san diego las rozas Ceip los jarales las rozas
Ceip los jarales las rozas Preguntas para el bautismo segunda parte
Preguntas para el bautismo segunda parte Unidad de mil
Unidad de mil Clasificacion de las disoluciones
Clasificacion de las disoluciones Disoluciones
Disoluciones Disolucin
Disolucin Tipos de disoluciones
Tipos de disoluciones De gas a sólido
De gas a sólido Ate disoluciones coloides y suspensiones
Ate disoluciones coloides y suspensiones Ejemplos de coloides
Ejemplos de coloides Tabla comparativa de soluciones coloides y suspensiones
Tabla comparativa de soluciones coloides y suspensiones Concentracion molar
Concentracion molar































