Hoofdstuk 8 Paragraaf 3 Zuren in water Eigenschappen












- Slides: 19

Hoofdstuk 8 Paragraaf 3 Zuren in water

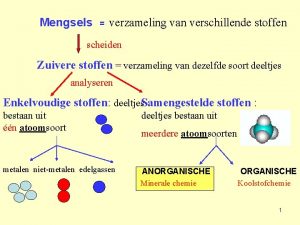
Eigenschappen van zure oplossingen. Alle zure oplossingen hebben een. . . . lage p. H-waarde rood Alle zure oplossingen kleuren rode kool. . . . Alle zure oplossingen moeten dus iets gemeen hebben

Bij elektrolyse van een zure oplossing blijkt dat elke zure oplossing: - de stroom geleidt - aan de – pool er altijd. . . H 2 ontstaat Dus: Elke zure oplossing bevat. . . . vrije ionen Elke zure oplossing bevat. . . H+ ionen

Een H-atoom bestaat uit: 1. . . . p+ en 1 eˉ Een H+ ion bestaat uit: 1. . . p+ Een H+ ion kan niet vrij voorkomen. Het H+ ion bindt zich aan een H 2 O molecuul: +. H O = H. . 2 . . . . H 3 O + + ionen. . . . Een zure oplossing bevat dus: H O 3 Het H 3 O+ ion heet het. . . . oxonium ion

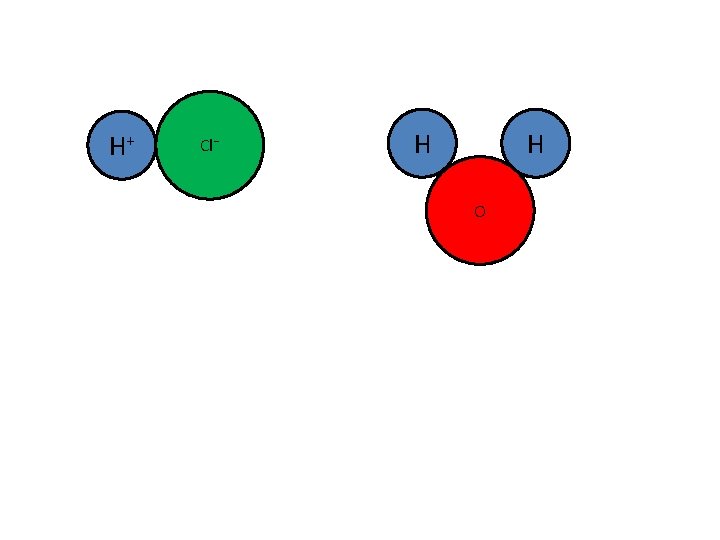
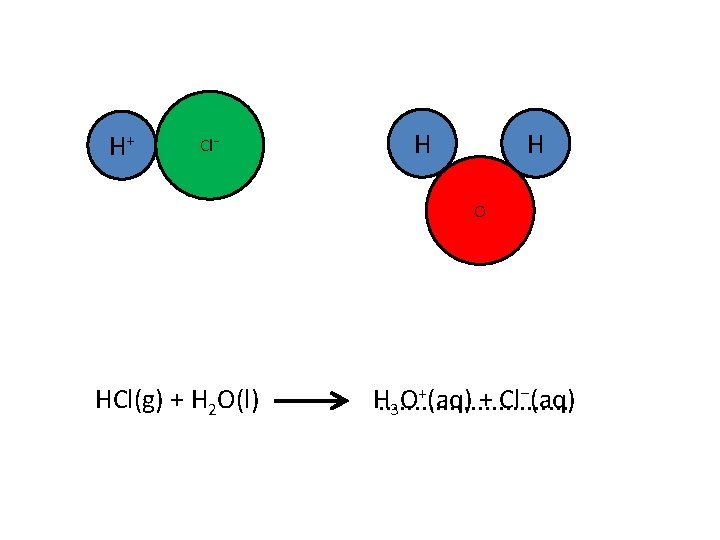
Als je aan neutraal water HCl toevoegt, ontstaat een zure oplossing. + ionen Een zure oplossing bevat H. . . . O 3 HCl moet dus een. . . H+ aan H 2 O hebben gegeven

H+ Cl⁻ H H O

H+ Cl⁻ H H O HCl(g) + H 2 O(l) +(aq) + Cl⁻(aq) H. . . . O 3

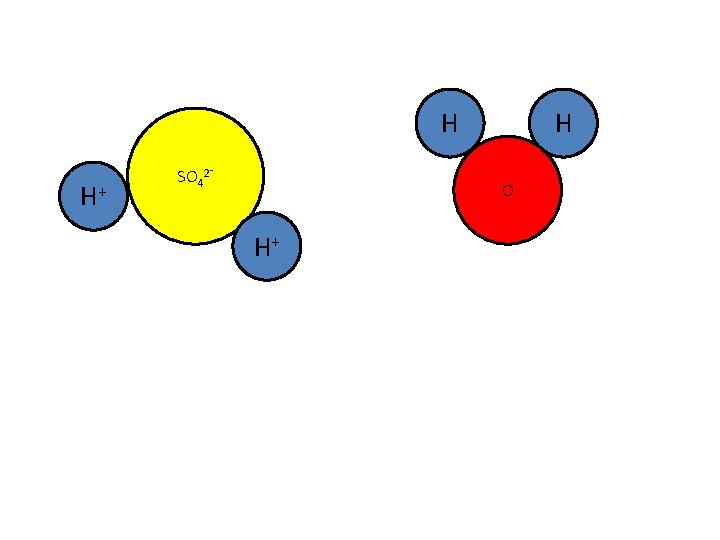
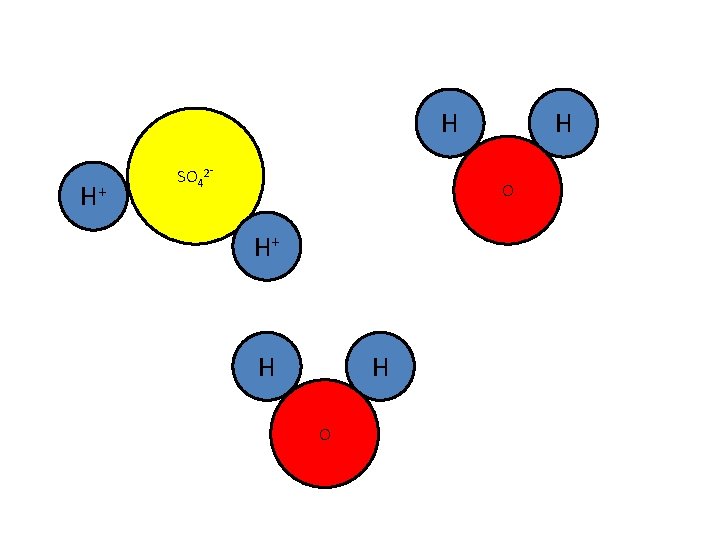
Als je H 2 SO 4 in water oplost, krijg je ook een zure oplossing:

H H+ SO 42⁻ H O H+

H H+ SO 42⁻ H O H+ H H O

In een reactievergelijking: H 2 SO 4(l) + 2 H 2 O(l) 2 H 3 O+(aq) + SO 42⁻(aq). . . .

+(aq) ionen Een zure oplossing bevat dus altijd H. . . O 3

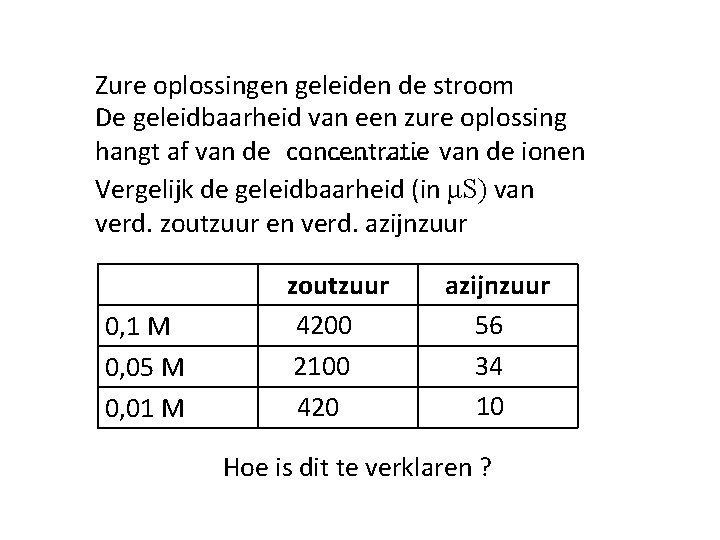
Zure oplossingen geleiden de stroom De geleidbaarheid van een zure oplossing. . . . . van de ionen hangt af van de concentratie Vergelijk de geleidbaarheid (in μS) van verd. zoutzuur en verd. azijnzuur 0, 1 M 0, 05 M 0, 01 M zoutzuur 4200 2100 420 azijnzuur 56 34 10 Hoe is dit te verklaren ?

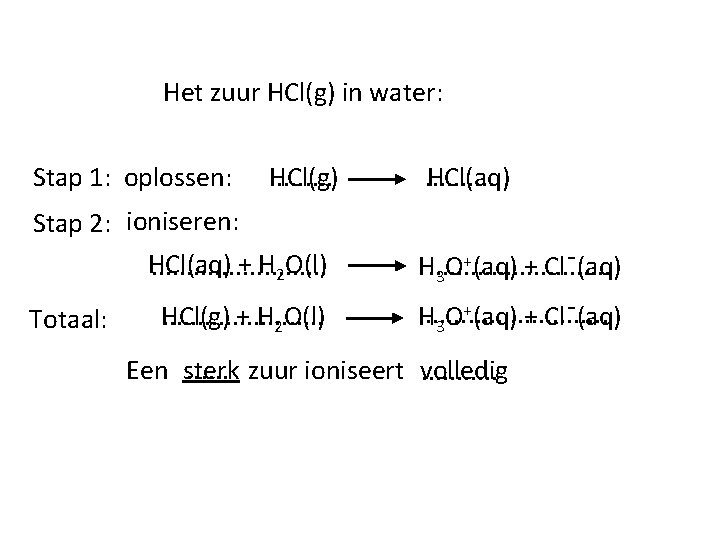
Het zuur HCl(g) in water: Stap 1: oplossen: HCl(g). . . . . HCl(aq) Stap 2: ioniseren: HCl(aq) + H 2 O(l). . . +(aq) + Clˉ(aq) H. . . O 3 HCl(g) + H 2 O(l). . . + H. . . 3 O (aq) + Clˉ(aq) Totaal: . . . zuur ioniseert volledig Een sterk. . .

Het zuur azijnzuur in water: . . oplossen: CH CH 3 COOH(aq). . . . . 3 COOH(l) Stap 2: ioniseren: +(aq) +CH COOˉ(aq) CH COOH(aq) + H O(l) H O. . . . . 3 2 3 3 Stap 1: Een zwak. . . . zuur ioniseert maar voor een klein. . . deel Vandaar dat een oplossing van een zwak zuur de stroom veel minder goed geleidt !!!

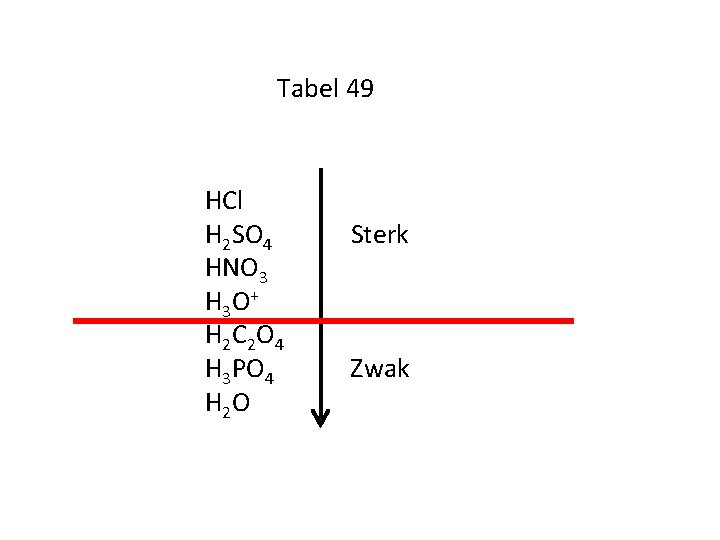
Tabel 49 HCl H 2 SO 4 HNO 3 H 3 O + H 2 C 2 O 4 H 3 PO 4 H 2 O Sterk Zwak

Onthoud: Sterke zuren zijn: Waterstofchloride HCl HNO 3 Salpeterzuur H 2 SO 4 Zwavelzuur

Een oplossing van een sterk zuur noteren we: . . . IN IONEN Een oplossing van een zwak zuur noteren we: . . . IN MOLECULEN

Vul in: Formule zuur HNO 3 H 3 PO 4 H 2 S H 2 SO 4 Notatie oplossing H 3 O+(aq) + NO 3⁻(aq) H 3 PO 4(aq) H 2 S(aq) 2 H 3 O+(aq) + SO 42⁻(aq)
 Zure stoffen
Zure stoffen Kwikdihydroxide
Kwikdihydroxide Zure stoffen
Zure stoffen Paragraaf symbool
Paragraaf symbool Wat is een paragraaf
Wat is een paragraaf Voortplanting bij planten
Voortplanting bij planten Zorgbehoefte vaststellen
Zorgbehoefte vaststellen Water and water and water water
Water and water and water water Stroomsterkte symbool grootheid
Stroomsterkte symbool grootheid Hoofdstuk 6
Hoofdstuk 6 Wiskunde 3 havo
Wiskunde 3 havo Begeleidingsstijlen leerling
Begeleidingsstijlen leerling Belofte van pisa samenvatting
Belofte van pisa samenvatting Noughts and crosses zusammenfassung
Noughts and crosses zusammenfassung Aardrijkskunde hoofdstuk 2 havo 4
Aardrijkskunde hoofdstuk 2 havo 4 Samenvatting bespiegeling hoofdstuk 9 massacultuur
Samenvatting bespiegeling hoofdstuk 9 massacultuur Wiskunde havo 4 hoofdstuk 4
Wiskunde havo 4 hoofdstuk 4 Hoofdstuk in een opera
Hoofdstuk in een opera Diagonalen parallellogram even lang
Diagonalen parallellogram even lang Eigenschappen van hoeken
Eigenschappen van hoeken