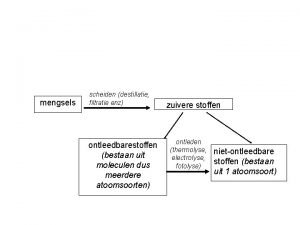
Mengsels verzameling van verschillende stoffen scheiden Zuivere stoffen




























- Slides: 43

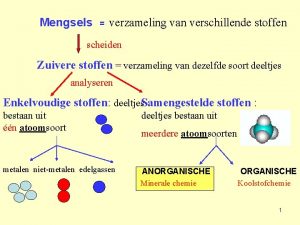
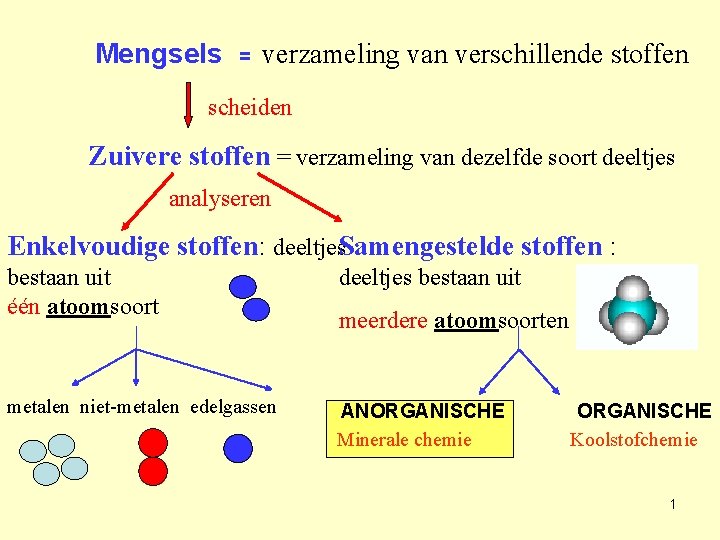
Mengsels = verzameling van verschillende stoffen scheiden Zuivere stoffen = verzameling van dezelfde soort deeltjes analyseren Enkelvoudige stoffen: deeltjes. Samengestelde stoffen : bestaan uit één atoomsoort deeltjes bestaan uit metalen niet-metalen edelgassen ANORGANISCHE Minerale chemie meerdere atoomsoorten ORGANISCHE Koolstofchemie 1

Anorganische verbindingsklassen (p 119) Nieuw: • aangepaste naamgeving • uitbreiding van ‘zuren’ en ‘zouten’ 2

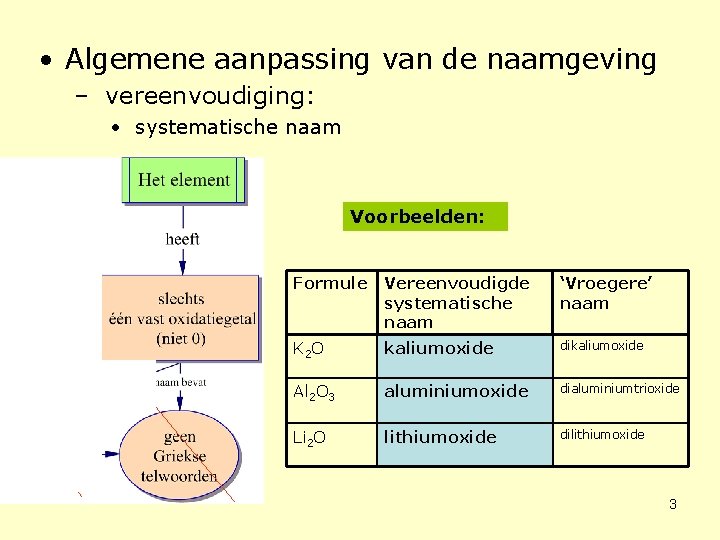
• Algemene aanpassing van de naamgeving – vereenvoudiging: • systematische naam Voorbeelden: Formule Vereenvoudigde systematische naam ‘Vroegere’ naam K 2 O kaliumoxide dikaliumoxide Al 2 O 3 aluminiumoxide dialuminiumtrioxide Li 2 O lithiumoxide dilithiumoxide 3

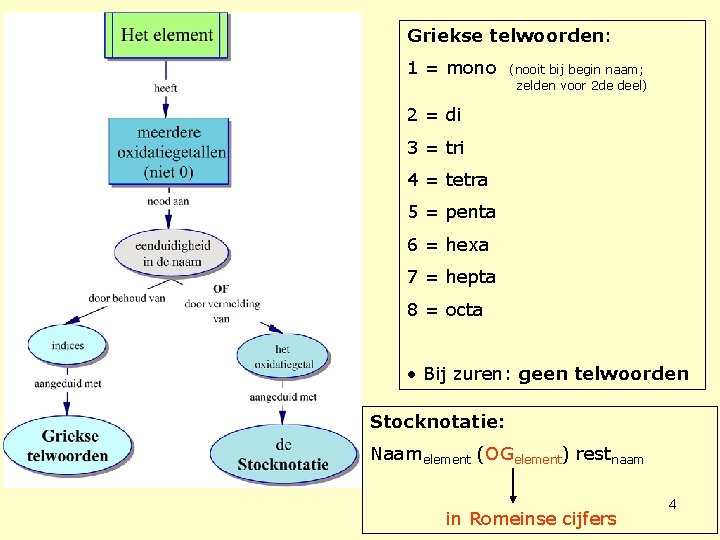
Griekse telwoorden: 1 = mono (nooit bij begin naam; zelden voor 2 de deel) 2 = di 3 = tri 4 = tetra 5 = penta 6 = hexa 7 = hepta 8 = octa • Bij zuren: geen telwoorden Stocknotatie: Naamelement (OGelement) restnaam in Romeinse cijfers 4

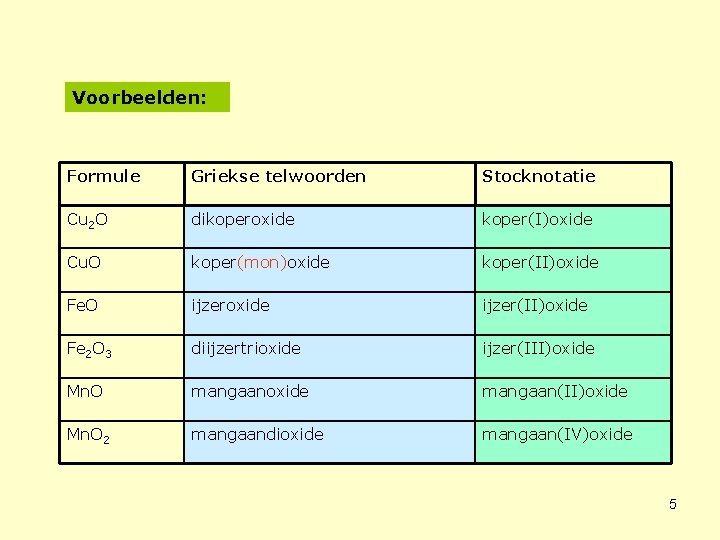
Voorbeelden: Formule Griekse telwoorden Stocknotatie Cu 2 O dikoperoxide koper(I)oxide Cu. O koper(mon)oxide koper(II)oxide Fe. O ijzeroxide ijzer(II)oxide Fe 2 O 3 diijzertrioxide ijzer(III)oxide Mn. O mangaanoxide mangaan(II)oxide Mn. O 2 mangaandioxide mangaan(IV)oxide 5

Samenvatting: 6

OXIDEN (p. 120) 7

Bepalend voor de fysische eigenschappen (p. 121) Bepalend voor de fysische eigenschappen 8

9

Formulevorming • OG = 0 • OGzuurstof = -II • gebruik van kruisregel om n en m te bepalen En Om Naamvorming = (n) naam van het element + (m) oxide • vereenvoudiging waar kan | anders Griekse telwoorden of Stock • Opdrachten Formule Systematische naam Ag 2 O zilveroxide Cl 2 O 3 dichloortrioxide Stocknotatie chloor(III)oxide Pb. O 2 looddioxide lood(IV)oxide P 2 O 3 difosfortrioxide fosfor(III)oxide Sn. O Hg 2 O tinoxide tin (II)oxide dikwikoxide kwik(I)oxide 10

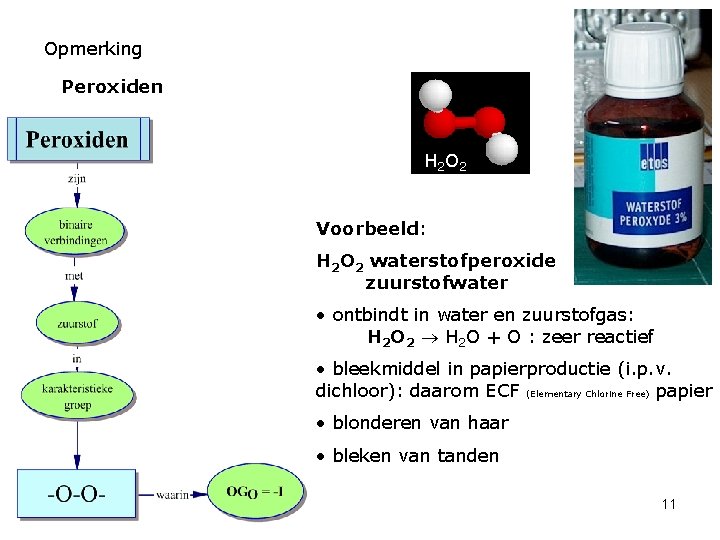
Opmerking Peroxiden H 2 O 2 Voorbeeld: H 2 O 2 waterstofperoxide zuurstofwater • ontbindt in water en zuurstofgas: H 2 O 2 H 2 O + O : zeer reactief • bleekmiddel in papierproductie (i. p. v. dichloor): daarom ECF (Elementary Chlorine Free) papier • blonderen van haar • bleken van tanden 11

• Opdracht Vlekken van donker gekleurde vruchten – bosbessen, rode bessen, kersen, vlierbessen – kun je op twee manieren wegwerken. Heb je vlekken op ongekleurd goed gemaakt, dan leg je de vlek in waterstofperoxide (3%) en druppel je midden op de vlek enkele druppels ammoniak. De vlek zal verdwijnen. Spoel wel goed na. Let wel, gekleurde stoffen kan je op deze manier niet behandelen. Met het wegwerken van de vlek zou je ook de kleurstof van de vezel aantasten. Bij gekleurde stoffen besprenkel je de vlek daarom het beste eerst met vers citroensap voor je ze – direct daarna – een beurt geeft in de wasmachine. Uit KOOK juli/aug 2004 • Leid uit de tekst een eigenschap af van waterstofperoxide. Ontkleuringsmiddel - bleekmiddel • In welke andere gebruiken uit het dagelijkse leven wordt zuurstofwater nog gebruikt omwille van bovenstaande eigenschap? Blonderen van haar – bleken van tanden • Welke andere eigenschap van waterstofperoxide ken je? Ontsmettingsmiddel • Verklaar de gebruiksnaam “zuurstofwater” vanuit de formule van de stof. H 2 O 2 = formule van water H 2 O met extra zuurstofatoom 12

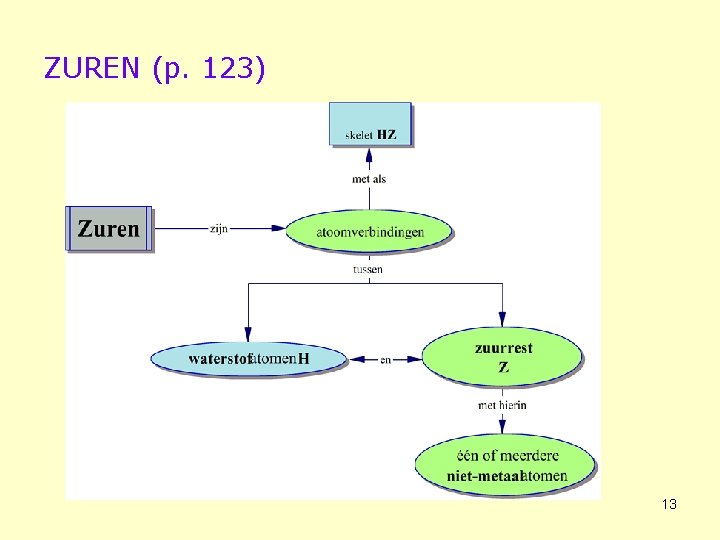
ZUREN (p. 123) 13

• Samenstelling Waardigheid = aantal H-atomen per molecule zuur HCl: éénwaardig zuur; H 2 S: tweewaardig zuur 14

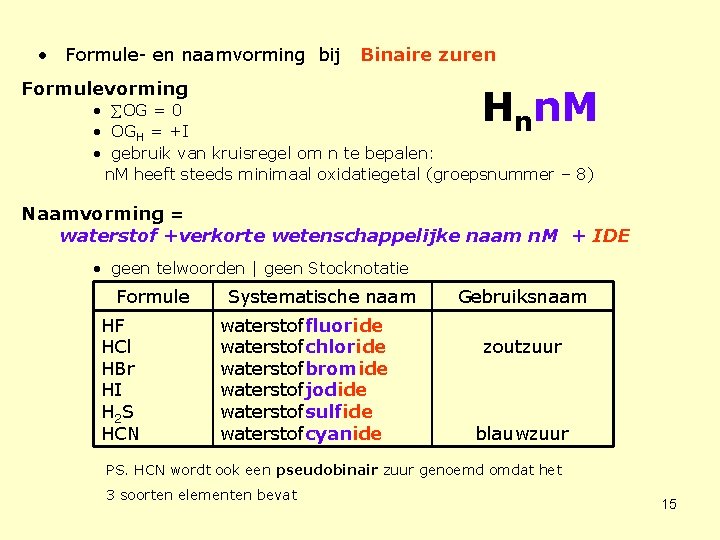
• Formule- en naamvorming bij Binaire zuren Formulevorming Hnn. M • OG = 0 • OGH = +I • gebruik van kruisregel om n te bepalen: n. M heeft steeds minimaal oxidatiegetal (groepsnummer – 8) Naamvorming = waterstof +verkorte wetenschappelijke naam n. M + IDE • geen telwoorden | geen Stocknotatie Formule HF HCl HBr HI H 2 S HCN Systematische naam waterstoffluoride waterstofchloride waterstofbromide waterstofjodide waterstofsulfide waterstofcyanide Gebruiksnaam zoutzuur blauwzuur PS. HCN wordt ook een pseudobinair zuur genoemd omdat het 3 soorten elementen bevat 15

16

• Formule- en naamvorming bij Ternaire zuren Formulevorming Hnn. MOp • OG = 0 • OGH = +I • gebruik van kruisregel om n en p te bepalen: n. M heeft veranderlijk OG: in stamzuur n. M hoogste OG (behalve bij halogenen: in stamzuur OG = +V) Naamvorming = waterstof + verkorte, wetenschappelijke naam n. M + AAT, PER. . . AAT, IET of HYPO. . . IET geen telwoorden | geen Stocknotatie 17

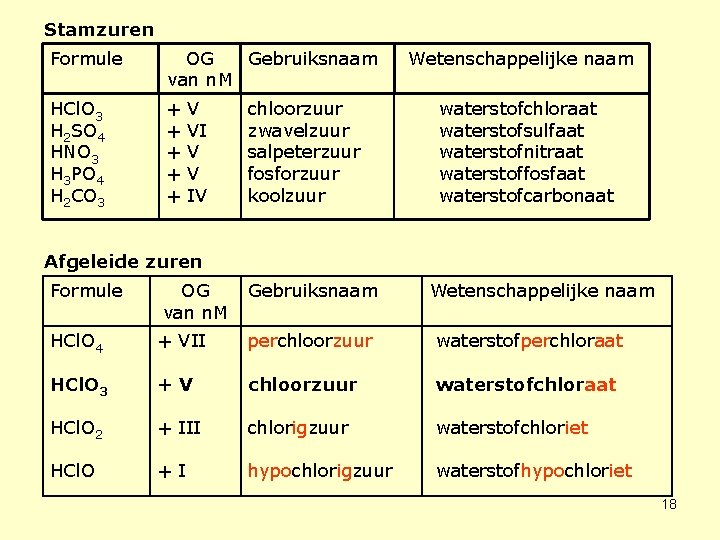
Stamzuren Formule OG Gebruiksnaam van n. M HCl. O 3 H 2 SO 4 HNO 3 H 3 PO 4 H 2 CO 3 + + + V VI V V IV chloorzuur zwavelzuur salpeterzuur fosforzuur koolzuur Wetenschappelijke naam waterstofchloraat waterstofsulfaat waterstofnitraat waterstoffosfaat waterstofcarbonaat Afgeleide zuren Formule OG van n. M Gebruiksnaam Wetenschappelijke naam HCl. O 4 + VII perchloorzuur waterstofperchloraat HCl. O 3 +V chloorzuur waterstofchloraat HCl. O 2 + III chlorigzuur waterstofchloriet HCl. O +I hypochlorigzuur waterstofhypochloriet 18

Meest voorkomende zuren (stamzuren zijn vet gedrukt) Formule Gebruiksnaam Wetenschappelijke naam waterstof + zuurrest HCl. O 4 HCl. O 3 HCl. O 2 HCl. O perchloorzuur chlorigzuur hypochlorigzuur HBr. O 4 HBr. O 3 HBr. O 2 HBr. O perbroomzuur bromigzuur hypobromigzuur HIO 4 HIO 3 HIO 2 HIO perjoodzuur jodigzuur hypojodigzuur Zuurrest O. G. van n. M waterstofperchloraat waterstofchloriet waterstofhypochloriet Cl. O 41 Cl. O 31 Cl. O 21 Cl. O 1 - + VII +V + III +I waterstofperbromaat waterstofbromiet waterstofhypobromiet Br. O 41 Br. O 31 Br. O 21 Br. O 1 - + VII +V + III +I IO 41 IO 31 IO 21 IO 1 - + VII +V + III +I HSO 41 -, SO 42 HSO 31 -, SO 32 - + VI + IV NO 31 NO 21 - +V + III waterstofperjodaat waterstofjodiet waterstofhypojodiet H 2 SO 4 H 2 SO 3 zwavelzuur waterstofsulfaat zwaveligzuur waterstofsulfiet HNO 3 HNO 2 salpeterzuur waterstofnitraat salpeterigzuur waterstofnitriet 19

Formule Gebruiksnaam Wetenschappelijke naam waterstof + zuurrest Zuurrest O. G. van n. M H 3 PO 4 fosforzuur waterstoffosfaat H 2 PO 41 -, HPO 42 -, PO 43 - +V H 3 PO 3 fosforigzuur waterstoffosfiet H 2 PO 31 -, HPO 32 -, PO 33 - + III H 3 PO 2 hypofosforigzuur waterstofhypofosfiet H 2 PO 21 -, HPO 22 -, PO 23 - +I CO 32 HCO 31 - + IV H 2 CO 3 koolzuur waterstofcarbonaat H 4 Si. O 4 kiezelzuur waterstofsilicaat Si. O 44 - e. a. + IV H 3 BO 3 boorzuur waterstofboraat BO 33 - e. a. + III 20

Overgebleven H-atomen in het zuurrest-ion worden aangeduid met Griekse telwoorden Voorbeelden CO 32 - carbonaation HCO 31 - waterstofcarbonaation PO 43 - fosfaation HPO 42 - waterstoffosfaation H 2 PO 41 - diwaterstoffosfaation 21

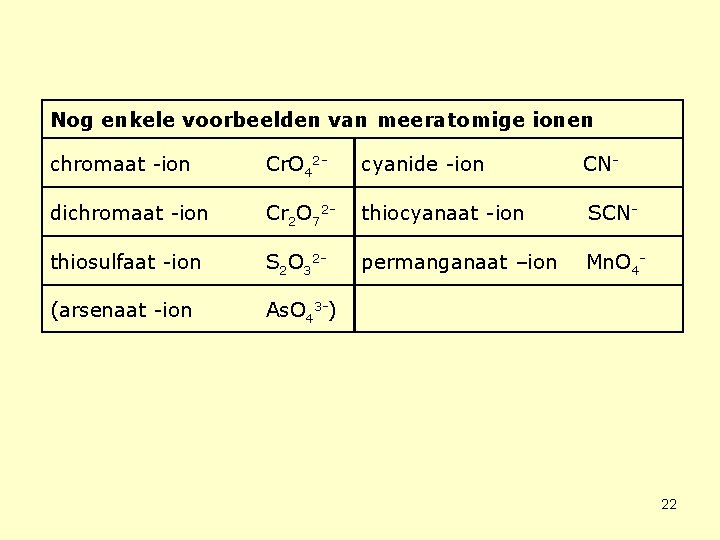
Nog enkele voorbeelden van meeratomige ionen chromaat -ion Cr. O 42 - cyanide -ion CN- dichromaat -ion Cr 2 O 72 - thiocyanaat -ion SCN- thiosulfaat -ion S 2 O 32 - permanganaat –ion Mn. O 4 - (arsenaat -ion As. O 43 -) 22

• Omschrijf de betekenis van onderstaande gevarenlogo’s HCl HCN T+ T+ = zeer giftig F+ F+ = zeer licht ontvlambaar HCl Xi = irriterend Xn Xn = schadelijk O oxiderend E explosief C corrosief N milieugevaarlijk 23

HYDROXIDEN = BASEN (p. 127) 24

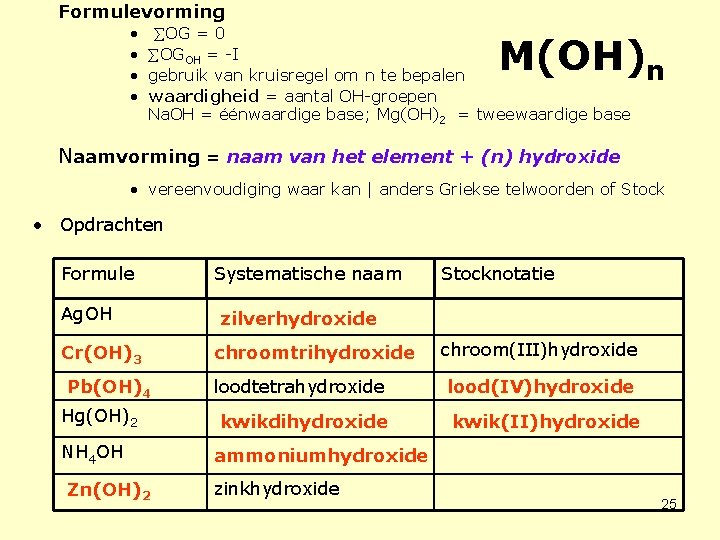
Formulevorming • • OG = 0 OGOH = -I gebruik van kruisregel om n te bepalen waardigheid = aantal OH-groepen Na. OH = éénwaardige base; Mg(OH)2 = tweewaardige base M(OH)n Naamvorming = naam van het element + (n) hydroxide • vereenvoudiging waar kan | anders Griekse telwoorden of Stock • Opdrachten Formule Ag. OH Cr(OH)3 Pb(OH)4 Hg(OH)2 NH 4 OH Zn(OH)2 Systematische naam Stocknotatie zilverhydroxide chroomtrihydroxide chroom(III)hydroxide loodtetrahydroxide lood(IV)hydroxide kwikdihydroxide kwik(II)hydroxide ammoniumhydroxide zinkhydroxide 25

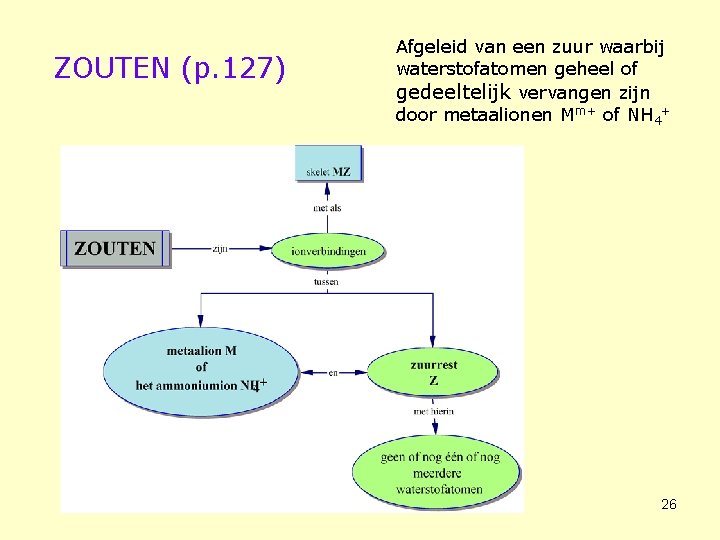
ZOUTEN (p. 127) Afgeleid van een zuur waarbij waterstofatomen geheel of gedeeltelijk vervangen zijn door metaalionen Mm+ of NH 4+ 26

27

• Formule- en naamvorming bij Binaire zouten Mn(n. M)m bij Ternaire zouten Formulevorming Mn[n. MOp]m • OG = 0 • OGM en OGzuurrest moeten gekend zijn • gebruik van kruisregel om n en m te bepalen: Naamvorming = (n) naam van het metaal + (m) naam van de zuurrest • telwoorden | Stocknotatie indien M meerdere OG heeft • Opmerkingen : waterstofzouten bevatten nog het element waterstof in de zuurrest vb. Na. H 2 PO 4 natriumdiwaterstoffosfaat : dubbelzouten afgeleid van een meerwaardig zuur waarbij de waterstofatomen door twee metaalatomen vervangen zijn KNa. SO 3 kaliumnatriumsulfiet 28

29

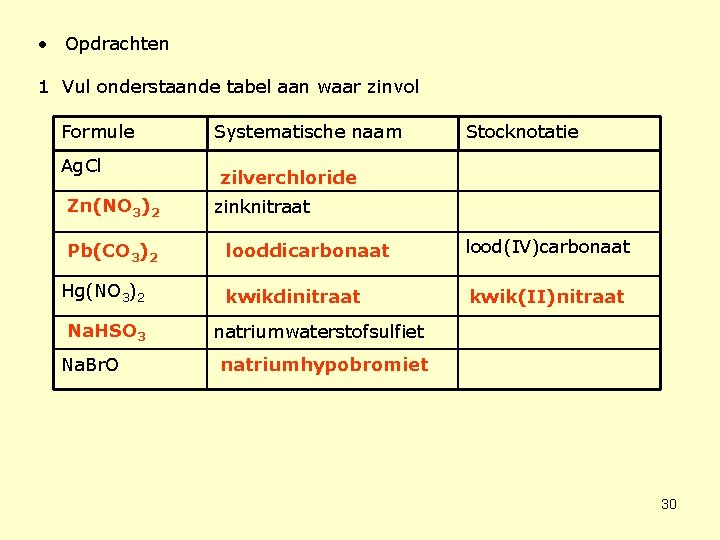
• Opdrachten 1 Vul onderstaande tabel aan waar zinvol Formule Ag. Cl Zn(NO 3)2 Pb(CO 3)2 Hg(NO 3)2 Na. HSO 3 Na. Br. O Systematische naam Stocknotatie zilverchloride zinknitraat looddicarbonaat lood(IV)carbonaat kwikdinitraat kwik(II)nitraat natriumwaterstofsulfiet natriumhypobromiet 30

• Onderstreep in de tekst de naam van twee waterstofzouten. • Schrijf de formule van deze twee zouten (NH 4)HCO 3 • Wat is de functie van deze twee waterstofzouten. Na. HCO 3 rijsmiddel • Welk gas komt vrij bij verhitten van deze twee zouten? CO 2 koolstofdioxide • In natriumwaterstofcarbonaat en ammoniumwaterstofcarbonaat wordt de term waterstof vaak vervangen door een ander tussenvoegsel. Welke? Zoek eens op de verpakking van allerhande koekjes. bi : ammoniumbicarbonaat - natriumbicarbonaat • Onder welke gebruiksnaam is natriumwaterstofcarbonaat beter gekend? Zuiveringszout - maagpoeder - bakpoeder 31

• Een beetje geschiedenis … ‘Javel’ 32

Ons bleekwater, ook wel “javel” genoemd, bestaat tweehonderd jaar. Na zovele jaren is het nog steeds één van de betere desinfecterende middelen. Javel is wel zo gewoon geworden dat we nauwelijks nog stilstaan bij de wondere eigenschappen van dit huis-, tuin- en keukenmiddeltje. Het water van Javel vindt zijn oorsprong in de textielindustrie waar het gebruikt werd om stoffen te bleken. Gedurende eeuwen was linnen gebleekt op de traditionele manier: wassen, uitspreiden op het gras en enkele malen per dag nat sproeien. In 1790 toonde de chemicus Berthollet aan dat het blekende effect veroorzaakt werd door zuurstof in de lucht. Het bleken kwam dus voort uit een oxidatie-reductie-reactie en hij zocht een manier om het wat sneller te doen. Na wat zoeken vond hij natriumhypochloriet. Het werd dadelijk “water van Javel” genoemd naar de plaats waar het eerste fabriekje stond. Het werd al snel duidelijk dat je met javel meer kon doen dan stoffen bleken. Apothekers ontdekten zijn ontsmettende eigenschappen en de ontsmettingsmiddelen die vandaag in de hospitalen gebruikt worden zijn nog steeds afgeleid van het zure hypochloriet. Tijdens de eerste WO zat het Franse leger zonder betrouwbaar drinkwater aan de frontlinie in Verdun. Een generaal vermengde een klein beetje javel met water van de Maas, om zijn belegerde troepen toch te kunnen laven zonder ze aan allerhande infecties bloot te stellen. Twee druppels javel in een karaf zijn voldoende om elk besmettingsgevaar te bannen. De smaak gaat er natuurlijk wel wat op achteruit… 33

Eén van de minder fraaie toepassingen van de chemie is het gebruik van chloorgas als gifgas in WO I. Het klinkt misschien onwaarschijnlijk, maar ook nu worden nog mensen door chloorgas aangetast, soms zelfs met dodelijke afloop. In dit geval zijn het geen militairen maar ijverige huisvrouwen of mannen die het toilet eens een extra schoonmaakbeurt willen geven. Hierbij gebruiken ze (ondanks de waarschuwing in de verbruikersinfo) zowel bleekwater om te ontsmetten als zoutzuur of mierenzuur of citroenzuur om te ontkalken. 34

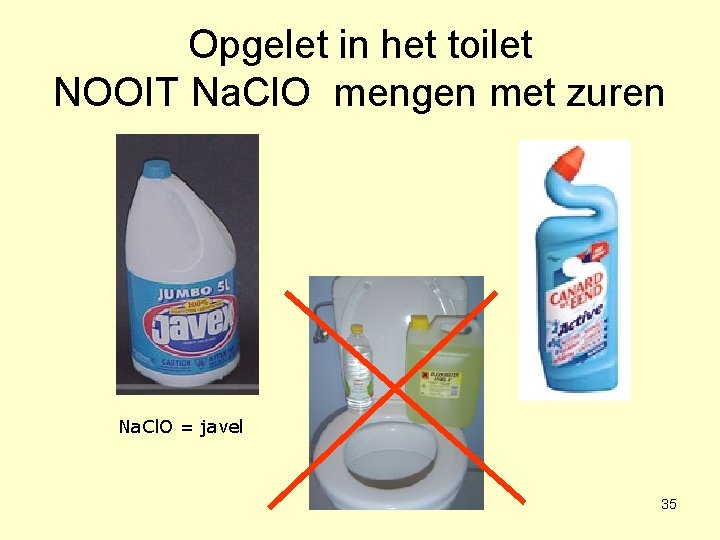
Opgelet in het toilet NOOIT Na. Cl. O mengen met zuren Na. Cl. O = javel 35

Demonstratieproef We slaan de waarschuwing even in de wind en voegen – onder de trekkast- een beetje bleekwater samen met wat ontkalker (WCeend). Noteer je waarneming en schrijf de bijbehorende reactievergelijking Een gebeurt een gasontwikkeling – de geur van dichloor is waarneembaar Na. Cl. O + 2 HCl Na. Cl + H 2 O + Cl 2 • Onderstreep in bovenstaande teksten / etiket alle eigenschappen van bleekwater. • Verbeter in de etiketten twee fouten in de naam en/of formule van de vermelde chemische stoffen. Wateroplossing – waterige oplossing Chl – Cl Na. OCl – Na. Cl. O Chloor – dichloor eigenlijk juist • Welke stof bedoelt men met het zure hypochloriet. Waterstofhypochloriet HCl. O 36

37

38

Taak: anorganische verbindingen rondom ons www. periodieksysteem. com Formule Ca. CO 3 Ag. NO 3 Systematische naam + Stocknotatie (indien mogelijk) calciumcarbonaat zilvernitraat Gebruiksnaam kalksteen /// Si. O 2 siliciumoxide Toepassing en/of gebruik en/of voorkomen Marmeren venstertabletten Wegbranden van wratten Zand is het basiselement van glas. Zand bevat siliciumoxide dat de glasstructuur maakt. Het zand van de Kempen is uitstekend geschikt voor het maken van glas want het is zuiver, de korrels voldoende groot en het bevat weinig ijzer (dat het glas kleurt). Stofklasse Ternair zout metaaloxide Bron : Colruyt Info Greenline n° 14 Keukenzout: Na. Cl natriumchloride op smaak brengen van gerechten Binair zout 39

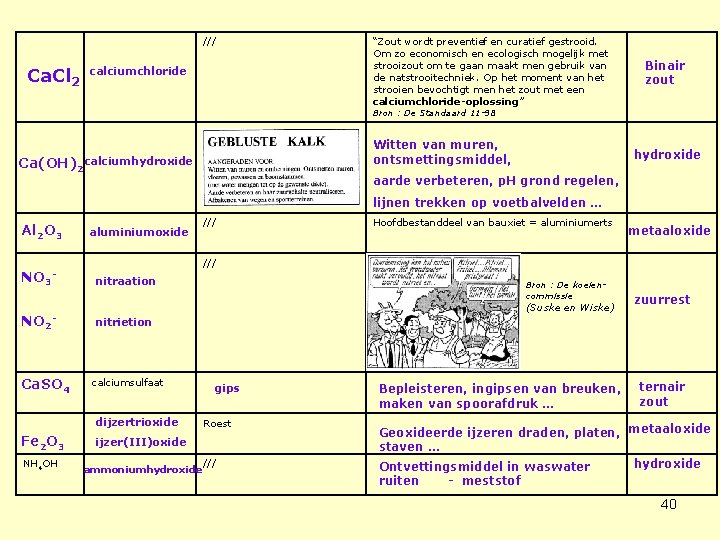
/// Ca. Cl 2 calciumchloride “Zout wordt preventief en curatief gestrooid. Om zo economisch en ecologisch mogelijk met strooizout om te gaan maakt men gebruik van de natstrooitechniek. Op het moment van het strooien bevochtigt men het zout met een calciumchloride-oplossing” Binair zout Bron : De Standaard 11 -98 Witten van muren, ontsmettingsmiddel, Ca(OH)2 calciumhydroxide aarde verbeteren, p. H grond regelen, lijnen trekken op voetbalvelden … Al 2 O 3 NO 3 - NO 2 - Ca. SO 4 aluminiumoxide NH 4 OH Hoofdbestanddeel van bauxiet = aluminiumerts metaaloxide /// nitraation Bron : De koeiencommissie (Suske en Wiske) zuurrest nitrietion calciumsulfaat dijzertrioxide Fe 2 O 3 /// gips Roest ijzer(III)oxide ammoniumhydroxide /// Bepleisteren, ingipsen van breuken, maken van spoorafdruk … ternair zout Geoxideerde ijzeren draden, platen, metaaloxide staven … hydroxide Ontvettingsmiddel in waswater ruiten - meststof 40

Na 2 CO 3 Ca. O HCl CO 2 SO 2 Cu. SO 4 natriumcarbonaat ternair zout soda /// Polijstmiddel in tandpasta calciumcarbonaat calciumoxide waterstofchloride koolstofdioxide Ongebluste kalk zoutzuur -zuur in de maag -zuur gebruikt in ontkalkers Koolzuur – ‘acide’ zwavel(IV)oxide absorbant voor CO 2 – maken van gebluste kalk /// Bron : etiket BOXER bruisend water Uitlaatgas van auto’s, industrie – een oorzaak van zure regen kopersulfaat /// Schimmelbestrijder – onkruidbestrijder - algenbestrijder ternair zout metaaloxide binair zuur nietmetaaloxide ternair zout 41

Na. OH natriumhydroxide Bijtende soda Bron : De Standaard 30 -11 -98 H 2 S waterstofsulfide /// Geur rotte eieren binair zuur Narcosemiddel – N 2 O Roesmiddel( drug) distikstofoxide In gaspatronen slagroomspuiten stikstof(I)oxide /// CO koolstofmonoxide koolstof(II)oxide niet-metaal -oxide Dood bij kachel Twee personen stierven in hun woning in Gent, omdat een butaanbrander alle zuurstofgas in de woonkamer opgebruikt had. In Atembeke stikte een tienjarig meisje in een badkamer die verwarmd werd met een gasbrander, waarvan de verluchtingspijp dichtgestopt was om de koude buiten te houden. Eveneens in de badkamer stierf een meisje in Hamme. Ook hier was de oorzaak een onvoldoende geventileerde gasbrander. niet-metaal -oxide Bron : De Standaard 2/3 -1 -93 H 2 CO 3 waterstofcarbonaat koolzuur In bier - champagne Ternair zuur 42

43
 Indampen
Indampen Ternair zout gips
Ternair zout gips Oefeningen op scheidingstechnieken
Oefeningen op scheidingstechnieken Soorten mengsels
Soorten mengsels Programma scheiden zonder schade
Programma scheiden zonder schade Bedankt werkbegeleider
Bedankt werkbegeleider Trapjesgrafiek
Trapjesgrafiek Welke twee hoofdsoorten van activiteiten zijn er
Welke twee hoofdsoorten van activiteiten zijn er Soorten begeleidingsstijlen
Soorten begeleidingsstijlen Verschillende bladeren
Verschillende bladeren Schrijfdoelen
Schrijfdoelen Persoonlijke interesses
Persoonlijke interesses Zuilen soorten
Zuilen soorten Verschillende actoren
Verschillende actoren Verschillende schrijfdoelen
Verschillende schrijfdoelen Verschillende markten
Verschillende markten Proportionalisme
Proportionalisme Domeinen geschiedenis
Domeinen geschiedenis Teksstructuren
Teksstructuren Economielokaal
Economielokaal Grafiek oligopolie
Grafiek oligopolie Verschillende soorten gesprekken
Verschillende soorten gesprekken Rautekgreep
Rautekgreep Wat is een botverbinding
Wat is een botverbinding Anorganische stoffen
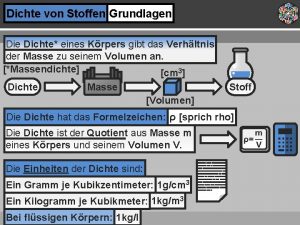
Anorganische stoffen Dichten von stoffen
Dichten von stoffen Welke stoffen lossen op in water
Welke stoffen lossen op in water Atoomrooster diamant
Atoomrooster diamant Zuurconstante tabel
Zuurconstante tabel Etiketten gevaarlijke stoffen
Etiketten gevaarlijke stoffen Regulerende stoffen
Regulerende stoffen Onderdompelingsmethode
Onderdompelingsmethode Natriumwaterstofoxalaat formule
Natriumwaterstofoxalaat formule Zelfontbrandingstemperatuur hout
Zelfontbrandingstemperatuur hout Zure stoffen
Zure stoffen Covalentie van stikstof
Covalentie van stikstof Biologische stoffen vca
Biologische stoffen vca Ruhe stoffen
Ruhe stoffen Doorsnede wortel
Doorsnede wortel Szfaja
Szfaja Wet van behoud van energie
Wet van behoud van energie Van go or van goff
Van go or van goff Levenscyclus koolwitje
Levenscyclus koolwitje Trappe van vergelyking
Trappe van vergelyking