HIV Glasgow 2020 virtual HIV Drug Therapy Glasgow





- Slides: 29

HIV Glasgow 2020 (virtual) HIV Drug Therapy Glasgow, UK 5 – 8 Octubre 2020

Advertencia de ACC VIH sobre el uso de estas diapositivas • Estas diapositivas se han realizado, bajo la coordinación de un grupo de colaboradores independientes, que han revisado los estudios más relevantes presentados en el Congreso Glasgow 2020, que ha tenido lugar en formato virtual del 5 -8 de octubre de 2020. • • Expresamos nuestro agradecimiento a los autores de los trabajos presentados. • • El contenido de este material refleja el punto de vista de los autores y no el de ACC VIH. Estas diapositivas pueden ser utilizadas, con fines docentes y de formación, en sus presentaciones por aquellos médicos o investigadores que lo deseen. Sin embargo, se ruega no cambiar el contenido ni la atribución de las mismas. Esta actividad docente puede contener datos sobre fármacos o productos que no estén aprobados por la EMEA y las autoridades sanitarias españolas o de otros países. ACC VIH no recomienda utilizar ningún fármaco fuera de las recomendaciones realizadas por dichos organismos. Por ello, ACC VIH advierte a los lectores que deben consultar las recomendaciones y las informaciones que proporcionan las autoridades sanitarias, los comités de expertos y los fabricantes de los diferentes productos sobre la correcta utilización de los fármacos (indicaciones, dosificaciones, contraindicaciones, efectos adversos, interacciones, etc).

ÍNDICE • Ensayos clínicos • Estudios de cohortes • Comorbilidades Congreso 2020

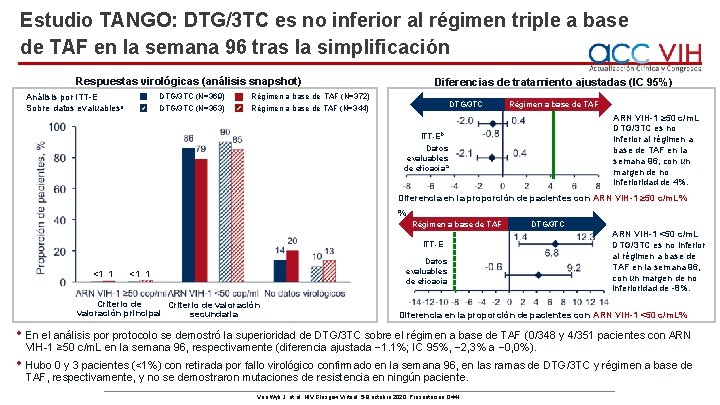
Estudio TANGO: DTG/3 TC es no inferior al régimen triple a base de TAF en la semana 96 tras la simplificación Respuestas virológicas (análisis snapshot) Análisis por ITT-E Sobre datos evaluablesa DTG/3 TC (N=369) DTG/3 TC (N=353) Diferencias de tratamiento ajustadas (IC 95%) Régimen a base de TAF (N=372) Régimen a base de TAF (N=344) DTG/3 TC Régimen a base de TAF ARN VIH-1 ≥ 50 c/m. L DTG/3 TC es no inferior al régimen a base de TAF en la semana 96, con un margen de no inferioridad de 4%. ITT-Eb Datos evaluables de eficacia a Diferencia en la proporción de pacientes con ARN VIH-1 ≥ 50 c/m. L% % Régimen a base de TAF DTG/3 TC ITT-E <1 1 Datos evaluables de eficacia <1 1 Criterio de valoración principal secundaria ARN VIH-1 <50 c/m. L DTG/3 TC es no inferior al régimen a base de TAF en la semana 96, con un margen de no inferioridad de -8%. Diferencia en la proporción de pacientes con ARN VIH-1 <50 c/m. L% • En el análisis por protocolo se demostró la superioridad de DTG/3 TC sobre el régimen a base de TAF (0/348 y 4/351 pacientes con ARN VIH-1 ≥ 50 c/m. L en la semana 96, respectivamente (diferencia ajustada − 1. 1%; IC 95%, − 2, 3% a − 0, 0%). • Hubo 0 y 3 pacientes (<1%) con retirada por fallo virológico confirmado en la semana 96, en las ramas de DTG/3 TC y régimen a base de TAF, respectivamente, y no se demostraron mutaciones de resistencia en ningún paciente. Van Wyk J, et al. HIV Glasgow Virtual. 5 -8 octubre 2020; Presentación O 441.

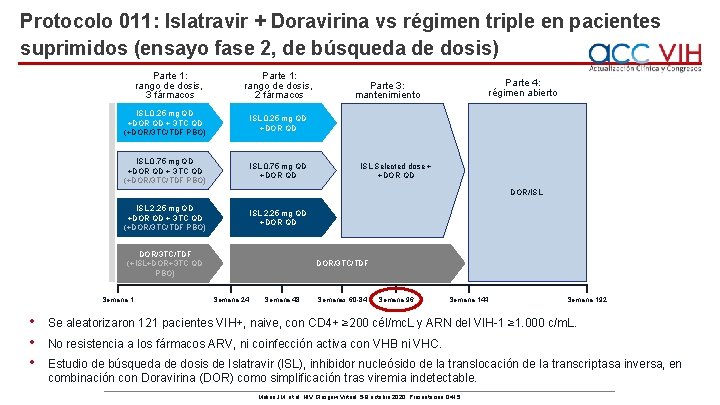
Protocolo 011: Islatravir + Doravirina vs régimen triple en pacientes suprimidos (ensayo fase 2, de búsqueda de dosis) Parte 1: rango de dosis, 3 fármacos Parte 1: rango de dosis, 2 fármacos ISL 0, 25 mg QD +DOR QD + 3 TC QD (+DOR/3 TC/TDF PBO) ISL 0, 25 mg QD +DOR QD ISL 0, 75 mg QD +DOR QD + 3 TC QD (+DOR/3 TC/TDF PBO) ISL 0, 75 mg QD +DOR QD Parte 4: régimen abierto Parte 3: mantenimiento ISL Selected dose + +DOR QD DOR/ISL 2, 25 mg QD +DOR QD + 3 TC QD (+DOR/3 TC/TDF PBO) ISL 2, 25 mg QD +DOR QD DOR/3 TC/TDF (+ISL+DOR+3 TC QD PBO) Semana 1 • • • DOR/3 TC/TDF Semana 24 Semana 48 Semanas 60 -84 Semana 96 Semana 144 Semana 192 Se aleatorizaron 121 pacientes VIH+, naive, con CD 4+ ≥ 200 cél/mc. L y ARN del VIH-1 ≥ 1. 000 c/m. L. No resistencia a los fármacos ARV, ni coinfección activa con VHB ni VHC. Estudio de búsqueda de dosis de Islatravir (ISL), inhibidor nucleósido de la translocación de la transcriptasa inversa, en combinación con Doravirina (DOR) como simplificación tras viremia indetectable. Molina JM, et al. HIV Glasgow Virtual. 5 -8 octubre 2020; Presentación O 415.

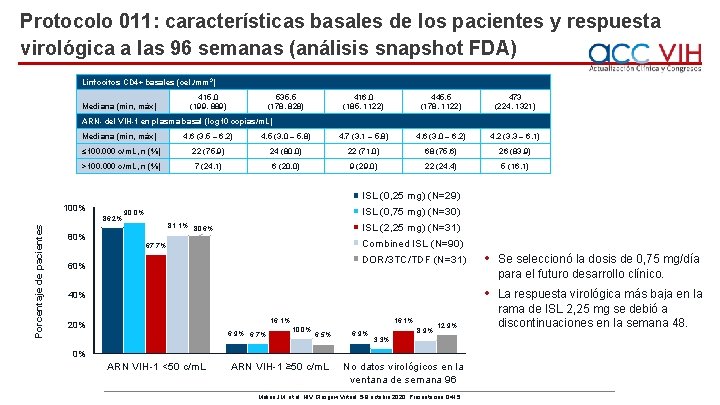
Protocolo 011: características basales de los pacientes y respuesta virológica a las 96 semanas (análisis snapshot FDA) Linfocitos CD 4+ basales (cel. /mm 3) Mediana (mín, máx) 415, 0 (199, 889) 535, 5 (178, 828) 416, 0 (185, 1122) 445, 5 (178, 1122) 473 (224, 1321) ARN- del VIH-1 en plasma basal (log 10 copias/m. L) Mediana (mín, máx) 4, 6 (3, 5 – 6, 2) 4, 5 (3, 0 – 5, 8) 4, 7 (3, 1 – 5, 8) 4, 6 (3, 0 – 6, 2) 4, 2 (3, 3 – 6, 1) ≤ 100. 000 c/m. L, n (%) 22 (75, 9) 24 (80, 0) 22 (71, 0) 68 (75, 6) 26 (83, 9) >100. 000 c/m. L, n (%) 7 (24, 1) 6 (20, 0) 9 (29, 0) 22 (24, 4) 5 (16, 1) ISL (0, 25 mg) (N=29) 100% Porcentaje de pacientes 86, 2% 80% ISL (0, 75 mg) (N=30) 90, 0% ISL (2, 25 mg) (N=31) 81, 1% 80, 6% Combined ISL (N=90) 67, 7% DOR/3 TC/TDF (N=31) 60% 40% 16, 1% 20% 6, 9% 6, 7% 16, 1% 10, 0% 6, 5% 6, 9% 8, 9% 12, 9% 3, 3% 0% ARN VIH-1 <50 c/m. L ARN VIH-1 ≥ 50 c/m. L No datos virológicos en la ventana de semana 96 Molina JM, et al. HIV Glasgow Virtual. 5 -8 octubre 2020; Presentación O 415. • Se seleccionó la dosis de 0, 75 mg/día para el futuro desarrollo clínico. • La respuesta virológica más baja en la rama de ISL 2, 25 mg se debió a discontinuaciones en la semana 48.

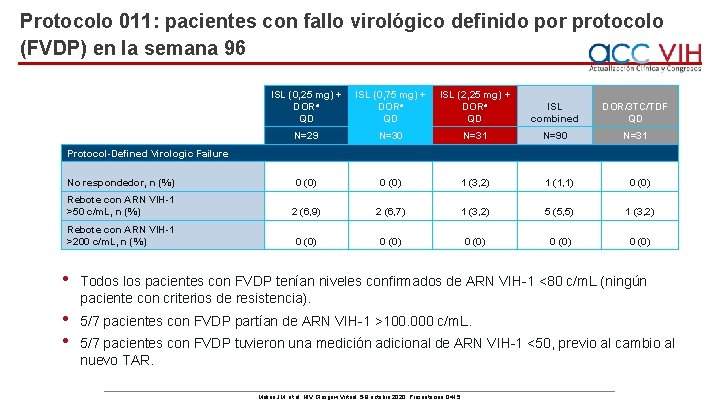
Protocolo 011: pacientes con fallo virológico definido por protocolo (FVDP) en la semana 96 ISL (0, 25 mg) + DORa QD ISL (0, 75 mg) + DORa QD ISL (2, 25 mg) + DORa QD ISL combined DOR/3 TC/TDF QD N=29 N=30 N=31 N=90 N=31 No respondedor, n (%) 0 (0) 1 (3, 2) 1 (1, 1) 0 (0) Rebote con ARN VIH-1 >50 c/m. L, n (%) 2 (6, 9) 2 (6, 7) 1 (3, 2) 5 (5, 5) 1 (3, 2) Rebote con ARN VIH-1 >200 c/m. L, n (%) 0 (0) 0 (0) Protocol-Defined Virologic Failure • Todos los pacientes con FVDP tenían niveles confirmados de ARN VIH-1 <80 c/m. L (ningún paciente con criterios de resistencia). • • 5/7 pacientes con FVDP partían de ARN VIH-1 >100. 000 c/m. L. 5/7 pacientes con FVDP tuvieron una medición adicional de ARN VIH-1 <50, previo al cambio al nuevo TAR. Molina JM, et al. HIV Glasgow Virtual. 5 -8 octubre 2020; Presentación O 415.

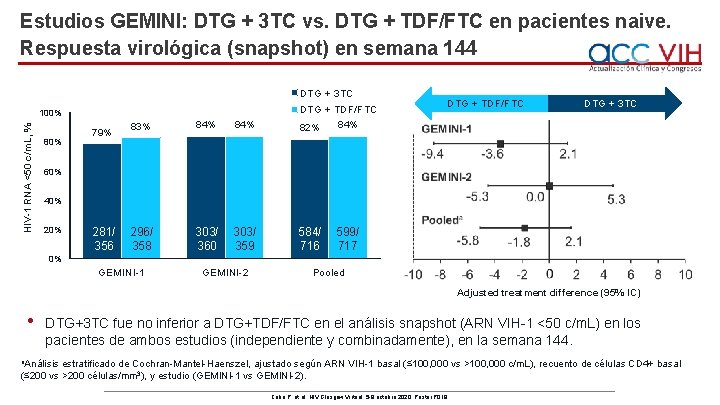
Estudios GEMINI: DTG + 3 TC vs. DTG + TDF/FTC en pacientes naive. Respuesta virológica (snapshot) en semana 144 DTG + 3 TC 83% 84% DTG + TDF/FTC 84% 82% 296/ 358 303/ 360 303/ 359 584/ 716 HIV-1 RNA <50 c/m. L, % 100% 80% 79% DTG + TDF/FTC DTG + 3 TC 60% 40% 281/ 356 599/ 717 0% GEMINI-1 GEMINI-2 Pooled Adjusted treatment difference (95% IC) • DTG+3 TC fue no inferior a DTG+TDF/FTC en el análisis snapshot (ARN VIH-1 <50 c/m. L) en los pacientes de ambos estudios (independiente y combinadamente), en la semana 144. a. Análisis estratificado de Cochran-Mantel-Haenszel, ajustado según ARN VIH-1 basal (≤ 100, 000 vs >100, 000 c/m. L), recuento de células CD 4+ basal (≤ 200 vs >200 células/mm 3), y estudio (GEMINI-1 vs GEMINI-2). Cahn P, et al. HIV Glasgow Virtual. 5 -8 octubre 2020; Poster P 018.

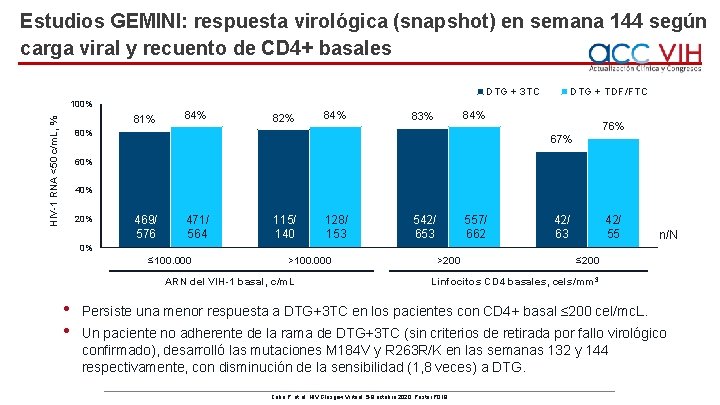
Estudios GEMINI: respuesta virológica (snapshot) en semana 144 según carga viral y recuento de CD 4+ basales DTG + 3 TC 100% HIV-1 RNA <50 c/m. L, % 81% 84% 82% 84% DTG + TDF/FTC 84% 83% 80% 76% 67% 60% 40% 20% 469/ 576 471/ 564 115/ 140 128/ 153 542/ 653 557/ 662 42/ 63 42/ 55 n/N 0% ≤ 100. 000 >100. 000 ARN del VIH-1 basal, c/m. L • • >200 ≤ 200 Linfocitos CD 4 basales, cels/mm 3 Persiste una menor respuesta a DTG+3 TC en los pacientes con CD 4+ basal ≤ 200 cel/mc. L. Un paciente no adherente de la rama de DTG+3 TC (sin criterios de retirada por fallo virológico confirmado), desarrolló las mutaciones M 184 V y R 263 R/K en las semanas 132 y 144 respectivamente, con disminución de la sensibilidad (1, 8 veces) a DTG. Cahn P, et al. HIV Glasgow Virtual. 5 -8 octubre 2020; Poster P 018.

Estudio STAT: DTG/3 TC como régimen de inicio “Test and Treat” en pacientes de reciente diagnóstico de infección VIH • 131 pacientes adultos (16 centros), diagnosticados de infección VIH en los 14 días previos a su inclusión en el estudio, que no disponían de la analítica al comenzar con DTG/3 TC. Características inmunovirológicas basales de los pacientes ARN del VIH-1, mediana (rango), c/m. L, n (%) a, b <100. 000 to <500. 000 to <1, 000 ≥ 1, 000 Recuento de CD 4+, mediana (rango), células/mm 3 b <200, n (%) DTG/3 TC (N=131) 63. 056 (<40 to 68. 706, 840)c 79 (60) 32 (24) 9 (7) 10 (8) 389, 0 (<20 to 1466)d 37 (28) Co-infección VHB, n (%)b, e 7 (5) Mutación de resistencia M 184 V, n (%)b 1 (<1) a 1 (<1%) paciente carecía de resultados basales de ARN VIH-1. las muestras basales, en la semana 1 se conocieron la carga viral del VIH-1, el recuento de CD 4+ y la posible co-infección por VHB, y la resistencia basal en la semana 4. c. Límite inferior de cuantificación <40. d. Límite inferior de cuantificación <20. e 2 pacientes con co-infección por VHB continuaron con DTG/3 TC. b. De Rolle CP, et al. HIV Glasgow Virtual, 5 -8 octubre, 2020; Poster P 020.

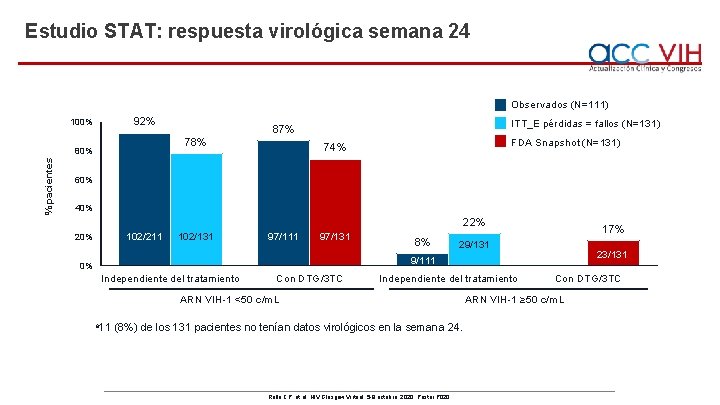
Estudio STAT: respuesta virológica semana 24 Observados (N=111) 92% 100% 78% % pacientes 80% ITT_E pérdidas = fallos (N=131) 87% FDA Snapshot (N=131) 74% 60% 40% 22% 102/211 20% 102/131 97/111 97/131 8% 17% 29/131 23/131 9/111 0% Independiente del tratamiento Con DTG/3 TC Independiente del tratamiento ARN VIH-1 <50 c/m. L a 11 (8%) de los 131 pacientes no tenían datos virológicos en la semana 24. Rolle CP, et al. HIV Glasgow Virtual, 5 -8 octubre, 2020; Poster P 020. Con DTG/3 TC ARN VIH-1 ≥ 50 c/m. L

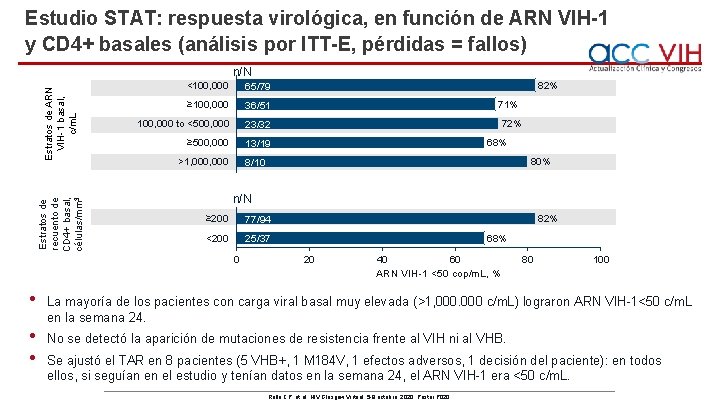
Estudio STAT: respuesta virológica, en función de ARN VIH-1 y CD 4+ basales (análisis por ITT-E, pérdidas = fallos) Estratos de recuento de CD 4+ basal, células/mm 3 Estratos de ARN VIH-1 basal, c/m. L n/N <100, 000 65/79 ≥ 100, 000 36/51 100, 000 to <500, 000 23/32 ≥ 500, 000 13/19 82% 71% 72% 68% 8/10 >1, 000 80% n/N ≥ 200 77/94 <200 25/37 0 82% 68% 20 40 60 80 100 ARN VIH-1 <50 cop/m. L, % • La mayoría de los pacientes con carga viral basal muy elevada (>1, 000 c/m. L) lograron ARN VIH-1<50 c/m. L en la semana 24. • • No se detectó la aparición de mutaciones de resistencia frente al VIH ni al VHB. Se ajustó el TAR en 8 pacientes (5 VHB+, 1 M 184 V, 1 efectos adversos, 1 decisión del paciente): en todos ellos, si seguían en el estudio y tenían datos en la semana 24, el ARN VIH-1 era <50 c/m. L. Rolle CP, et al. HIV Glasgow Virtual, 5 -8 octubre, 2020; Poster P 020.

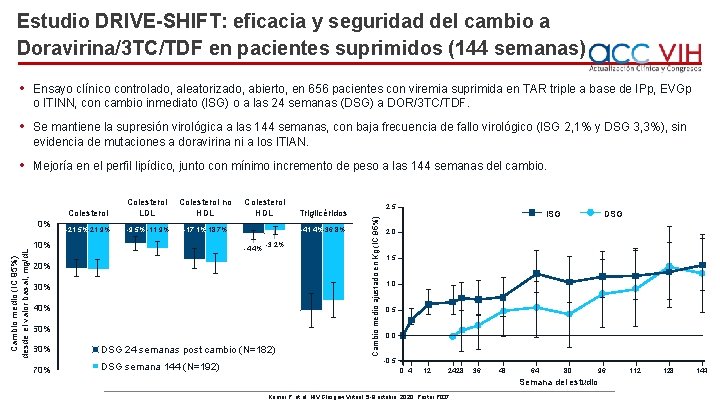
Estudio DRIVE-SHIFT: eficacia y seguridad del cambio a Doravirina/3 TC/TDF en pacientes suprimidos (144 semanas) • Ensayo clínico controlado, aleatorizado, abierto, en 656 pacientes con viremia suprimida en TAR triple a base de IPp, EVGp o ITINN, con cambio inmediato (ISG) o a las 24 semanas (DSG) a DOR/3 TC/TDF. • Se mantiene la supresión virológica a las 144 semanas, con baja frecuencia de fallo virológico (ISG 2, 1% y DSG 3, 3%), sin evidencia de mutaciones a doravirina ni a los ITIAN. • Mejoría en el perfil lipídico, junto con mínimo incremento de peso a las 144 semanas del cambio. Colesterol LDL Colesterol no HDL -21, 5%-21, 9% -9, 5% -11, 9% -17, 1%-18, 7% Cambio medio (IC 95%) desde el valor basal, mg/d. L -10% Colesterol HDL Triglicéridos -41, 4%-36, 8% -4, 4% -3, 2% -20% -30% -40% -50% -60% DSG 24 semanas post cambio (N=182) -70% DSG semana 144 (N=192) 2, 5 Cambio medio ajustado en Kg (IC 95%) 0% Colesterol ISG DSG 2, 0 1, 5 1, 0 0, 5 0, 0 -0, 5 0 4 12 2428 36 48 64 80 96 Semana del estudio Kumar P, et al. HIV Glasgow Virtual, 5 -8 octubre, 2020; Poster P 037. 112 128 144

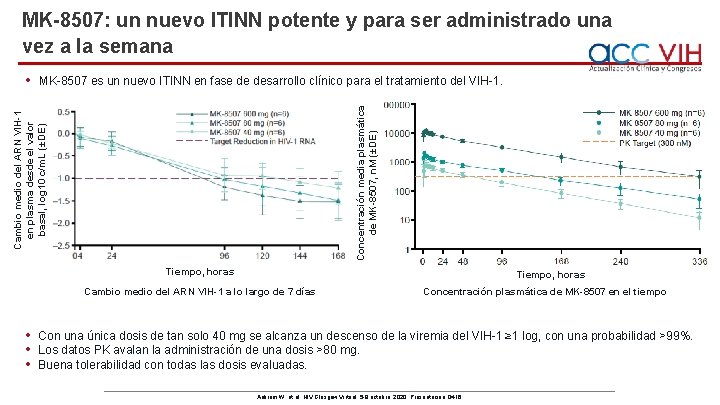
MK-8507: un nuevo ITINN potente y para ser administrado una vez a la semana Concentración media plasmática de MK-8507, n. M (±DE) MK-8507 es un nuevo ITINN en fase de desarrollo clínico para el tratamiento del VIH-1. Cambio medio del ARN VIH-1 en plasma desde el valor basal, log 10 c/m. L (±DE) • Tiempo, horas Cambio medio del ARN VIH-1 a lo largo de 7 días • • • Concentración plasmática de MK-8507 en el tiempo Con una única dosis de tan solo 40 mg se alcanza un descenso de la viremia del VIH-1 ≥ 1 log, con una probabilidad >99%. Los datos PK avalan la administración de una dosis >80 mg. Buena tolerabilidad con todas las dosis evaluadas. Ankrom W, et al. HIV Glasgow Virtual, 5 -8 octubre, 2020; Presentación O 416.

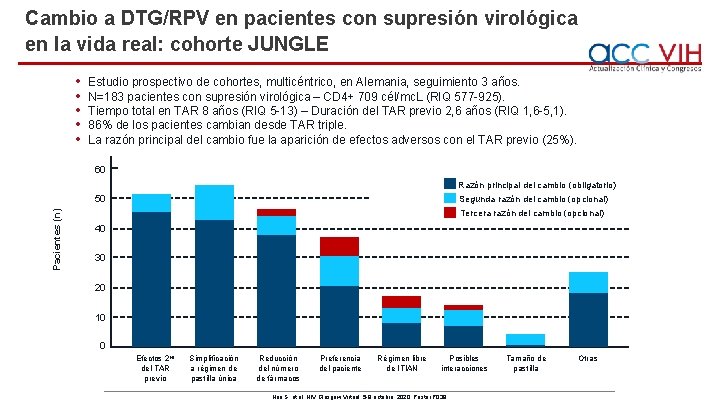
Cambio a DTG/RPV en pacientes con supresión virológica en la vida real: cohorte JUNGLE • • • Estudio prospectivo de cohortes, multicéntrico, en Alemania, seguimiento 3 años. N=183 pacientes con supresión virológica – CD 4+ 709 cél/mc. L (RIQ 577 -925). Tiempo total en TAR 8 años (RIQ 5 -13) – Duración del TAR previo 2, 6 años (RIQ 1, 6 -5, 1). 86% de los pacientes cambian desde TAR triple. La razón principal del cambio fue la aparición de efectos adversos con el TAR previo (25%). 60 Razón principal del cambio (obligatorio) Pacientes (n) 50 Segunda razón del cambio (opcional) Tercera razón del cambio (opcional) 40 30 20 10 0 Efectos 2 os del TAR previo Simplificación a régimen de pastilla única Reducción del número de fármacos Preferencia del paciente Régimen libre de ITIAN Posibles interacciones Noe S, et al. HIV Glasgow Virtual, 5 -8 octubre, 2020; Poster P 039. Tamaño de pastilla Otras

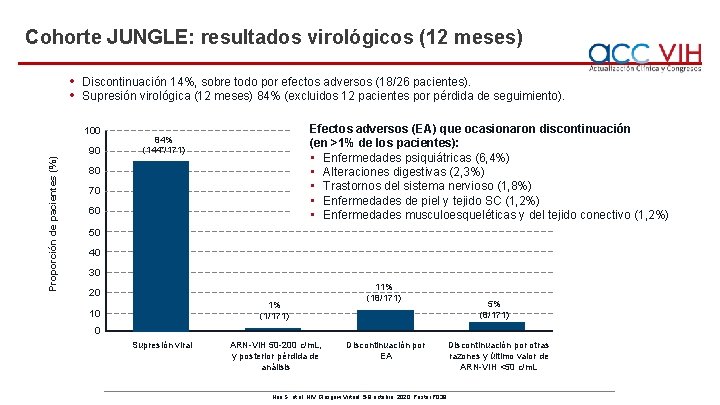
Cohorte JUNGLE: resultados virológicos (12 meses) • • Discontinuación 14%, sobre todo por efectos adversos (18/26 pacientes). Supresión virológica (12 meses) 84% (excluidos 12 pacientes por pérdida de seguimiento). 100 Proporción de pacientes (%) 90 Efectos adversos (EA) que ocasionaron discontinuación (en >1% de los pacientes): • Enfermedades psiquiátricas (6, 4%) • Alteraciones digestivas (2, 3%) • Trastornos del sistema nervioso (1, 8%) • Enfermedades de piel y tejido SC (1, 2%) • Enfermedades musculoesqueléticas y del tejido conectivo (1, 2%) 84% (144*/171) 80 70 60 50 40 30 20 1% (1/171) 10 11% (18/171) 5% (8/171) 0 Supresión viral ARN-VIH 50 -200 c/m. L, y posterior pérdida de análisis Discontinuación por EA Discontinuación por otras razones y último valor de ARN-VIH <50 c/m. L Noe S, et al. HIV Glasgow Virtual, 5 -8 octubre, 2020; Poster P 039.

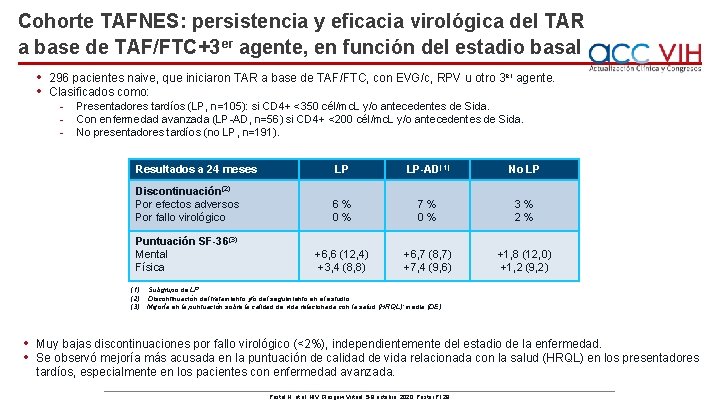
Cohorte TAFNES: persistencia y eficacia virológica del TAR a base de TAF/FTC+3 er agente, en función del estadio basal • • 296 pacientes naive, que iniciaron TAR a base de TAF/FTC, con EVG/c, RPV u otro 3 er agente. Clasificados como: - Presentadores tardíos (LP, n=105): si CD 4+ <350 cél/mc. L y/o antecedentes de Sida. - Con enfermedad avanzada (LP-AD, n=56) si CD 4+ <200 cél/mc. L y/o antecedentes de Sida. - No presentadores tardíos (no LP, n=191). Resultados a 24 meses LP LP-AD(1) No LP Discontinuación(2) Por efectos adversos Por fallo virológico 6% 0% 7% 0% 3% 2% Puntuación SF-36(3) Mental Física +6, 6 (12, 4) +3, 4 (8, 8) +6, 7 (8, 7) +7, 4 (9, 6) +1, 8 (12, 0) +1, 2 (9, 2) (1) (2) (3) • • Subgrupo de LP. Discontinuación del tratamiento y/o del seguimiento en el estudio. Mejoría en la puntuación sobre la calidad de vida relacionada con la salud (HRQL); media (DE). Muy bajas discontinuaciones por fallo virológico (<2%), independientemente del estadio de la enfermedad. Se observó mejoría más acusada en la puntuación de calidad de vida relacionada con la salud (HRQL) en los presentadores tardíos, especialmente en los pacientes con enfermedad avanzada. Postel N, et al. HIV Glasgow Virtual, 5 -8 octubre, 2020; Poster P 129.

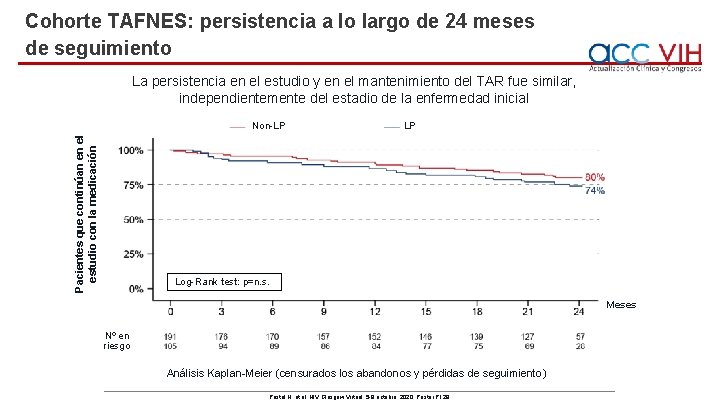
Cohorte TAFNES: persistencia a lo largo de 24 meses de seguimiento La persistencia en el estudio y en el mantenimiento del TAR fue similar, independientemente del estadio de la enfermedad inicial Pacientes que continúan en el estudio con la medicación Non-LP LP Log-Rank test: p=n. s. Meses Nº en riesgo Análisis Kaplan-Meier (censurados los abandonos y pérdidas de seguimiento) Postel N, et al. HIV Glasgow Virtual, 5 -8 octubre, 2020; Poster P 129.

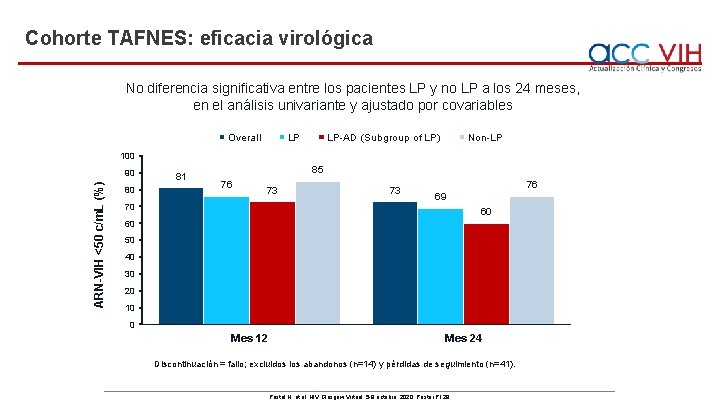
Cohorte TAFNES: eficacia virológica No diferencia significativa entre los pacientes LP y no LP a los 24 meses, en el análisis univariante y ajustado por covariables Overall LP LP-AD (Subgroup of LP) Non-LP 100 ARN-VIH <50 c/m. L (%) 90 80 81 85 76 73 70 73 76 69 60 60 50 40 30 20 10 0 Mes 12 Mes 24 Discontinuación = fallo; excluidos los abandonos (n=14) y pérdidas de seguimiento (n=41). Postel N, et al. HIV Glasgow Virtual, 5 -8 octubre, 2020; Poster P 129.

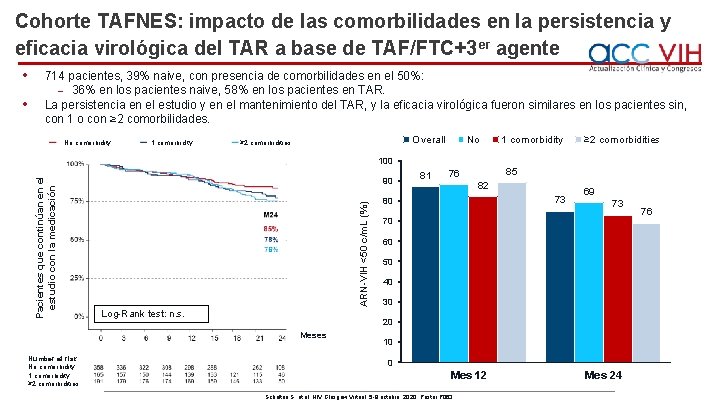
Cohorte TAFNES: impacto de las comorbilidades en la persistencia y eficacia virológica del TAR a base de TAF/FTC+3 er agente No comorbidity 1 comorbidity Overall ≥ 2 comorbidities No 1 comorbidity ≥ 2 comorbidities 100 90 ARN-VIH <50 c/m. L (%) • 714 pacientes, 39% naive, con presencia de comorbilidades en el 50%: ˗ 36% en los pacientes naive, 58% en los pacientes en TAR. La persistencia en el estudio y en el mantenimiento del TAR, y la eficacia virológica fueron similares en los pacientes sin, con 1 o con ≥ 2 comorbilidades. Pacientes que continúan en el estudio con la medicación • Log-Rank test: n. s. 85 76 82 73 80 69 73 70 60 50 40 30 20 Meses Number at risk No comorbidity 1 comorbidity ≥ 2 comorbidities 81 10 0 Mes 12 Scholten S, et al. HIV Glasgow Virtual, 5 -8 octubre, 2020; Poster P 063. Mes 24 76

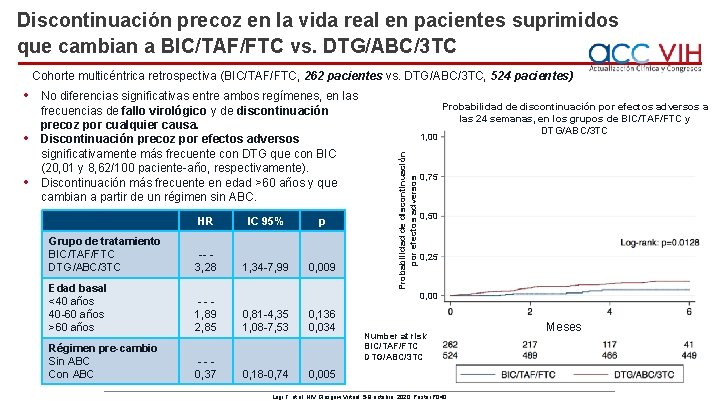
Discontinuación precoz en la vida real en pacientes suprimidos que cambian a BIC/TAF/FTC vs. DTG/ABC/3 TC Cohorte multicéntrica retrospectiva (BIC/TAF/FTC, 262 pacientes vs. DTG/ABC/3 TC, 524 pacientes) • • No diferencias significativas entre ambos regímenes, en las frecuencias de fallo virológico y de discontinuación precoz por cualquier causa. Discontinuación precoz por efectos adversos significativamente más frecuente con DTG que con BIC (20, 01 y 8, 62/100 paciente-año, respectivamente). Discontinuación más frecuente en edad >60 años y que cambian a partir de un régimen sin ABC. HR IC 95% p Grupo de tratamiento BIC/TAF/FTC DTG/ABC/3 TC -- 3, 28 1, 34 -7, 99 0, 009 Edad basal <40 años 40 -60 años >60 años --1, 89 2, 85 0, 81 -4, 35 1, 08 -7, 53 0, 136 0, 034 Régimen pre-cambio Sin ABC Con ABC --0, 37 0, 18 -0, 74 0, 005 1, 00 Probabilidad de discontinuación por efectos adversos • Probabilidad de discontinuación por efectos adversos a las 24 semanas, en los grupos de BIC/TAF/FTC y DTG/ABC/3 TC 0, 75 0, 50 0, 25 0, 00 Number at risk BIC/TAF/FTC DTG/ABC/3 TC Lagi F, et al. HIV Glasgow Virtual, 5 -8 octubre, 2020; Poster P 040. Meses

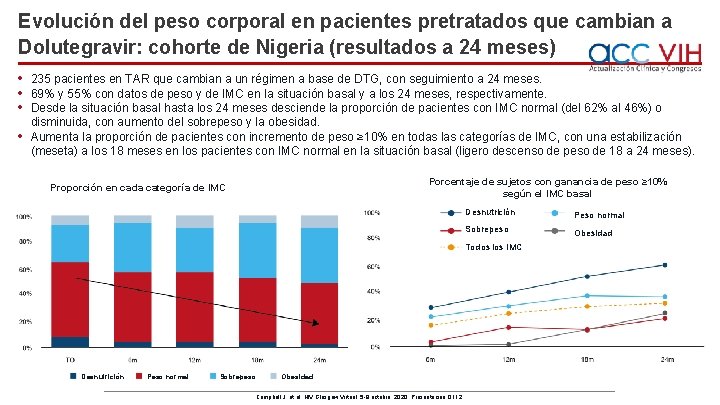
Evolución del peso corporal en pacientes pretratados que cambian a Dolutegravir: cohorte de Nigeria (resultados a 24 meses) • • 235 pacientes en TAR que cambian a un régimen a base de DTG, con seguimiento a 24 meses. 69% y 55% con datos de peso y de IMC en la situación basal y a los 24 meses, respectivamente. Desde la situación basal hasta los 24 meses desciende la proporción de pacientes con IMC normal (del 62% al 46%) o disminuida, con aumento del sobrepeso y la obesidad. Aumenta la proporción de pacientes con incremento de peso ≥ 10% en todas las categorías de IMC, con una estabilización (meseta) a los 18 meses en los pacientes con IMC normal en la situación basal (ligero descenso de peso de 18 a 24 meses). Porcentaje de sujetos con ganancia de peso ≥ 10% según el IMC basal Proporción en cada categoría de IMC Desnutrición Peso normal Sobrepeso Obesidad Todos los IMC Desnutrición Peso normal Sobrepeso Obesidad Campbell J, et al. HIV Glasgow Virtual, 5 -8 octubre, 2020; Presentación O 112.

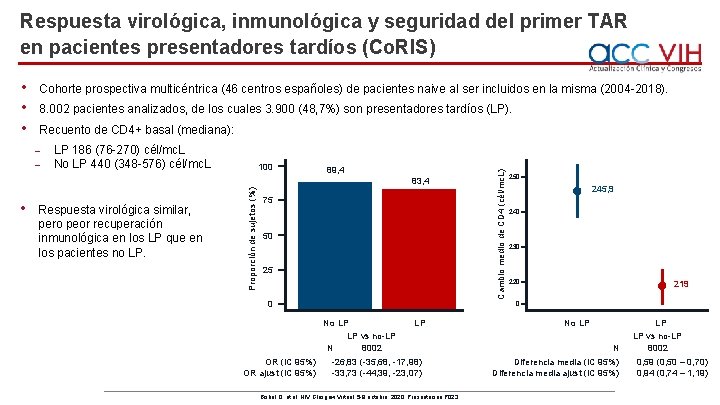
Respuesta virológica, inmunológica y seguridad del primer TAR en pacientes presentadores tardíos (Co. RIS) Cohorte prospectiva multicéntrica (46 centros españoles) de pacientes naive al ser incluidos en la misma (2004 -2018). 8. 002 pacientes analizados, de los cuales 3. 900 (48, 7%) son presentadores tardíos (LP). Recuento de CD 4+ basal (mediana): ˗ ˗ LP 186 (76 -270) cél/mc. L No LP 440 (348 -576) cél/mc. L 100 89, 4 • Respuesta virológica similar, pero peor recuperación inmunológica en los LP que en los pacientes no LP. Proporción de sujetos (%) 83, 4 75 50 250 245, 9 240 230 220 219 0 No LP LP vs no-LP N 8002 OR (IC 95%) OR ajust (IC 95%) Cambio medio de CD 4 (cél/mc. L) • • • LP -26, 83 (-35, 68, -17, 98) -33, 73 (-44, 39, -23, 07) Bisbal O, et al. HIV Glasgow Virtual, 5 -8 octubre, 2020; Presentación P 023. No LP N Diferencia media (IC 95%) Diferencia media ajust (IC 95%) LP LP vs no-LP 8002 0, 59 (0, 50 – 0, 70) 0, 94 (0, 74 – 1, 19)

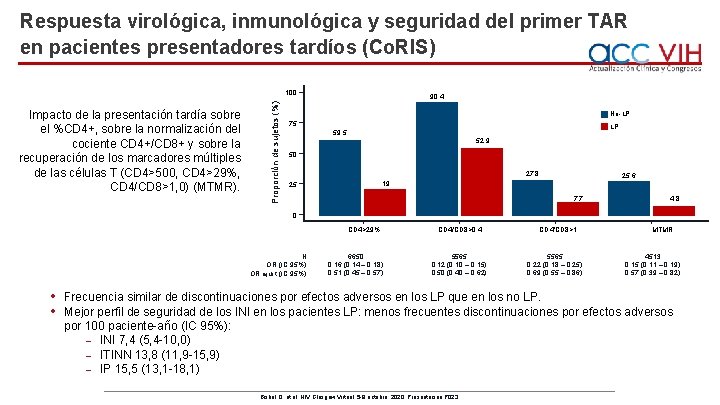
Respuesta virológica, inmunológica y seguridad del primer TAR en pacientes presentadores tardíos (Co. RIS) Impacto de la presentación tardía sobre el %CD 4+, sobre la normalización del cociente CD 4+/CD 8+ y sobre la recuperación de los marcadores múltiples de las células T (CD 4>500, CD 4>29%, CD 4/CD 8>1, 0) (MTMR). Proporción de sujetos (%) 100 90, 4 No-LP 75 LP 59, 5 52, 9 50 27, 8 25, 6 19 25 7, 7 4, 8 0 CD 4>29% N OR (IC 95%) OR ajust (IC 95%) • • 6650 0, 16 (0, 14 – 0, 18) 0, 51 (0, 45 – 0, 57) CD 4/CD 8>0, 4 5565 0, 12 (0, 10 – 0, 15) 0, 50 (0, 40 – 0, 62) CD 4/CD 8>1 5565 0, 22 (0, 18 – 0, 25) 0, 69 (0, 55 – 0, 86) MTMR 4513 0, 15 (0, 11 – 0, 19) 0, 57 (0, 39 – 0, 82) Frecuencia similar de discontinuaciones por efectos adversos en los LP que en los no LP. Mejor perfil de seguridad de los INI en los pacientes LP: menos frecuentes discontinuaciones por efectos adversos por 100 paciente-año (IC 95%): ˗ INI 7, 4 (5, 4 -10, 0) ˗ ITINN 13, 8 (11, 9 -15, 9) ˗ IP 15, 5 (13, 1 -18, 1) Bisbal O, et al. HIV Glasgow Virtual, 5 -8 octubre, 2020; Presentación P 023.

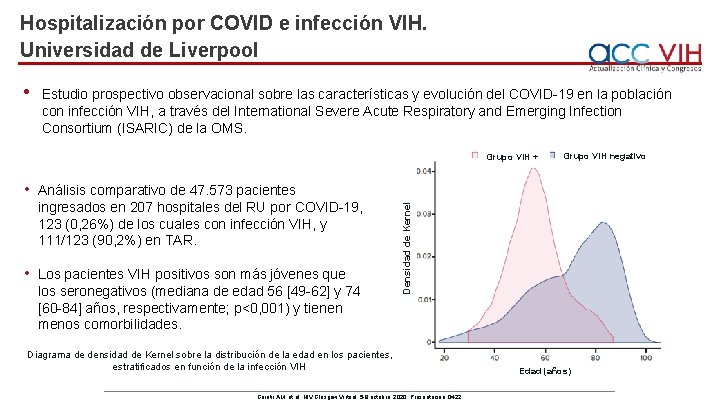
Hospitalización por COVID e infección VIH. Universidad de Liverpool • Estudio prospectivo observacional sobre las características y evolución del COVID-19 en la población con infección VIH, a través del International Severe Acute Respiratory and Emerging Infection Consortium (ISARIC) de la OMS. • Análisis comparativo de 47. 573 pacientes ingresados en 207 hospitales del RU por COVID-19, 123 (0, 26%) de los cuales con infección VIH, y 111/123 (90, 2%) en TAR. • Los pacientes VIH positivos son más jóvenes que los seronegativos (mediana de edad 56 [49 -62] y 74 [60 -84] años, respectivamente; p<0, 001) y tienen menos comorbilidades. Grupo VIH negativo Densidad de Kernel Grupo VIH + Diagrama de densidad de Kernel sobre la distribución de la edad en los pacientes, estratificados en función de la infección VIH Geretii AM, et al. HIV Glasgow Virtual, 5 -8 octubre, 2020; Presentación O 422. Edad (años)

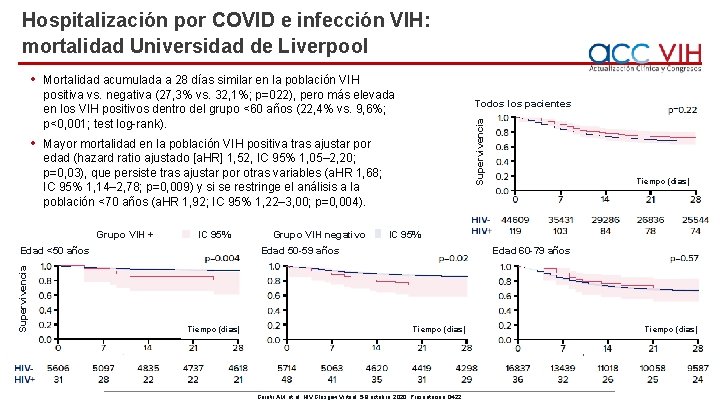
Hospitalización por COVID e infección VIH: mortalidad Universidad de Liverpool • Mortalidad acumulada a 28 días similar en la población VIH positiva vs. negativa (27, 3% vs. 32, 1%; p=022), pero más elevada en los VIH positivos dentro del grupo <60 años (22, 4% vs. 9, 6%; p<0, 001; test log-rank). Mayor mortalidad en la población VIH positiva tras ajustar por edad (hazard ratio ajustado [a. HR] 1, 52, IC 95% 1, 05– 2, 20; p=0, 03), que persiste tras ajustar por otras variables (a. HR 1, 68; IC 95% 1, 14– 2, 78; p=0, 009) y si se restringe el análisis a la población <70 años (a. HR 1, 92; IC 95% 1, 22– 3, 00; p=0, 004). Grupo VIH + IC 95% Edad <50 años Supervivencia Todos los pacientes Supervivencia • Grupo VIH negativo IC 95% Edad 50 -59 años Tiempo (días) Edad 60 -79 años Tiempo (días) Geretii AM, et al. HIV Glasgow Virtual, 5 -8 octubre, 2020; Presentación O 422. Tiempo (días)

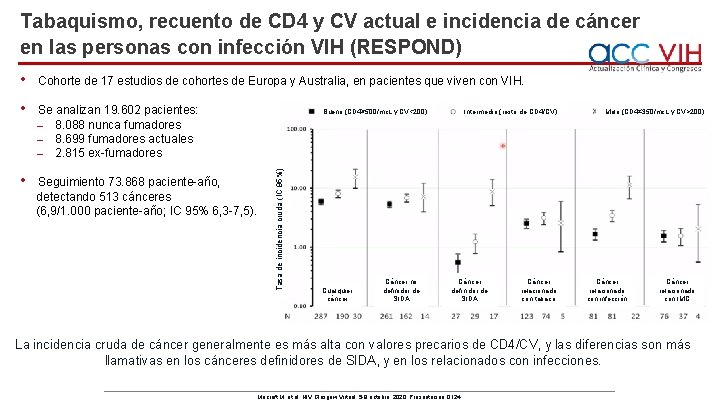
Tabaquismo, recuento de CD 4 y CV actual e incidencia de cáncer en las personas con infección VIH (RESPOND) • Cohorte de 17 estudios de cohortes de Europa y Australia, en pacientes que viven con VIH. • Se analizan 19. 602 pacientes: ˗ 8. 088 nunca fumadores ˗ 8. 699 fumadores actuales ˗ 2. 815 ex-fumadores • Seguimiento 73. 868 paciente-año, detectando 513 cánceres (6, 9/1. 000 paciente-año; IC 95% 6, 3 -7, 5). Tasa de incidencia cruda (IC 95%) Bueno (CD 4≥ 500/mc. L y CV<200) Cualquier cáncer Cáncer no definidor de SIDA Intermedio (resto de CD 4/CV) Cáncer definidor de SIDA Cáncer relacionado con tabaco Malo (CD 4≤ 350/mc. L y CV>200) Cáncer relacionado con infección Cáncer relacionado con IMC La incidencia cruda de cáncer generalmente es más alta con valores precarios de CD 4/CV, y las diferencias son más llamativas en los cánceres definidores de SIDA, y en los relacionados con infecciones. Mocroft M, et al. HIV Glasgow Virtual, 5 -8 octubre, 2020; Presentación O 124.

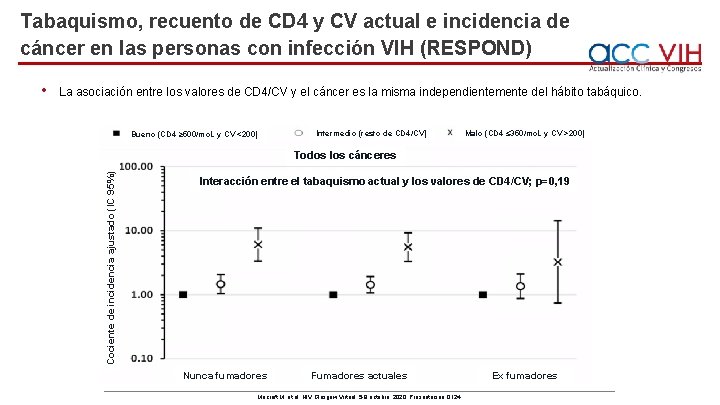
Tabaquismo, recuento de CD 4 y CV actual e incidencia de cáncer en las personas con infección VIH (RESPOND) La asociación entre los valores de CD 4/CV y el cáncer es la misma independientemente del hábito tabáquico. Bueno (CD 4 ≥ 500/mc. L y CV <200) Intermedio (resto de CD 4/CV) Malo (CD 4 ≤ 350/mc. L y CV >200) Todos los cánceres Cociente de incidencia ajustado (IC 95%) • Interacción entre el tabaquismo actual y los valores de CD 4/CV; p=0, 19 Nunca fumadores Fumadores actuales Mocroft M, et al. HIV Glasgow Virtual, 5 -8 octubre, 2020; Presentación O 124. Ex fumadores

HIV Glasgow 2020 (virtual) Glasgow, UK 5 – 8 Octubre 2020
 Deliberate adulteration definition
Deliberate adulteration definition Drug therapy problems
Drug therapy problems Drug therapy management
Drug therapy management Nursing process in drug therapy
Nursing process in drug therapy Psychoanalytic therapy is to as humanistic therapy is to
Psychoanalytic therapy is to as humanistic therapy is to Bioness bits cost
Bioness bits cost Humanistic therapy aims to
Humanistic therapy aims to Has virtual functions and accessible non-virtual destructor
Has virtual functions and accessible non-virtual destructor Triệu chứng nhiễm hiv
Triệu chứng nhiễm hiv Where did hiv come from
Where did hiv come from Test wiedzy o hiv i aids z odpowiedziami
Test wiedzy o hiv i aids z odpowiedziami Steps of index testing
Steps of index testing Elemen penilaian prognas snars edisi 1.1
Elemen penilaian prognas snars edisi 1.1 Phdp in hiv
Phdp in hiv Chii chinonzi hiv
Chii chinonzi hiv Window period hiv
Window period hiv Why do the bodys antibodies fail to protect people from hiv
Why do the bodys antibodies fail to protect people from hiv Iris hiv
Iris hiv Where did hiv come from
Where did hiv come from Hiv risk factors
Hiv risk factors Asante hiv-1 rapid recency assay
Asante hiv-1 rapid recency assay Fiebig hiv
Fiebig hiv Hiv case-based surveillance in ethiopia
Hiv case-based surveillance in ethiopia Triệu chứng nhiễm hiv
Triệu chứng nhiễm hiv Chapter 25 sexually transmitted infections and hiv/aids
Chapter 25 sexually transmitted infections and hiv/aids Chapter 24 sexually transmitted diseases and hiv/aids
Chapter 24 sexually transmitted diseases and hiv/aids Basic hiv course
Basic hiv course Stakeholders in hiv prevention
Stakeholders in hiv prevention Hiv treatments
Hiv treatments Causative organism of hiv/aids
Causative organism of hiv/aids