Gli stati di aggregazione Lo stato gassoso Paragone





















- Slides: 33

Gli stati di aggregazione Lo stato gassoso

Paragone Molecolare di Liquidi, Solidi e gas

Un paragone molecolare di Liquidi e Solidi n Proprietà fisiche delle sostanze si comprendono in termini di teoria cinetica molecolare : ¨I Gas sono compribili, assumono forma e volume del contenitore: Le molecole di un Gas non interagiscono fra loro. ¨ I Liquidi sono quasi incompressibili, assumono la forma ma non il volume del contenitore: Le molecole di un Liquido sono più vicino fra loro rispetto alle molecole di un gas, ma non così rigidamente legate per cui le molecole possono slittare le une sulle altre ¨I Solidi sono incompressibili e hanno una definita forma e volume: n Le molecole dei solidi sono rigidamente impacchettate e non possono slittare le une sulle altre.

Proprietà di un Gas • • • Può essere compresso facilmente Esercita una pressione sul recipiente Occupa tutto il volume disponibile Non ha forma propria nè volume proprio Due gas diffondono facilmente uno nell’altro Tutti i gas hanno basse densità · aria · acqua · ferro 0. 0013 g/ml 1. 00 g/ml 7. 9 g/ml

Composizione dell’Atmosfera

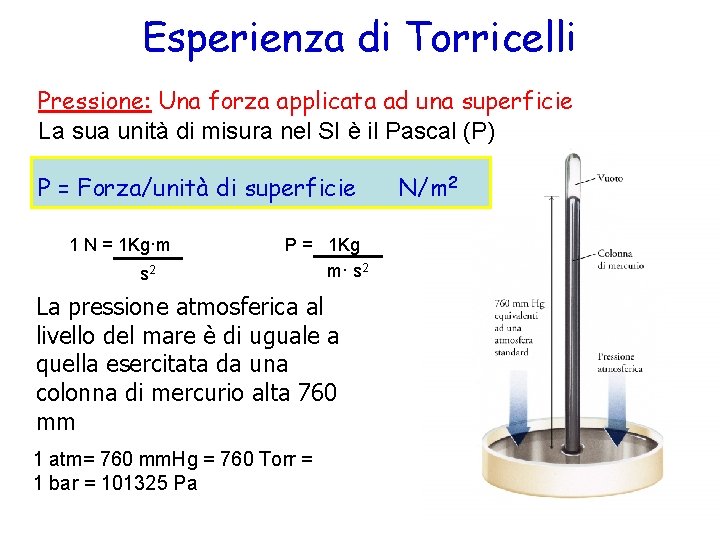
Esperienza di Torricelli Pressione: Una forza applicata ad una superficie La sua unità di misura nel SI è il Pascal (P) P = Forza/unità di superficie 1 N = 1 Kg·m s 2 P = 1 Kg m· s 2 La pressione atmosferica al livello del mare è di uguale a quella esercitata da una colonna di mercurio alta 760 mm 1 atm= 760 mm. Hg = 760 Torr = 1 bar = 101325 Pa N/m 2

Modello del Gas Ideale Cos’e’ un Gas Ideale? E’ un Gas che obbedisce alla equazione di stato dei gas Ideali 1. Le molecole che compongono il gas ideale vengono considerate puntiformi 2. Le molecole non interagiscono fra loro

Le Leggi dei Gas • Gli esperimenti mostrano che 4 variabili (di cui solo 3 indipendenti) sono sufficienti a descrivere completamente il comportamento all’equilibrio di un gas. – Pressione (P) – Volume (V) – Temperatura (T) – Numero di particelle (n) Lo studio dei gas e’ un eccellente esempio di uso del metodo scientifico. Illustra come delle osservazioni possono portare a dedurre delle leggi naturali, che a loro volta, possono essere spiegate con dei modelli

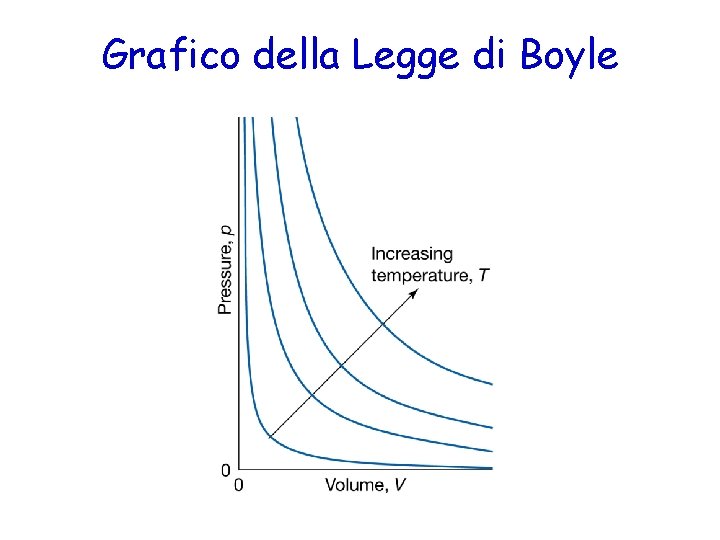
La Legge di Boyle Nel 1662, Robert Boyle scopre che il volume di un gas è inversamente proporzionale alla pressione 1 V P (T, n costanti)

La Legge di Boyle

Grafico della Legge di Boyle

La Legge di Boyle · A temperatura costante p. V = costante p 1 V 1 = K Robert Boyle 1627 -1691. p 2 V 2 = K p 1 V 1 = p 2 V 2

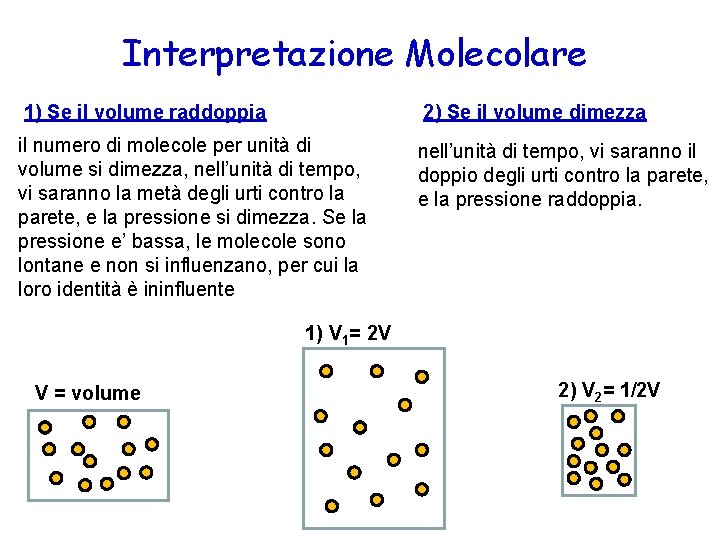
Interpretazione Molecolare 1) Se il volume raddoppia 2) Se il volume dimezza il numero di molecole per unità di volume si dimezza, nell’unità di tempo, vi saranno la metà degli urti contro la parete, e la pressione si dimezza. Se la pressione e’ bassa, le molecole sono lontane e non si influenzano, per cui la loro identità è ininfluente nell’unità di tempo, vi saranno il doppio degli urti contro la parete, e la pressione raddoppia. 1) V 1= 2 V V = volume 2) V 2= 1/2 V

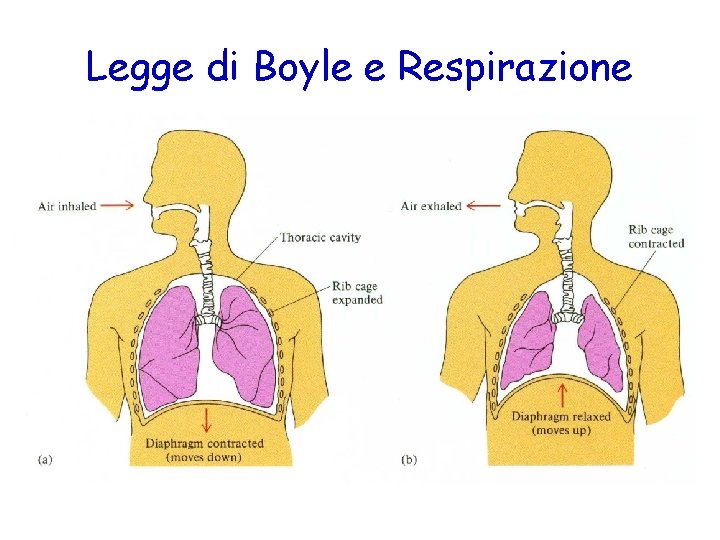
Legge di Boyle e Respirazione

Cosa comporta la Legge di Boyle? Il volume d’aria nella pompa viene ridotto, aumentando la pressione e permettendo all’aria di entrare nel pneumatico

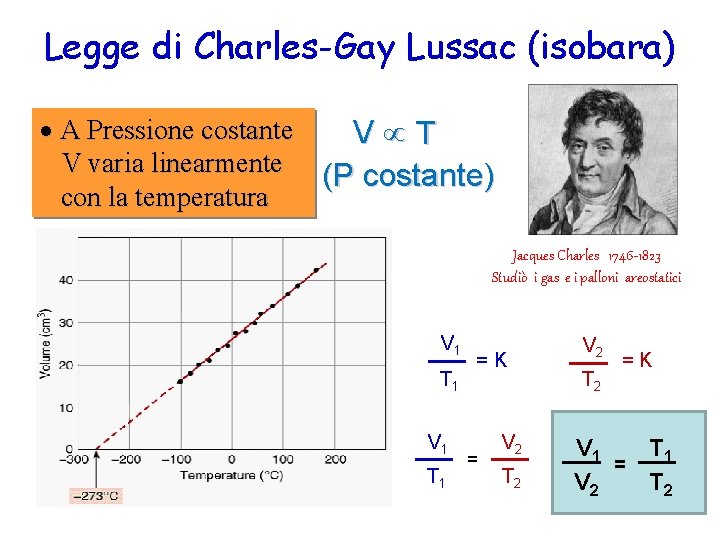
Legge di Charles-Gay Lussac (isobara) · A Pressione costante V T V varia linearmente (P costante) con la temperatura Jacques Charles 1746 -1823 Studiò i gas e i palloni areostatici V 1 T 1 =K = V 2 T 2 =K V 1 T 1 = V 2 T 2

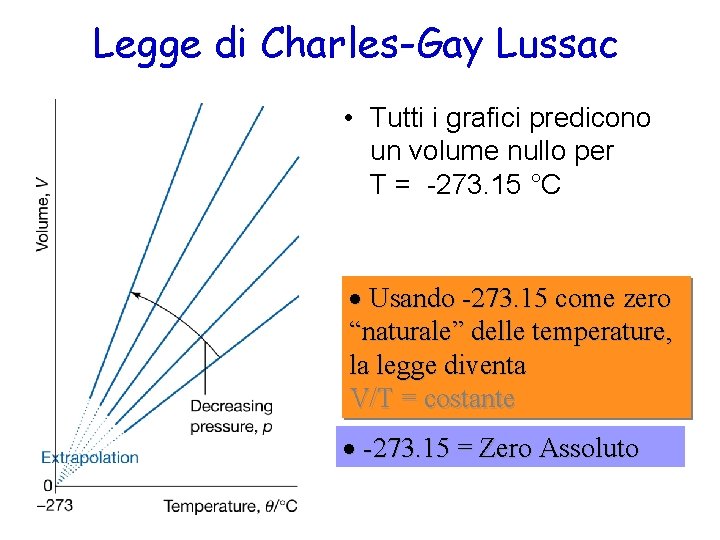
Legge di Charles-Gay Lussac • Tutti i grafici predicono un volume nullo per T = -273. 15 °C · Usando -273. 15 come zero “naturale” delle temperature, la legge diventa V/T = costante · -273. 15 = Zero Assoluto

La Scala Kelvin di Temperatura • Dato che tutti i grafici della legge di Charles-Gay Lussac intersecano l’asse delle temperature a 273. 15°C, Lord Kelvin propose di usare questo valore come zero di una scala assoluta di temperature: la scala Kelvin. • 0 Kelvin (0 K) è la temperatura dove il volume di un gas ideale è nullo, e cessa ogni movimento molecolare. • 1 K = 1°C

La Legge di Charles I palloncini, messi in azoto liquido a 77 K (-196 °C) diminuiscono il loro volume. A temperatura ambiente, gradualmente riprendono il loro volume.

Legge di Charles-Gay Lussac (isocora) A volume costante la pressione varia linearmente con la temperatura P T (V costante) P 1 =K T 1 P 1 T 1 = P 2 T 2 P 2 =K T 2 P 1 P 2 = T 1 T 2

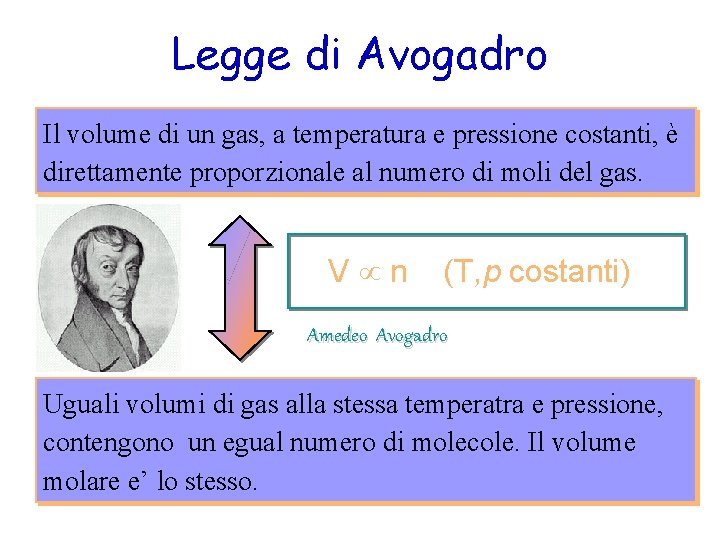
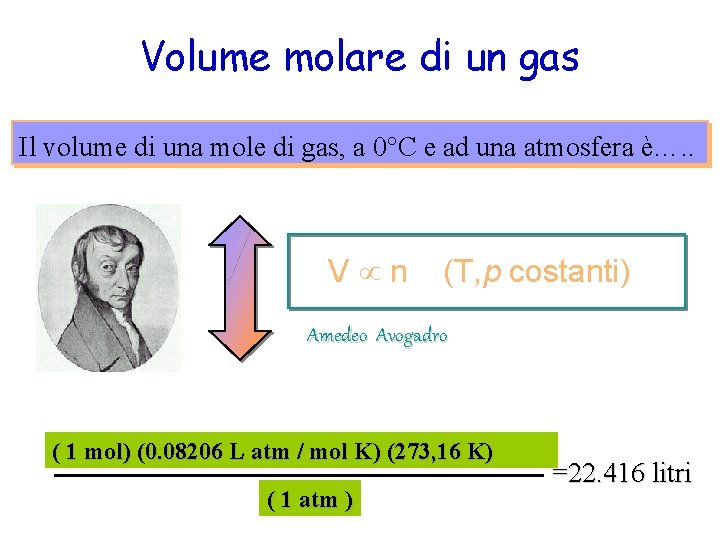
Legge di Avogadro Il volume di un gas, a temperatura e pressione costanti, è direttamente proporzionale al numero di moli del gas. V n (T, p costanti) Amedeo Avogadro Uguali volumi di gas alla stessa temperatra e pressione, contengono un egual numero di molecole. Il volume molare e’ lo stesso.

Volumi Molari

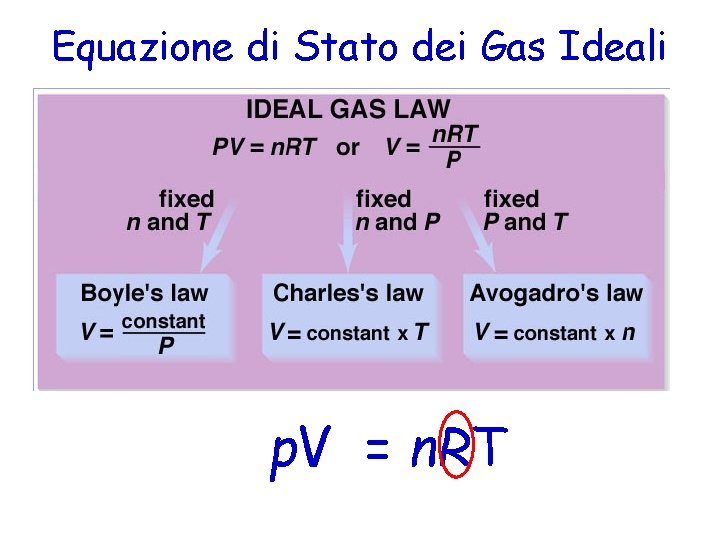
Equazione di Stato dei Gas Ideali • Riassumiamo – V 1/P; legge di Boyle – V T; legge di Charles – Gay Lussac – V n; legge di Avogadro • Possiamo combinare queste relazioni ed ottenere una unica legge: V n. T/p p. V = n. RT R = Costante universale dei Gas

Equazione di Stato dei Gas Ideali p. V = n. RT

La Costante dei Gas R R = 8. 314 J / mol K = 8. 314 J mol-1 K-1 R = 0. 08206 L atm mol-1 K-1 R = 62. 36 torr L mol-1 K-1

Volume molare di un gas Il volume di una mole di gas, a 0°C e ad una atmosfera è…. . V n (T, p costanti) Amedeo Avogadro ( 1 mol) (0. 08206 L atm / mol K) (273, 16 K) ( 1 atm ) =22. 416 litri

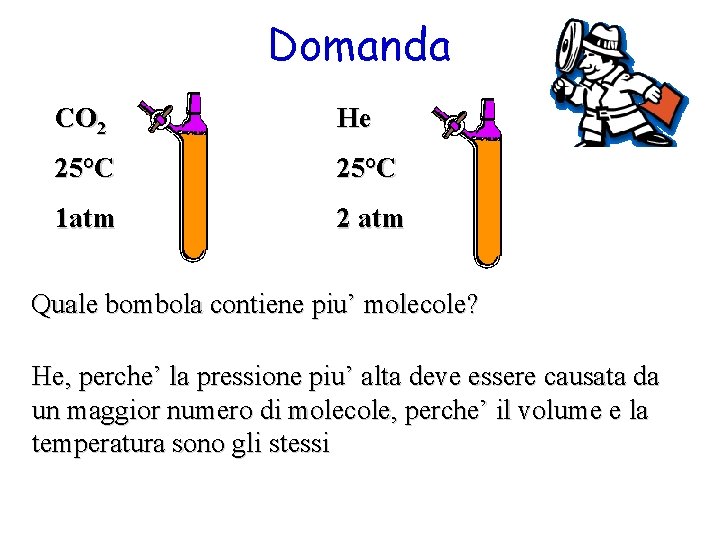
Domanda CO 2 He 25°C 1 atm 2 atm Quale bombola contiene piu’ molecole? He, perche’ la pressione piu’ alta deve essere causata da un maggior numero di molecole, perche’ il volume e la temperatura sono gli stessi

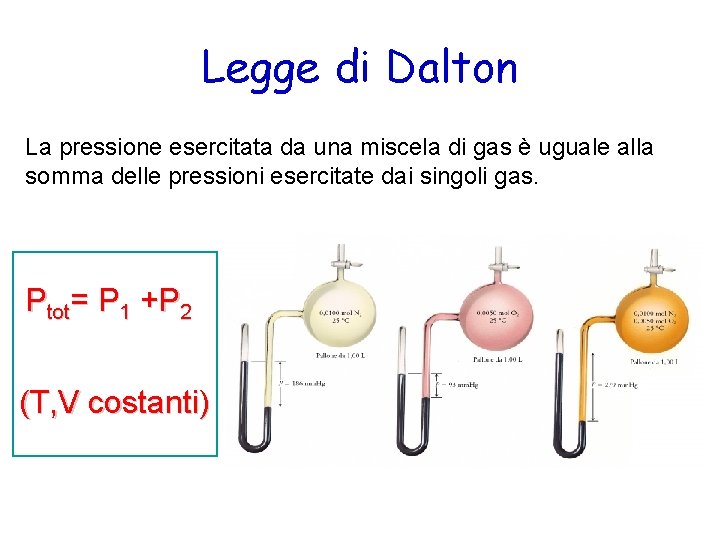
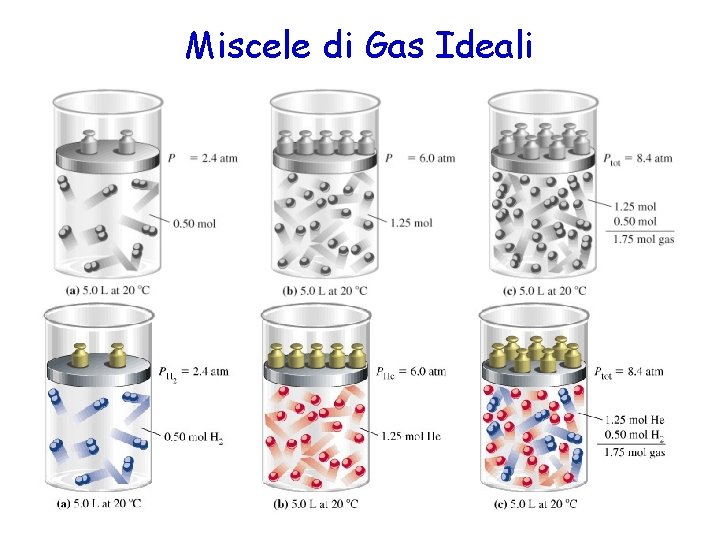
Legge di Dalton La pressione esercitata da una miscela di gas è uguale alla somma delle pressioni esercitate dai singoli gas. Ptot= P 1 +P 2 (T, V costanti)

Miscele di Gas Ideali © Dario Bressanini 29

Pressione Parziale Consideriamo due gas ideali in un recipiente di volume V Ptot= p 1 +p 2 La Pressione parziale è la pressione che il gas eserciterebbe nel recipiente se fosse da solo, alla stessa temperatura p 1 = n 1 RT/V p 2 = n 2 RT/V © Dario Bressanini 30

Condizioni Standard • Condizioni Ambientali Standard di Temperatura e Pressione (SATP) – Temperatura: 25 °C = 298. 15 K – Pressione: 1 atm – Il volume molare di un gas e’ Vm = 24. 79 L n Condizioni Standard (STP) ´ Temperatura: 0 °C = 273. 15 K ´ Pressione: 1 atm ´ Il volume molare di un gas ideale e’ Vm = 22. 41 L

Esempio…. n p. V = n. RT Negli Airbag il gas viene generato dalla decomposizione della Sodio Azide: 2 Na. N 3 2 Na + 3 N 2

Airbag V = n. RT/P Calcolare il volume di Azoto generato a 21°C e 823 mm Hg dalla decomposizione di 60, 0 g di Na. N 3 2 Na. N 3 2 Na + 3 N 2 mol Na. N 3 = 60. 0 g Na. N 3 / 65. 02 g/ mol = 0. 9228 mol N 2= 0. 9228 mol x 3/2 1. 38 mol N 2 ( 1. 38 mol) (0. 08206 L atm / mol K) (294 K) ( 823 mm Hg / 760 mm. Hg / atm ) = 30. 8 litri
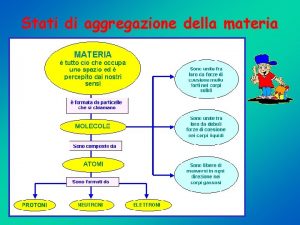
 Gli stati di aggregazione della materia
Gli stati di aggregazione della materia I passaggi di stato della materia scuola primaria
I passaggi di stato della materia scuola primaria Oggetti allo stato gassoso
Oggetti allo stato gassoso Oggetti allo stato gassoso
Oggetti allo stato gassoso Anafora pubblicità
Anafora pubblicità Secondo termine di paragone latino
Secondo termine di paragone latino In una scuola gli studenti sono stati divisi in tre gruppi
In una scuola gli studenti sono stati divisi in tre gruppi In una scuola gli studenti sono stati divisi in 3 gruppi
In una scuola gli studenti sono stati divisi in 3 gruppi Quali sono gli elementi fondamentali dello stato
Quali sono gli elementi fondamentali dello stato Elementi fondamentali dello stato
Elementi fondamentali dello stato Prescrizione morfina fiale su ricetta ssn
Prescrizione morfina fiale su ricetta ssn Solido liquido gassoso
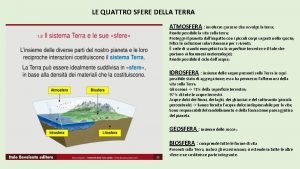
Solido liquido gassoso Le 4 sfere della terra
Le 4 sfere della terra Solido liquido gassoso
Solido liquido gassoso Usa settore primario
Usa settore primario Regno austro ungarico
Regno austro ungarico Stati condensati della materia
Stati condensati della materia Stati subcontinente indiano
Stati subcontinente indiano Stati regionali italiani
Stati regionali italiani Africa meridionale stati
Africa meridionale stati Principio degli stati corrispondenti
Principio degli stati corrispondenti La materia e i suoi stati
La materia e i suoi stati Stati europei
Stati europei Stati condensati
Stati condensati Vcanale di suez
Vcanale di suez Dynamic round character
Dynamic round character Diagramma delle tensioni
Diagramma delle tensioni Termodinamica degli stati
Termodinamica degli stati Danubio stati attraversati
Danubio stati attraversati Percorso fiume reno europa
Percorso fiume reno europa Un tempo i malavoglia erano stati numerosi
Un tempo i malavoglia erano stati numerosi Il terzo stato
Il terzo stato Hegel stato etico
Hegel stato etico Stato liquido
Stato liquido