GejLisakov zakon arlov zakon Nikoli Stefan 2012 GejLisakov







- Slides: 9

• Gej-Lisakov zakon • Šarlov zakon Nikolić Stefan 20/12

• Gej-Lisakov zakon (izobarska promena stanja gasa) Gej Lisakov zakon govori upravo o vezi između temperature gasa i zapremine kod idealnog gasa, gde je pritisak konstantan odnosno p=const. Taj proces se inače naziva izobarski. Postavili su ga zajednički Šarl, koji je utvrdio da se pri istom porastu temperature zapremina raznih gasova poveća za isti iznos i Gej-Lisak koji je odredio porast zapremine ako se temperatura poveća za 1 stepen C. On je utvrdio da je relativno povecanje zapremine gasa srazmerna porastu temperature.

Ako je pri zapremina , onda mozemo napisati da je na nekoj temperature t, zapremina V. To ce biti: = Velicina se naziva toplotni koeficijent sirenja gasa, I ona predstavlja promenu zapremine gasa u odnosu na zapreminu pri 0 za jedan stepen. To uvek iznosi:

Iz toga sledi Gej Lisakov zakon u celziusovoj skali: Na kraju, Gej Lisakov zakon u apsolutnoj skali dobija oblik: V= T ili =const Odnos zapremine I apsolutne temperature odredjene kolicine gasa pri stalnom pritisku jeste konstantan ili zapremina odredjene kolicine gasa pri stalnom pritisku proporcionalna je temperaturi.

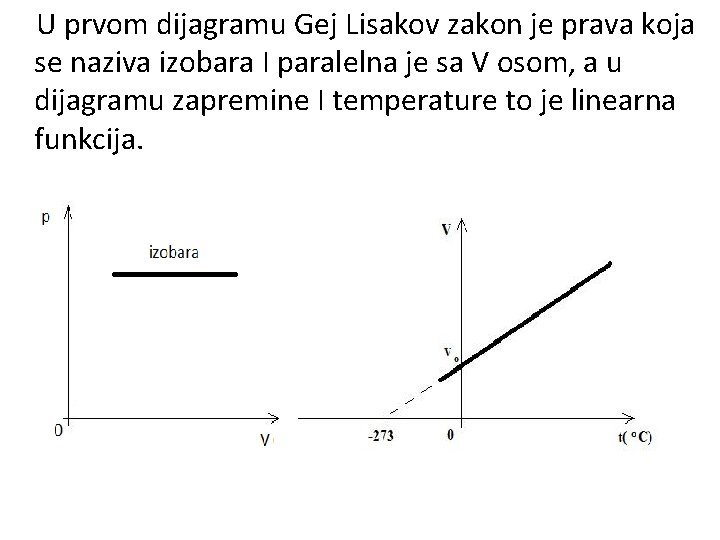
U prvom dijagramu Gej Lisakov zakon je prava koja se naziva izobara I paralelna je sa V osom, a u dijagramu zapremine I temperature to je linearna funkcija.

Sarlov zakon (izohorska promena stanja gasa) Izohorska promena gasa nastaje kad se gas zagreva pri stalnoj temperaturi. Sa porastom temperature povecava se I brzina kretanja molekula gasa. Pri tome se povecava impuls I brzina kretanja molekula pa tako I njihovo delovanje na zid suda pri cemu raste I pritisak gasa. Pocetkom XVIII veka se doslo do veze temperature I pritiska gasa. Merenjem relativnog povecanja pritiska, utvrdjeno je da je ono srazmerno porastu remperature.

)= = Ako je pri t=0 pritisak , tada mozemo uzeti da je na nekoj temperaturi t pritisak p I onda mozemo da napisemo: Tako dobijamo Sarlov zakon koj predstavlja linearnu funkciju: p= Sarlov zakon je mnogo jednostavniji u apsolutnoj skali temperature, posto znamo da je T[K]=t [C]+273 , onda mozemo napisati:

= = p= To znaci da je za svaki gas p/T stalno, onda mozemo napisati obrazac za Sarlov zakon: Sarlov zakon prema tome glasi: Odnos pritiska I apsolutne temperature, odredjene kolicine gasa pri stalnoj zapremini je konstantan ili pritisak odredjene kolicine gasa pri stalnoj zapremini upravno je proporcionalan apsolutnoj temperaturi.

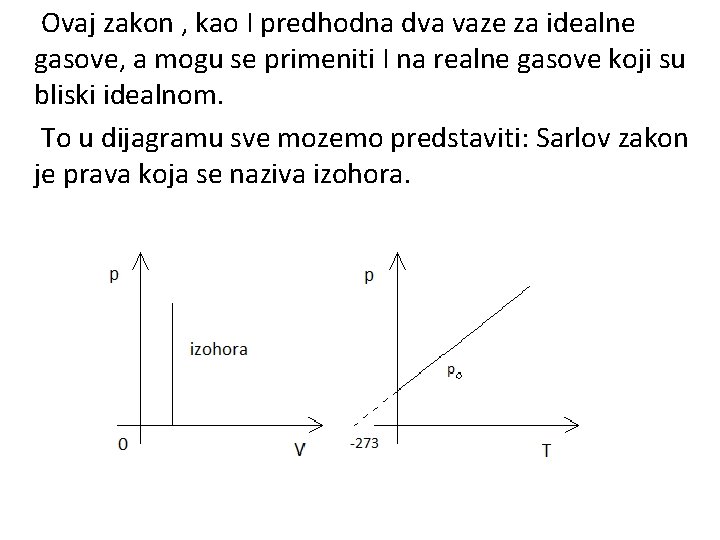
Ovaj zakon , kao I predhodna dva vaze za idealne gasove, a mogu se primeniti I na realne gasove koji su bliski idealnom. To u dijagramu sve mozemo predstaviti: Sarlov zakon je prava koja se naziva izohora.

















