FORE intermoleculare Clasificare Legturi de hidrogen Fore van












- Slides: 16

FORŢE intermoleculare

Clasificare ØLegături de hidrogen ØForţe van der Waals : - interacţii dipol – dipol - forţe de dispersie London

Legătura de hidrogen q cea mai puternică dintre forţele intermoleculare qse realizează între molecule care conţin H legat de un atom cu electronegativitate mare ( F, O, N) q între moleculele de : HF , H 2 O , NH 3

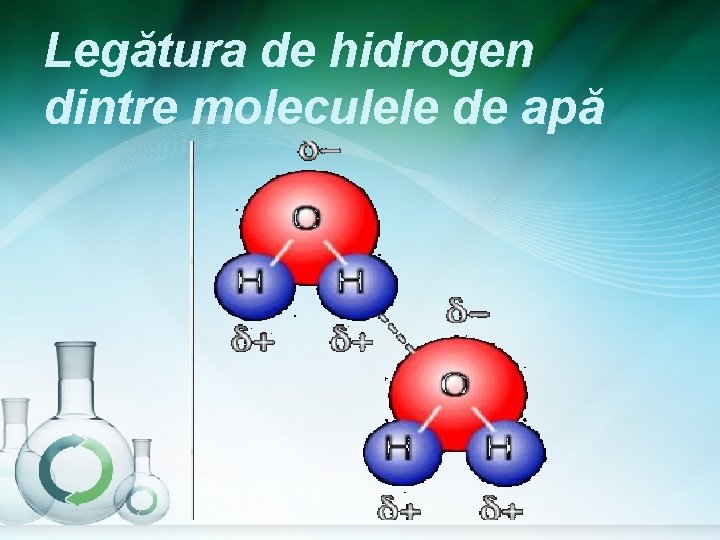
Legătura de hidrogen dintre moleculele de apă

Datorită punţilor de hidrogen care se realizează între moleculele sale, apa are o serie de proprietăţi fizice “anormale”.

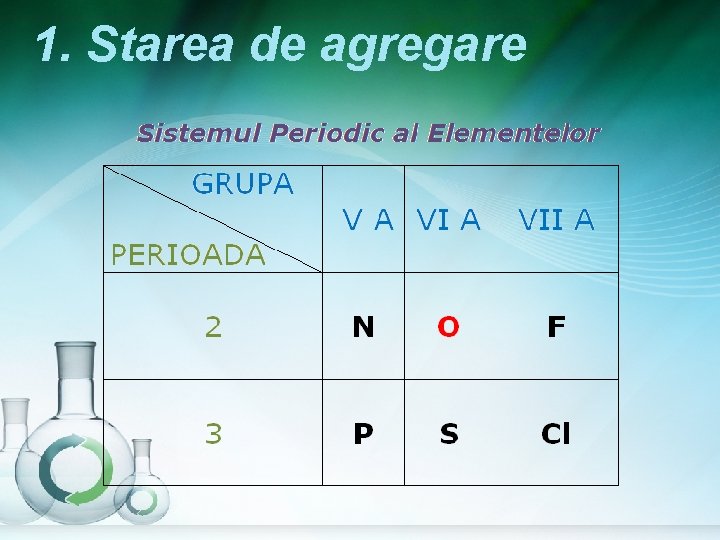
1. Starea de agregare


2. Dilatarea apei la îngheţare Ø Între 4 -0°C, legăturile de H dintre moleculele de apă se dublează. ØGheaţa are o structură afânată, de aceea , aceasta are o densitate mai mică decât densitatea apei. ØÎn râuri, lacuri, temperatura apei de sub stratul de gheaţă trebuie să fie mai mare de 4°C pentru ca vietăţile acvatice să poată supravieţui.


3. Forma cristalelor de gheaţă

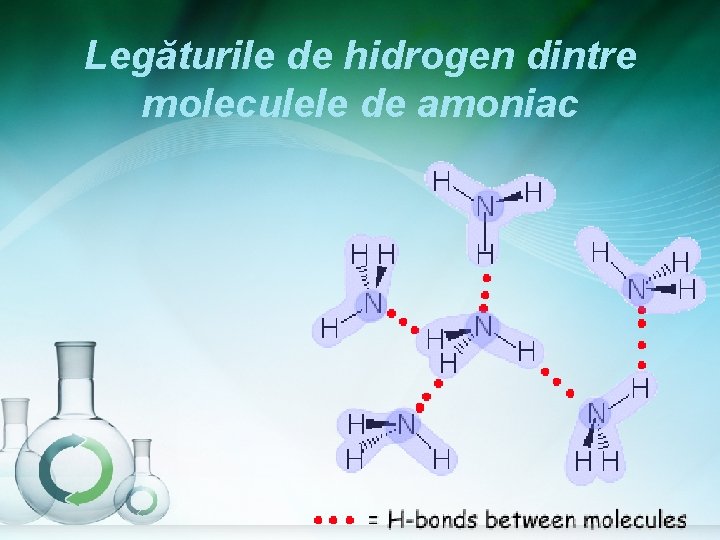
Legăturile de hidrogen dintre moleculele de amoniac

Interacţii dipol - dipol o Se realizează între moleculele polare HCl , H 2 S , PH 3 , HBr etc. o Sunt mai slabe decât legăturile de hidrogen


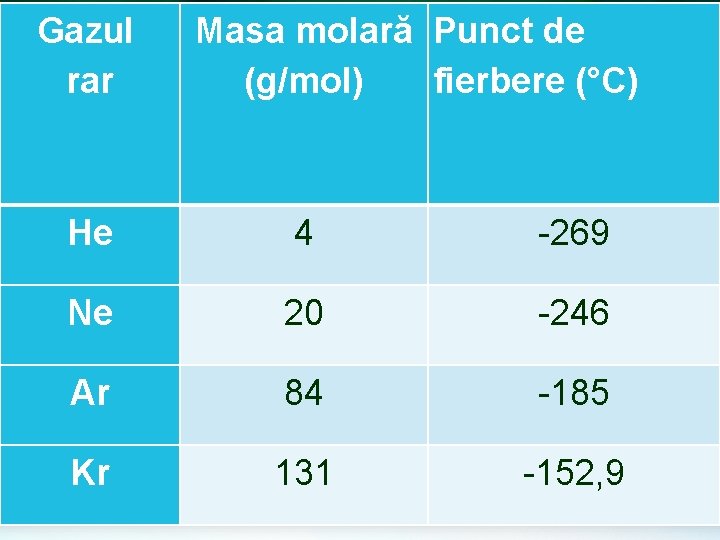
Forţele de dispersie London Se realizează între moleculele covalente nepolare sau între atomii gazelor rare: o H 2 , Cl 2 , N 2 , O 2 , CH 4 , CO 2 o He , Ar , Ne o Sunt legături foarte slabe o Explică lichefierea gazelor o Explică punctele de topire şi de fierbere foarte mici ale gazelor

Gazul rar Masa molară Punct de (g/mol) fierbere (°C) He 4 -269 Ne 20 -246 Ar 84 -185 Kr 131 -152, 9

Concluzii: Forţele intermoleculare sunt mult mai slabe decât legăturile chimice ionice şi covalente üInfluenţează unele proprietăţi fizice ale substanţelor ( puncte de topire şi de fierbere, solubilitate, densitate etc. ) üTăria lor scade în ordinea: ü Leg. de. H>Interacţii dipol–dipol >Forţe London
 Apoláris molekula
Apoláris molekula Ponts d'hidrogen
Ponts d'hidrogen Aturan oktet
Aturan oktet Hidrogén klorid előállítása
Hidrogén klorid előállítása Enllaços febles no covalents
Enllaços febles no covalents Label the following parts of a dna polymer
Label the following parts of a dna polymer Panjang gelombang terbesar deret paschen
Panjang gelombang terbesar deret paschen Gliserosa
Gliserosa Hidrogén ridegedés
Hidrogén ridegedés Landolt reakció
Landolt reakció Hidrogen
Hidrogen Fore flight
Fore flight Two man arms carry
Two man arms carry Frontline defense systems
Frontline defense systems Compass surveying definition
Compass surveying definition Bearing definition in surveying
Bearing definition in surveying Backhand forehand badminton
Backhand forehand badminton