ESCUELA POLITCNICA NACIONAL REACONDICIONAMIENTO DE POZOS ING FRANKLIN




























- Slides: 30

ESCUELA POLITÉCNICA NACIONAL REACONDICIONAMIENTO DE POZOS ING. FRANKLIN GÓMEZ

CONTENIDO • 1. INTRODUCCIÓN • 2. LA ESTIMULACIÓN DE POZOS Y EL DAÑO DE FORMACIÓN • 3. ESTIMULACIÓN MATRICIAL NO REACTIVA • 4. ESTIMULACIÓN MATRICIAL REACTIVA • 5. PROCEDIMIENTOS OPERACIONALES DEL REACONDICIONAMIENTO DE POZOS Y RESPONSABILIDADES DEL INGENIERO EN PETROLEOS

4. ESTIMULACIÓN MATRICIAL REACTIVA (ACIDIFICACIÓN MATRICIAL) 4. 1. Introducción 4. 2. Ácidos 4. 3. Cinética de Reacción 4. 4. Aditivos 4. 5. Selección de fluidos en la acidificación matricial • 4. 6. Estudios de laboratorio para el diseño de una estimulación matricial • • •

Introducción • Objetivo: Remover el daño ocasionado en las perforaciones y en la vecindad del pozo y eliminar obstrucciones en el mismo. • El elemento básico en la estimulación matricial ácida es el ácido.

Ácidos • Los ácidos se ionizan en hidrogeno y un anión. • Los ácidos son conocidos por su PH inferior a 7. • Mientras más completa sea la disociación en el agua, en hidrógeno y anión mayor poder de disolución tendrá el ácido y este será un ácido fuerte.

• El conocimiento del cómo, cúando y dónde se llevan a cabo las reacciones químicas es imprescindible para la selección y el diseño de una acidificación matricial. • Este conocimiento se basa en la estequiometría, el equilibrio y la velocidad de reacción.

• Un ácido para este caso requiere principalmente que los productos de reacción sean compuestos solubles en agua y removibles de la formación además de ser controlables sus efectos dañinos, ser seguros de manejarse, encontrarse disponibles en grandes cantidades y tener bajo costo.

• Entre los ácidos más comunmente utilizados son: • Ácido clorhídrico • Ácido fluorhídrico • Y los orgánicos: • Ácido acético y fórmico • Menos utilizados como el ácido sulfálmico y el cloroacético.

Ácido Clorhídrico ( HCl) • La principal desventaja del ácido clorhídrico es su alta corrosividad que puede ocasionar daño severo a las tuberías del pozo y al equipo de acero. • Esta alta corrosividad restringe la aplicabilidad del ácido a altas temperaturas sobre los 300 °F. • El ácido clorhídrico reacciona con la calcita y la dolomita (rocas calcáreas)


• Ver ejercicio pag. 42 para determinar la cantidad de calcita que reacciona con el acido. • En el campo el HCl se recibe en una concentración del 32% en peso. • Ver ejercicio pag. 44 para transformar la concentración del ácido recibida a la concentración de ácido requerida.

Ácido fluorhídrico • Es el único ácido que permite la disolución de minerales silícicos como las arcillas, los feldespatos y el cuarzo. Además también reacciona con los minerales calcáreos y con los iónes positivos de la propia salmuera de la formación. • El problema radica en la formación de precipitados insolubles producto de la reacción del ácido con minerales calcáreos.

• EL ácido fluorhídrico se lo utiliza en formaciones silícicas contenido de material calcácareo inferior al 20% por la formación de precipitados. • El ácido fluorhídrico se lo utiliza en la industria petrolera en conbinación con el ácido clorhídrico aunque más comunmente se utiliza el bifluoruro de amonio

• En la mezcla de HCl-HF el HF se disocia parcialmente por lo que le permite actuar como ácido débil además de que el HCl en la mezcla permite prevenir precipitaciones secundarias. • Esto debido a que no reacciona con los aluminosilicatos, no se gasta y por lo tanto mantiene la solución en un bajo PH.

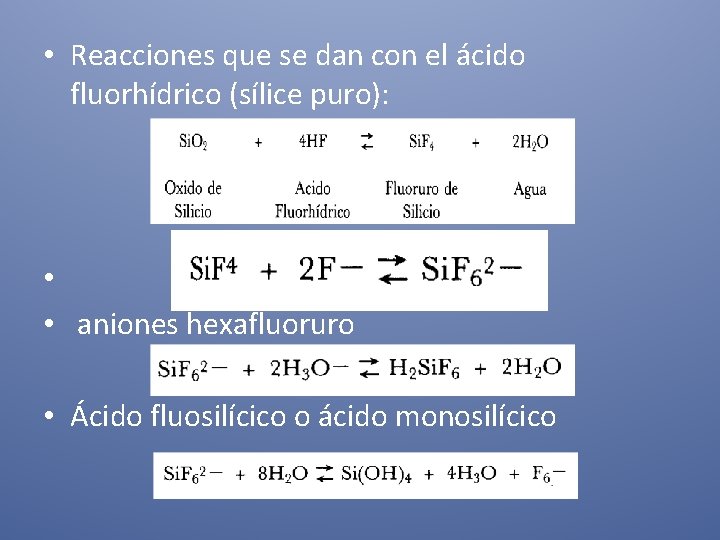
• Reacciones que se dan con el ácido fluorhídrico (sílice puro): • • aniones hexafluoruro • Ácido fluosilícico o ácido monosilícico

• Reacciones: • En las reacciones con los silicatos 1000 gls. de ácido fluorhídrico al 3% disolverán alrededor de 200 lbs de sílice, 140 lbs de bentonita o 500 lbs de otras arcillas.

• Precipitados que se formaran en las reacciones del HF con carbonatos y salmuera: • El floruro de calcio es un precipitado de cristales muy finos y de baja solubilidad. • Para evitar el contacto del ácido fluorhídrico con material calcáreo o salmuera de la formación se debe inyectar previamente un volumen de HCl que disuelva los carbonatos y desplace la sal muera de la zona donde entrará el HF.

• La siguiente tabla presenta los productos de reacción más comunes que se forman en las reacciones de HF • Para evitar la formación de precipitados se recomienda el uso de concentraciones bajas de HF máximo al 3%

• Los principales inconvenientes que conlleva el uso de HF son: Ø Origina productos que por lo general son de baja solubilidad y en algunos casos su precipitación es inevitable. Ø Dada la gran relación area mojada a su volumen tiene un rápido gastado el ácido. Ø El HF disuelve material cementante lo cual deja libre gran cantidad de finos. Ø El HF debilita la roca por disolver el material cementante por lo que esta puede colapsar

• Se han desarrollado procedimientos para mejorar el uso del HF : § SGMA ( Self Generating Mud Acid ) § SHF (Sequential HF Process) • Los cuales consisten en generar el HF en el reservorio.

§ Acido fluoborico: Este proceso genera en cualquier tiempo y lugar solo pequeñas cantidades de ácido fluorhídrico, de ahí que tiene las ventajas del sistema HF-HCl pero además no produce precipitados. • El ácido fluobórico reacciona con areniscas que tienen potasio y evita el daño por los precipitados de estos.

• Reacciones:

• La ventaja de este proceso es que proporciona una eficiente estabilización de los finos y las arcillas a través de las reacciones llevadas a cabo.

Ácido Acético • Es un ácido de tipo orgánico que actua lentamente y en forma parcial al reaccionar con agua y con los minerales de la formación. • Es utilizado como fluido de limpieza antes del disparo. • Su baja reactividad se lo hace imprescindible cuando se tienen en el pozo accesorios con aluminio o cromo. Se puede tenerlo en el pozo desde 3 hasta 7 días sin generar problemas de ácido.

• El ácido acético se presenta como acuoso o como no acuoso. • Disuelto en fluido oleoso se utiliza para remover bloqueos de agua y para alcanzar penetraciones profundas en la formación antes de gastarse. • Se lo emplea en soluciones al 10% en peso y equivale al 6, 1% del acido clorhídrico.

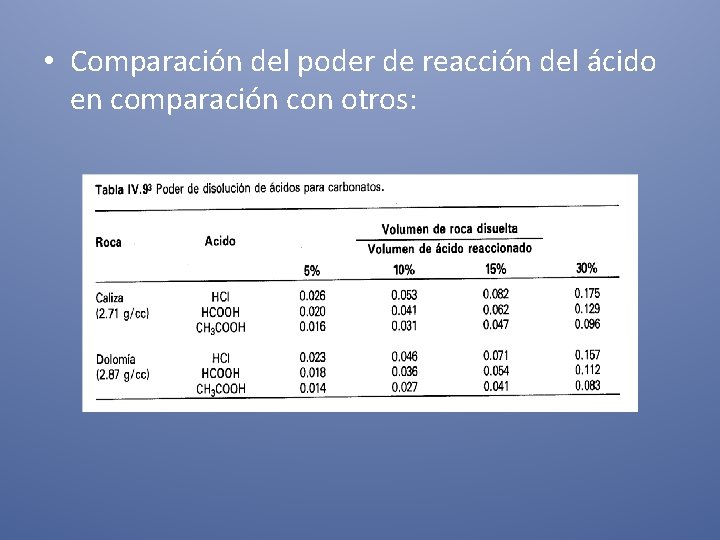
• Comparación del poder de reacción del ácido en comparación con otros:

• El ácido acético reacciona con la siguiente estequiometria: • La baja solubilidad de los productos de reacción hacen que el ácido acético no deba emplearse a concentraciones mayores al 10%

Ácido Fórmico • Es un ácido orgánico más fuerte que el ácido acético y apreciablemente más débil que el ácido clorhídrico. • Es menos fácil de inhibir que el ácido acético y se emplea en concentraciones hasta el 10% en peso. • Disuelve la misma cantidad de caliza que la del HCl al 8%

• La reacción del ácido fórmico con la calcita es: • Hasta concentraciones del 10% los productos de reacción solubles en agua, A mayores concentraciones el formato de calcio es gelatinoso.

Ácidos Especiales • Existen otros ácidos en polvo como: ácido sulfámico y el cloro acético que son fácilmente solubles en agua. • De la misma manera han sido utilizados el ácido cítrico y el ácido láctico como agentes para evitar la precipitación del fierro.
 Pozos infill
Pozos infill Politcnica
Politcnica Escuela benjamin franklin
Escuela benjamin franklin Benjamin franklin preparatoria
Benjamin franklin preparatoria Escuela preparatoria instituto superior benjamín franklin
Escuela preparatoria instituto superior benjamín franklin Preparatoria franklin roosevelt
Preparatoria franklin roosevelt Escuela nacional colegio de ciencias y humanidades
Escuela nacional colegio de ciencias y humanidades Escuela nacional de salud publica cuba
Escuela nacional de salud publica cuba Escuela nacional preparatoria 8
Escuela nacional preparatoria 8 Escuela tradicional
Escuela tradicional Escuela nueva y escuela tradicional cuadro comparativo
Escuela nueva y escuela tradicional cuadro comparativo Hacer de una escuela una buena escuela
Hacer de una escuela una buena escuela Caracteristicas pedagogia tradicional
Caracteristicas pedagogia tradicional Alison franklin lcsw
Alison franklin lcsw Political risk insurance companies
Political risk insurance companies Retaliation attorney franklin county
Retaliation attorney franklin county Ben franklin
Ben franklin Franklin delano roosevelt amante
Franklin delano roosevelt amante Ben franklin and his first kite
Ben franklin and his first kite Benjamin wynalazca piorunochronu
Benjamin wynalazca piorunochronu Franklin d. roosevelt
Franklin d. roosevelt Frankly speaking famous aphorisms from benjamin franklin
Frankly speaking famous aphorisms from benjamin franklin Titles for conclusions
Titles for conclusions Benjamin franklin bottle buddy
Benjamin franklin bottle buddy Ben franklin long arm
Ben franklin long arm Preparatoria franklin roosevelt
Preparatoria franklin roosevelt George cassutto
George cassutto Chapter 33 franklin d roosevelt and the shadow of war
Chapter 33 franklin d roosevelt and the shadow of war Det centrale dogme proteinsyntese
Det centrale dogme proteinsyntese Rachel franklin md
Rachel franklin md Chapter 9 attorney columbus
Chapter 9 attorney columbus