Elektrolyty Roztoky elektrolyt Aktivita iont Iontov sla Osmotick



























- Slides: 35

Elektrolyty Roztoky elektrolytů Aktivita iontů Iontová síla Osmotický tlak 1

Elektrolyty + + - Látky, které při interakci s molekulami rozpouštědla disociují na ionty. 2

Které látky patří mezi elektrolyty ? sloučeniny iontového charakteru ( např. Na. Cl, KOH, (NH 4)2 SO 4 atd. ) látky, v jejichž molekulách se nachází velmi polární kovalentní vazba (např. HCl, HNO 3, CH 3 COOH atd. ). 3

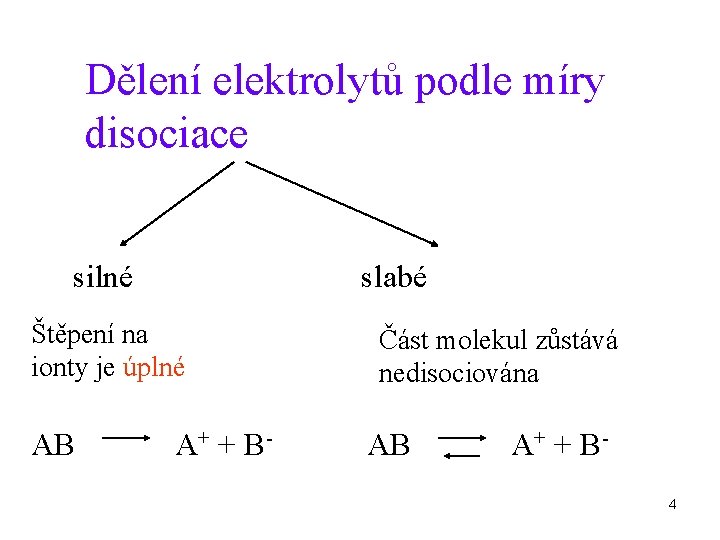
Dělení elektrolytů podle míry disociace silné slabé Štěpení na ionty je úplné AB A+ + B - Část molekul zůstává nedisociována AB A+ + B 4

Příklady silných elektrolytů Silné kyseliny HNO 3 - kys. dusičná HNO 3 H 2 SO 4 - kys. sírová H 2 SO 4 HCl. O 4 - kys. chloristá HCl. O 4 NO 3 - + H+ 2 H+ + SO 42 H+ + Cl. O 4 - HCl, HBr, HI - halogenovodíkové kyseliny kromě fluorovodíkové + HX H + X 5

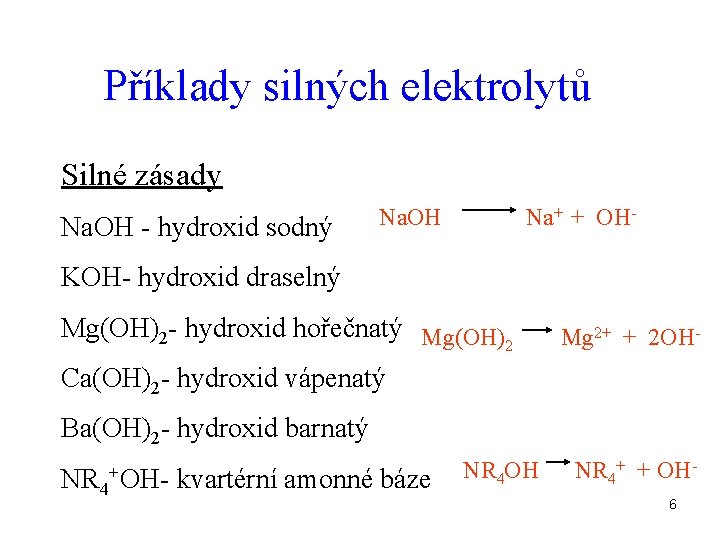
Příklady silných elektrolytů Silné zásady Na. OH - hydroxid sodný Na. OH Na+ + OH- KOH- hydroxid draselný Mg(OH)2 - hydroxid hořečnatý Mg(OH) 2 Mg 2+ + 2 OH- Ca(OH)2 - hydroxid vápenatý Ba(OH)2 - hydroxid barnatý NR 4 +OH- kvartérní amonné báze NR 4 OH NR 4+ + OH 6

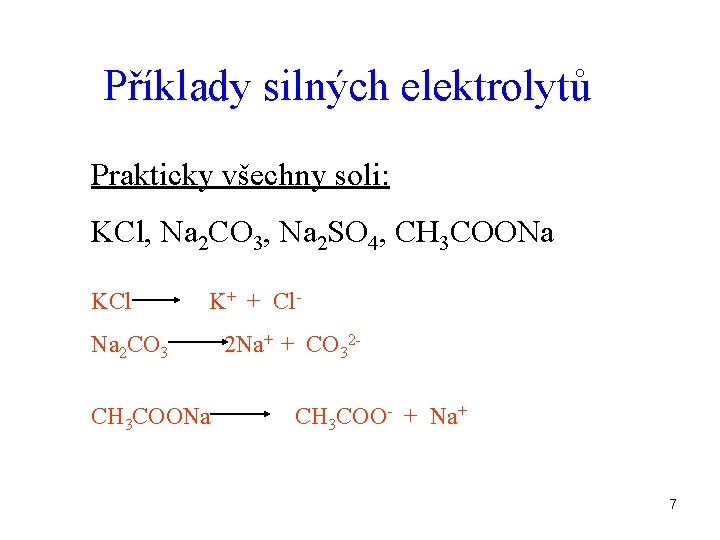
Příklady silných elektrolytů Prakticky všechny soli: KCl, Na 2 CO 3, Na 2 SO 4, CH 3 COONa KCl K+ + Cl- Na 2 CO 3 CH 3 COONa 2 Na+ + CO 32 CH 3 COO- + Na+ 7

Příklady slabých elektrolytů Slabé kyseliny (většina kyselin): HNO 2 - kyselina dusitá H 2 CO 3 - kyselina uhličitá H 2 S - sulfan většina organických kyselin 8

Příklady slabých elektrolytů Slabé zásady: NH 3 - amoniak CH 3 NH 2 - methylamin 9

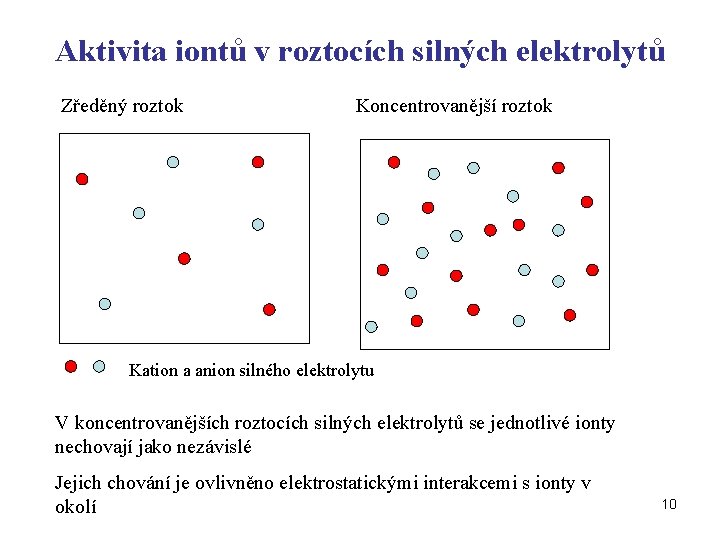
Aktivita iontů v roztocích silných elektrolytů Zředěný roztok Koncentrovanější roztok Kation a anion silného elektrolytu V koncentrovanějších roztocích silných elektrolytů se jednotlivé ionty nechovají jako nezávislé Jejich chování je ovlivněno elektrostatickými interakcemi s ionty v okolí 10

Chování iontů závisející na množství iontů popisuje aktivita ai = i ci i. . . aktivitní koeficient ci……koncentrace 1 Výpočet aktivitního koeficientu z Debye. Hűckelova vztahu: Z- náboj iontu, I-iontová síla 11

Iontová síla roztoku ci – koncentrace daného iontu zi - náboj daného iontu Je funkcí koncentrace (molární) a náboje iontů Protože iontová síla biologicky významných roztoků je relativně vysoká, je ji nutno brát v úvahu při všech výpočtech, kde se vyskytuje aktivita iontů a nespoléhat se na oblíbené konstatování, že „koncentrace látek v roztoku je nízká a místo aktivit můžeme použít koncentrace”. 12

Jaká je iontová síla roztoku Na 2 SO 4 o koncentraci 0, 1 mol/l ? Řešení: Na 2 SO 4 Na+ + SO 42 - 2 Na+ + SO 42 c 1= c(Na+) = 2 ∙ 0, 1 = 0, 2 mol/l c 2 = c(SO 42 -) = 0, 1 mol/l z 1= z(Na+) = 1 z 2 = z(SO 42 -) = 2 I = ½ (0, 2 ∙ 12 + 0, 1 ∙ 22) = ½ (0, 2 + 0, 4 )= 0, 3 mol/l 13

Koligativní vlastnosti roztoků vlastnosti závislé pouze na koncentraci (počtu) částic solutu, nikoliv na jeho kvalitě (nejsou závislé na velikosti molekul, jejich tvaru nebo náboji) Koligativní vlastnosti: snížení tlaku par rozpouštědla nad roztokem osmotický tlak 14

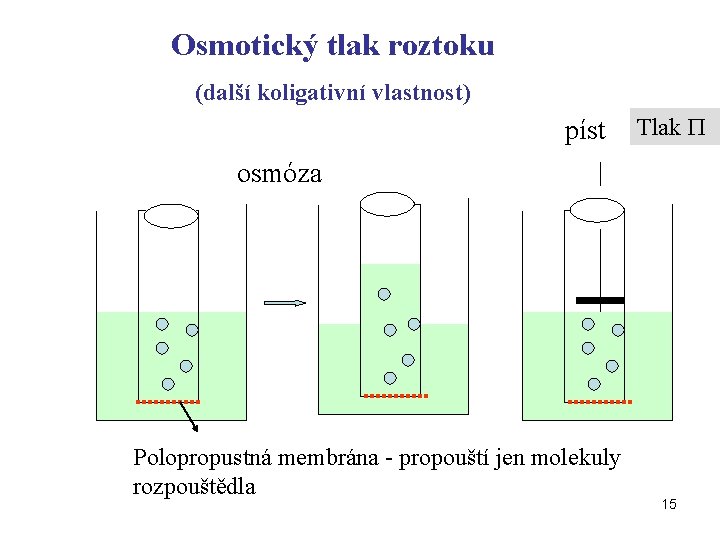
Osmotický tlak roztoku (další koligativní vlastnost) píst Tlak osmóza Polopropustná membrána - propouští jen molekuly rozpouštědla 15

Zjištění osmotického tlaku • měření (osmometry) • výpočet 16

Osmometry – měření osmotického tlaku 1 Principy měření: • snížení bodu tuhnutí (citlivé teploměry s rozlišitelností 0, 001 o C)* • zvýšení teploty varu (snížení rosného bodu)* • membránové (přímé) * Zjišťuje se molalita, převádí se na hodnotu osmotického tlaku 1 Podrobněji: M. Dastych: Instrumentální technika 17

Výpočet osmotického tlaku (přibližný výpočet, známe-li látkovou koncentraci) = i. c. R. T. (k. Pa) c - koncentrace mol. l-1 R - universální plynová konstanta 8, 314 J. mol-1. K-1 T - teplota (o K) 18

Jaký význam má i Neelektrolyty i=1 Silné elektrolyty: n=2, 3, …. Slabé elektrolyty i = 1 + αc(N – 1) i - koeficient, udávající počet částic vzniklých disociací elektrolytů α – stupeň disociace N- počet iontů vzniklých disociací jedné molekuly 19

Hodnoty i pro silné elektrolyty Na. Cl Na+ + Cl- i=2 Na 2 SO 4 2 Na+ + SO 42 - i=3 Mg. Cl 2 Mg 2+ + 2 Cl- i=3 Na 3 PO 4 3 Na+ + PO 43 - i=4 20

Koncentrace osmoticky aktivních částic = i. c. R. T. (k. Pa) Osmolalita (osmolální koncentrace) Osmolarita (osmolární koncentrace) i. c………. mol/kg i. c………. . mol/l zjistí se měřením (kryoskopicky, ebulioskopicky) vypočítá se z hodnot molárních koncentrací Vždy vyšší než odpovídá reálným vlastnostem roztoku 21

Příklad 1: Jaký osmotický tlak vykazuje fyziologický roztok chloridu sodného ? (T = 298 K ) c(Na. Cl) = 0, 154 mol. l-1 Na. Cl Na+ + Cl- silný elektrolyt i=2 Osmolarita : i. c = 2 x 0, 154 = 0, 308 mol/l Osmotický tlak = 2. 0, 154. 8, 31. 298 = 762, 7 k. Pa 22

Příklad 2: Jaký osmotický tlak vykazuje roztok glukosy o koncentraci 0, 154 mol/l? (T = 250 C ) glukosa je neelektrolyt i=1 osmolarita odpovídá molární koncentraci = 1. 0, 154. 8, 31. 298 = 381, 4 k. Pa Roztok glukosy má poloviční osmotický tlak než roztok Na. Cl o stejné koncentraci. 23

Osmotický tlak v roztoku obsahujícím více látek = R. T i. c -suma koncentrací všech osmoticky aktivních částic 24

Osmotický tlak v živých organismech (příklady) 25

Osmolarita a tonicita Roztoky izotonické = mají stejný osmotický tlak Osmolarita x tonicita Roztoky se stejnou osmolaritou oddělené membránou mají stejný osmotický tlak pokud osmoticky účinné látky membránou neprocházejí. 26

Osmotický tlak krevní plazmy - přísná regulace ( 795 k. Pa) Osmolalita krevní plazmy 280– 295 mmol. kg-1 Závisí především na koncentraci Na Nízká osmolalita – (až 230 mmol/kg): nedostatek sodíku nebo příliš mnoho vody Vysoká osmolalita – (až 400 mmol/kg): hypernatremie, hyperglykemie, uremie, přítomnost cizích molekul) 27

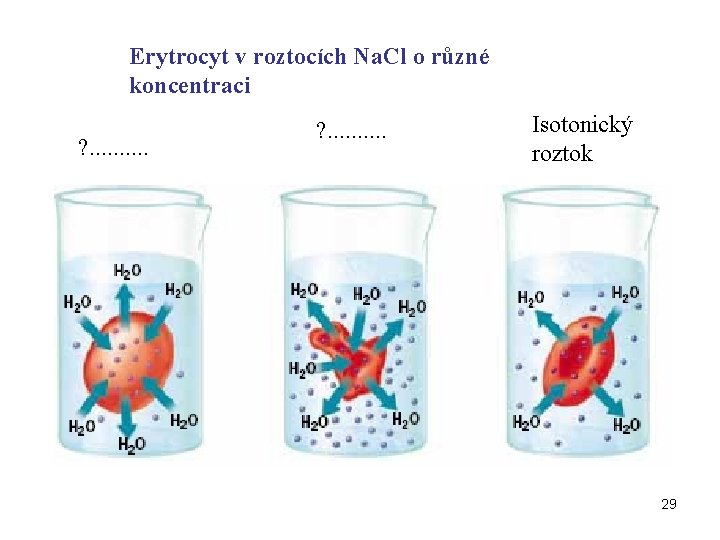
Erytrocyty a „isotonické“ roztoky Krevní plazma a cytosol erytrocytů (i všech dalších buněk) jsou izotonické Roztoky izotonické s krevní plazmou: 155 mmol/l Na. Cl 310 mmol/l glukosa 28

Erytrocyt v roztocích Na. Cl o různé koncentraci ? . . Isotonický roztok 29

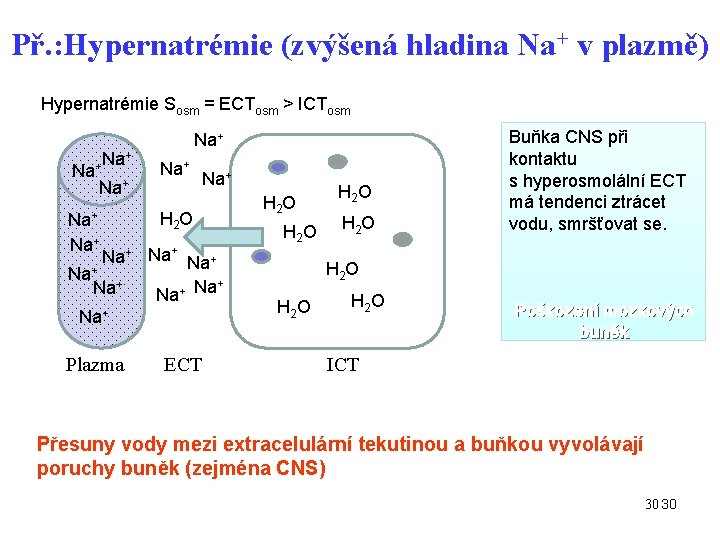
Př. : Hypernatrémie (zvýšená hladina Na+ v plazmě) Hypernatrémie Sosm = ECTosm > ICTosm Na+ Na+ H 2 O Na+ Na+ + + Na Na+ Plazma ECT H 2 O Buňka CNS při kontaktu s hyperosmolální ECT má tendenci ztrácet vodu, smršťovat se. H 2 O Poškození mozkových buněk ICT Přesuny vody mezi extracelulární tekutinou a buňkou vyvolávají poruchy buněk (zejména CNS) 30 30

Zjištění osmolality krevní plazmy osmolalita plazmy (mmol. kg-1 H 2 O) - výpočet ≈ 2 [Na+] + [glukosa] + [močovina] ≈ 1, 86 [Na+] + [glukosa] + [močovina] + 9 osmolalita plazmy (mmol. kg-1 H 2 O) -měření osmometry rozdíl mezi naměřenou a vypočtenou hodnotou (osmolární gap) může být vyvolán přítomností další látky ve vysoké koncentraci (ethanol, aceton, ethylenglykol. . ) 31

Bílkoviny v krevní plazmě koloidně osmotický tlak = onkotický tlak ( 0, 5% z celkového tlaku plazmy) podílí se hlavně albumin při poklesu koncentrace bílkovin v krvi dochází k přesunům vody z plazmy do intersticia (edémy) 32

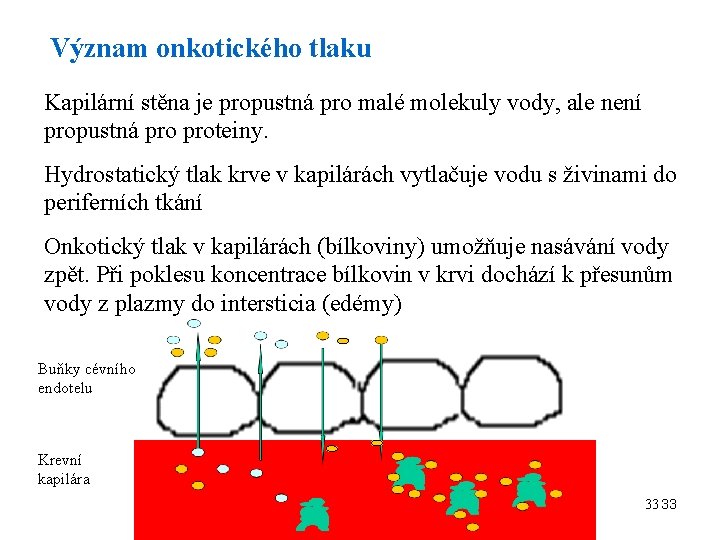
Význam onkotického tlaku Kapilární stěna je propustná pro malé molekuly vody, ale není propustná proteiny. Hydrostatický tlak krve v kapilárách vytlačuje vodu s živinami do periferních tkání Onkotický tlak v kapilárách (bílkoviny) umožňuje nasávání vody zpět. Při poklesu koncentrace bílkovin v krvi dochází k přesunům vody z plazmy do intersticia (edémy) Buňky cévního endotelu Krevní kapilára 33 33

Polyurie při diabetes mellitus Při vysoké hladině glukosy v krvi se glukosa v ledvinách nestačí resorbovat a odchází do moče, současně osmoticky poutá vodu Terapie mannitolem Působí jako osmotické diuretikum (po intravenózním podání se filtruje v ledvinách, nevstřebává se a osmoticky poutá vodu) INFUSIO MANNITOLI 10% INFUSIA INFUSIO MANNITOLI 20% INFUSIA infuzní roztok Složení: 10% 20% 1000 ml infuzního roztoku obsahuje: Mannitolum 100 g 200 g Aqua pro iniectione ad 1000 ml Teoretická osmolarita 549 mosmol/l 1098 mosmol/l 34

Struktura chrupavky vysoký obsah glykosaminoglykanů (obsahují početné skupiny uronových kyselin, kys. sírové), vysoký obsah iontů Na, Mg, Ca váže velké množství vody vysoký osmotický tlak při zatížení vytlačení vody uvolnění zátěže návrat vody 35
 Co to je iont
Co to je iont Kladny iont
Kladny iont Roztoky chemia 7 rocnik
Roztoky chemia 7 rocnik Matematika směsi a roztoky
Matematika směsi a roztoky šla žitím matka má jak kajícnice smutná
šla žitím matka má jak kajícnice smutná Thomas sla
Thomas sla Sla se
Sla se Petrus pemegang kunci kerajaan surga
Petrus pemegang kunci kerajaan surga Interlanguage continuum
Interlanguage continuum Sla audit checklist
Sla audit checklist Sla certification
Sla certification Primo motoneurone
Primo motoneurone Https://www.servicetonic.es/service-desk/que-es-un-sla/
Https://www.servicetonic.es/service-desk/que-es-un-sla/ Acculturation model and accommodation theory of sla
Acculturation model and accommodation theory of sla Ms premier support services
Ms premier support services Ebs sla
Ebs sla Sla theory
Sla theory Davide sla
Davide sla Individual differences in sla
Individual differences in sla Joint geometry
Joint geometry All probability formulas
All probability formulas Kpi sla examples
Kpi sla examples Sla meme
Sla meme Sla singkatan dari
Sla singkatan dari Sla quiz
Sla quiz Ntt sla
Ntt sla Salesforce sla agreement
Salesforce sla agreement Sla servicing student loans
Sla servicing student loans Sla tma
Sla tma Criteri el escorial
Criteri el escorial Sla ou slem
Sla ou slem Azure sql server sla
Azure sql server sla Krashen 5 hypothesis
Krashen 5 hypothesis Https://www.servicetonic.es/service-desk/que-es-un-sla/
Https://www.servicetonic.es/service-desk/que-es-un-sla/ Sla 99,99%
Sla 99,99% Motivation sla
Motivation sla



























































