Roztoky elektrolyt Acidobazick reakce II PUFRY Biochemick stav

Roztoky elektrolytů Acidobazické reakce II PUFRY © Biochemický ústav LF MU (E. T. ) 2009

Tlumivé roztoky (pufry) Látky, pomocí kterých lze: • nastavit přesnou hodnotu p. H • udržet dané p. H v určitých mezích • tlumit výkyvy p. H způsobené omezeným přídavkem kyseliny či zásady.

Pufry jsou nejčastěji: • směs slabé kyseliny a (její) soli se silnou zásadou (kys. octová a octan sodný) • směs slabé zásady a (její) soli se silnou kyselinou (amoniak a chlorid amonný) • směs solí vícesytné kyseliny (hydrogenfosforečnan a dihydrogenfosforečnan sodný)

Složení pufru Příklad: roztok (CH 3 COOH + CH 3 COONa) (ve srovnatelných koncentracích) Částice přítomné v roztoku: CH 3 COO- CH 3 COOH Na+ H+ (hlavně ze soli z kyseliny ze soli z kyseliny) Přítomnost CH 3 COO- ze soli potlačuje disociaci CH 3 COOH Rovnováha v roztoku: CH 3 COOH CH 3 COO- + H+
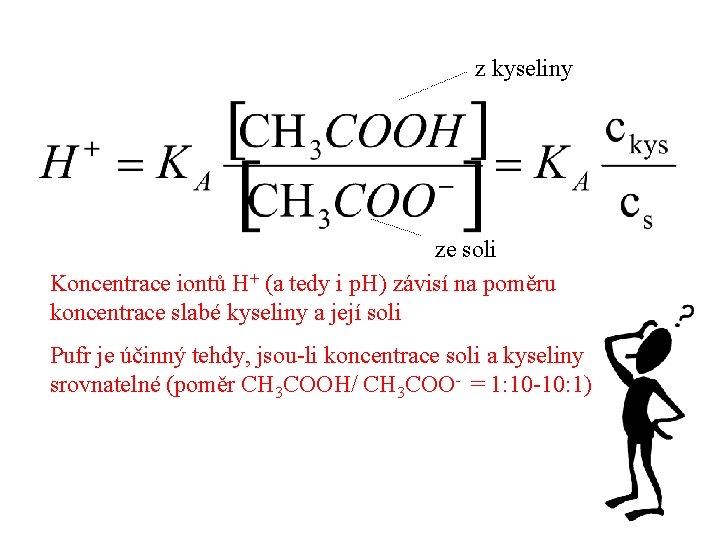
z kyseliny ze soli Koncentrace iontů H+ (a tedy i p. H) závisí na poměru koncentrace slabé kyseliny a její soli Pufr je účinný tehdy, jsou-li koncentrace soli a kyseliny srovnatelné (poměr CH 3 COOH/ CH 3 COO- = 1: 10 -10: 1)

Jak pufr působí Př. : Do roztoku přidáme silnou kyselinu H+ ionty → porušíme rovnováhu Rovnováha v roztoku se opět vytvoří: CH 3 COO- + H+ CH 3 COOH Aby byla zachována rovnováha, část H+ iontů se sloučí na CH 3 COOH • většina přidaných H+ je vázána jako slabá kyselina, její disociace je potlačena přítomností CH 3 COO • poměr koncentrací CH 3 COOH a CH 3 COO- se však příliš nemění, [H]+ také ne (protože koncentrace obou složek směsi jsou srovnatelné)

Př. : Do roztoku přidáme silný hydroxid OH- ionty → porušíme rovnováhu CH 3 COOH + OH- CH 3 COO- + H 2 O Zvýší se koncentrace CH 3 COOAby byla zachována rovnováha, část CH 3 COO- iontů se sloučí na CH 3 COOH • přibylo iontů CH 3 COO-, část se přeměnila na CH 3 COOH • poměr koncentrací CH 3 COOH a CH 3 COOH se však příliš nemění, [H+] také ne (protože koncentrace obou složek soli jsou srovnatelné)

Hodnota p. H pufru Henderson-Hasselbalchova rovnice v obecném tvaru c. B – koncentrace bazické složky pufru (sůl slabé kyseliny u kyselého pufru nebo slabá báze u bazického pufru) c. A– koncentrace kyselé složky pufru (slabá kyselina u kyselého pufru nebo sůl slabé báze u bazického pufru)

Na čem závisí p. H pufru ? na hodnotě p. KA na poměru koncentrace sbazické složky a kyselé složky

Jaké bude p. H octanového pufru připraveného z 0, 5 l kyseliny octové, c=0, 2 mol/l a 0, 5 l octanu sodného c=0, 4 mol/l ? (p. KA=4, 73) Jaké bude p. H octanového pufru připraveného z 0, 2 l kyseliny octové, c=0, 4 mol/l a 0, 3 l octanu sodného c=0, 2 mol/l ?

Kapacita pufru - vyjadřuje účinnost pufru = množství H+ nebo OH- iontů , které je třeba přidat k 1 l pufru, aby se p. H změnilo o 1 (resp. 0, 1)

Na čem závisí kapacita pufru ? • na poměru koncentrací obou složek • na koncentraci obou složek pufru

Závislost kapacity na poměru koncentrací Změna poměru koncentrací je nejmenší, jsou-li koncentrace soli i kyseliny stejné Kapacita je nejvyšší, jestliže c. B/c. A = 1 log 1 = 0 pak p. H = p. KA Účinné pufry mají p. H = p. K 1 ( c. B/c. A = 1/10 -10 /1)

Závislost kapacity na koncentraci Při stejném poměru obou složek pufru má větší kapacitu pufr s vyšší koncentrací

Jak připravíme účinný pufr s danou hodnotou p. H ?

Pufry používané v biologii - příklady HEPES (N-2 -Hydroxyethylpiperazin-N'-2 -ethansulfonová kyselina p. KA = 7, 3 při 37°C Tris-(hydroxymethyl)-aminomethan, p. KA = 8, 3 při 20°C MEG (N-methylglukamin) p. KA = 9, 52 při 25°C Odhadněte, pro jaké přibližné hodnoty p. H jsou vhodné tyto pufry?


Pufrační systémy v organismu Krev p. H krve 7, 40 0, 04 Nejvýznamnější pufry v krvi: Hydrogenuhličitanový pufr: HCO 3 -/H 2 CO 3 Bílkoviny (hemoglobin, albumin): Protein/Protein H+ Hydrogenfosfátový pufr: HPO 42 -/H 2 PO 4 - Všechny pufrační systémy působí koordinovaně

Hydrogenuhličitanový pufr (hydrogenkarbonátový) CO 2 + H 2 O H 2 CO 3 H+ + HCO 3 • CO 2 se rozpouští ve vodě a jeho malá část vytváří H 2 CO 3 • Koncentrace H 2 CO 3 závisí na koncentraci CO 2 • Namísto koncentrace [H 2 CO 3] používáme efektivní koncentraci [H 2 CO 3]eff [CO 2 + H 2 CO 3] = [H 2 CO 3]ef efektivní koncentrace Její mírou je p. CO 2 nad roztokem

Namísto KA pro kys. uhličitou vyjadřujeme KAef (voda, 25 C) p. KAef = 6, 37 pro krev (t =37 o. C, vyšší iontová síla) p. KAeff = 6, 10
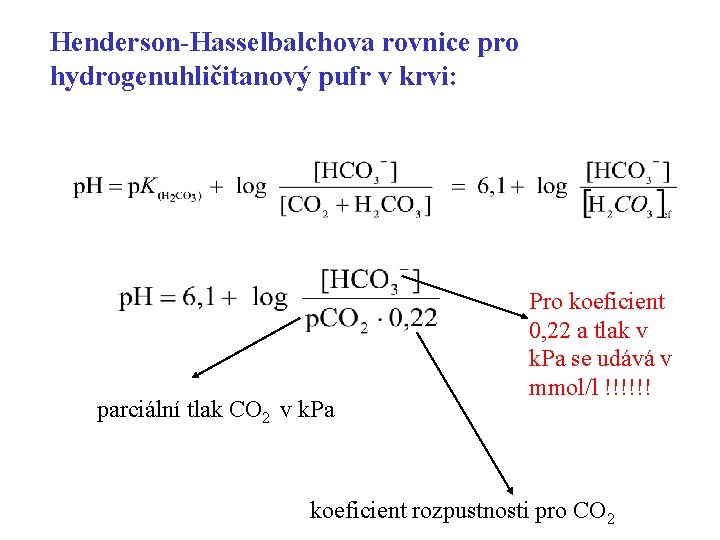
Henderson-Hasselbalchova rovnice pro hydrogenuhličitanový pufr v krvi: parciální tlak CO 2 v k. Pa Pro koeficient 0, 22 a tlak v k. Pa se udává v mmol/l !!!!!! koeficient rozpustnosti pro CO 2

Jak působí hydrogenuhličitanový pufr ? Otevřený systém - množství CO 2 může regulovat ventilací CO 2 + H 2 O H 2 CO 3 H+ + HCO 3 plíce H+ H+ + HCO 3 - H 2 CO 3 CO 2 + H 2 O OH- + H 2 CO 3 HCO 3 - + H 2 O CO 2 + H 2 O ledviny

Hydrogenkarbonátový pufr působí jako otevřený pufrový systém Koncentrace obou složek mohou být změněny: CO 2 dýcháním HCO 3 - činností jater a ledvin

Disociace H 2 CO 3 do druhého stupně HCO 3 - H+ + CO 32 p. K 2 = 10, 25 nemá pro udržování p. H krve význam Proč?
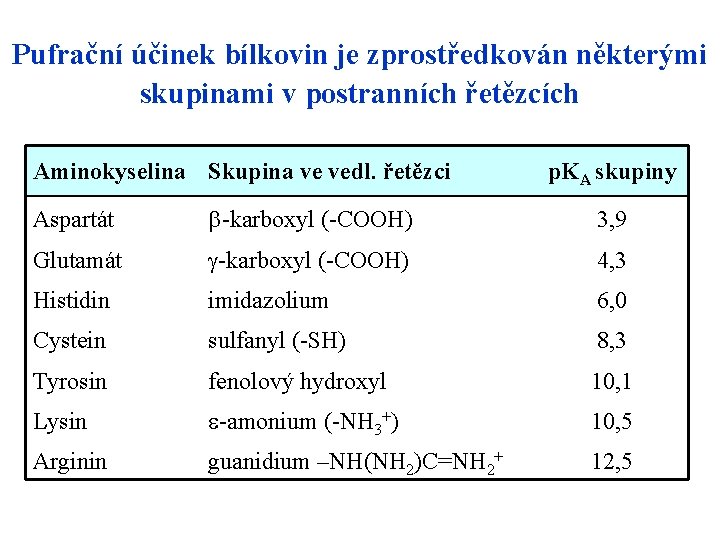
Pufrační účinek bílkovin je zprostředkován některými skupinami v postranních řetězcích Aminokyselina Skupina ve vedl. řetězci p. KA skupiny Aspartát -karboxyl (-COOH) 3, 9 Glutamát -karboxyl (-COOH) 4, 3 Histidin imidazolium 6, 0 Cystein sulfanyl (-SH) 8, 3 Tyrosin fenolový hydroxyl 10, 1 Lysin -amonium (-NH 3+) 10, 5 Arginin guanidium –NH(NH 2)C=NH 2+ 12, 5

Která z uvedených AK se může efektivně podílet na udržení p. H 7, 4 ?

Nejvýznamnější aminokyselinou z hlediska pufračního účinku bílkovin v krvi je histidin N N H CH 2 -CH-COONH 3 + Reverzibilní protonizace a deprotonizace OH- p. KA ≈ 6 H+ H + N báze konj. kyselina N H CH 2 -CH-COONH 3 +

Nejvýznamnějším bílkovinným pufrem v krvi je hemoglobin, je to hlavní bílkovina krve Obsahuje histidinové zbytky: např. hemoglobin A (tetramer) má 38 His Pufrační účinky má také albumin (hlavní bílkovina plazmy) a ostatní bílkoviny.

Systém hemoglobin/oxyhemoglobin HHb Hb- + H+ p. KA 7, 8 HHb. O 2 - + H+ p. KA 6, 2 (jedná se o disociace histidinových zbytků) HHb. O 2 vzniká v plicích z HHb a ihned disociuje na Hb. O 2 - + H+ ve tkáních odevzdá Hb. O 2 - kyslík, přijímá proton a mění se na HHb

Vlastnosti Hb. O 2 a Hb O 2 Hb + H+ O 2 + HHb

Acidobazické vlastnosti Hb. O 2 a Hb Animace: O 2 HHb H+

Acidobazické vlastnosti Hb. O 2 a Hb Animace: HHb O 2 H+

Hydrogenfosfátový pufr HPO 42 - / H 2 PO 4 - p. KA 2 = 6, 8 koncentrace fosfátů v krvi je nízká působí jako účinný pufr v moči a v buňkách
- Slides: 33