EFEITO DA RADIAO IONIZANTE EM CLULAS PARTE II



















- Slides: 34

EFEITO DA RADIAÇÃO IONIZANTE EM CÉLULAS PARTE II

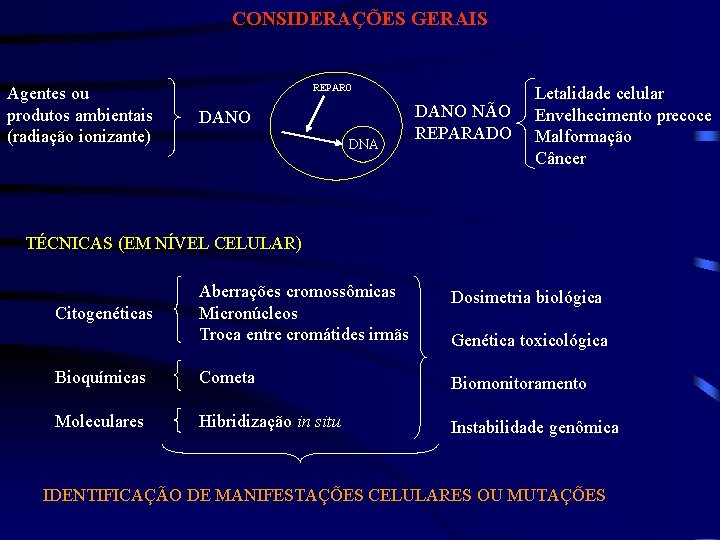
CONSIDERAÇÕES GERAIS Agentes ou produtos ambientais (radiação ionizante) REPARO DANO DNA DANO NÃO REPARADO Letalidade celular Envelhecimento precoce Malformação Câncer TÉCNICAS (EM NÍVEL CELULAR) Aberrações cromossômicas Micronúcleos Troca entre cromátides irmãs Dosimetria biológica Bioquímicas Cometa Biomonitoramento Moleculares Hibridização in situ Instabilidade genômica Citogenéticas Genética toxicológica IDENTIFICAÇÃO DE MANIFESTAÇÕES CELULARES OU MUTAÇÕES

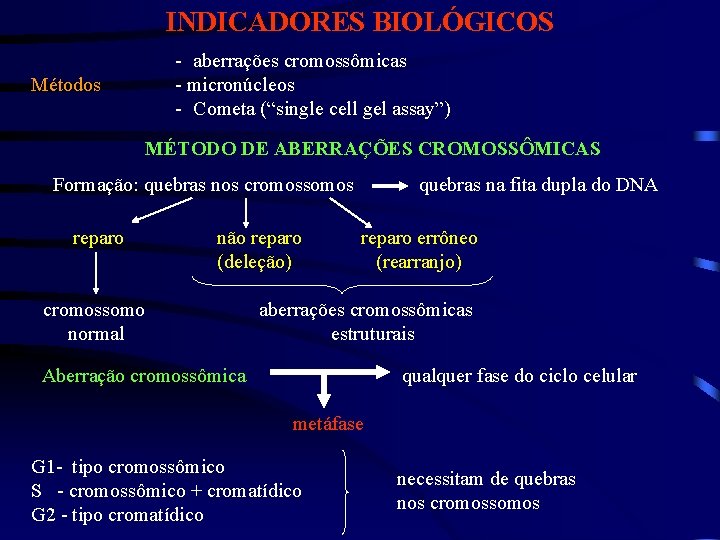
INDICADORES BIOLÓGICOS - aberrações cromossômicas - micronúcleos - Cometa (“single cell gel assay”) Métodos MÉTODO DE ABERRAÇÕES CROMOSSÔMICAS Formação: quebras nos cromossomos reparo não reparo (deleção) cromossomo normal quebras na fita dupla do DNA reparo errôneo (rearranjo) aberrações cromossômicas estruturais Aberração cromossômica qualquer fase do ciclo celular metáfase G 1 - tipo cromossômico S - cromossômico + cromatídico G 2 - tipo cromatídico necessitam de quebras nos cromossomos

ABERRAÇÃO TIPO CROMOSSÔMICO

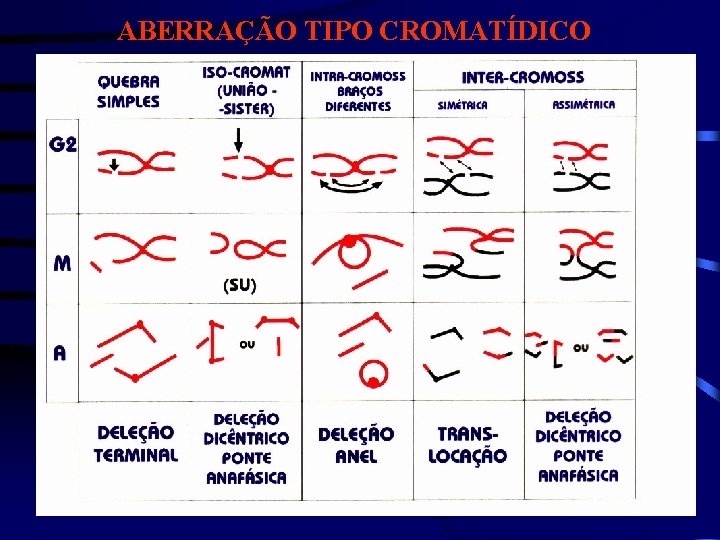
ABERRAÇÃO TIPO CROMATÍDICO

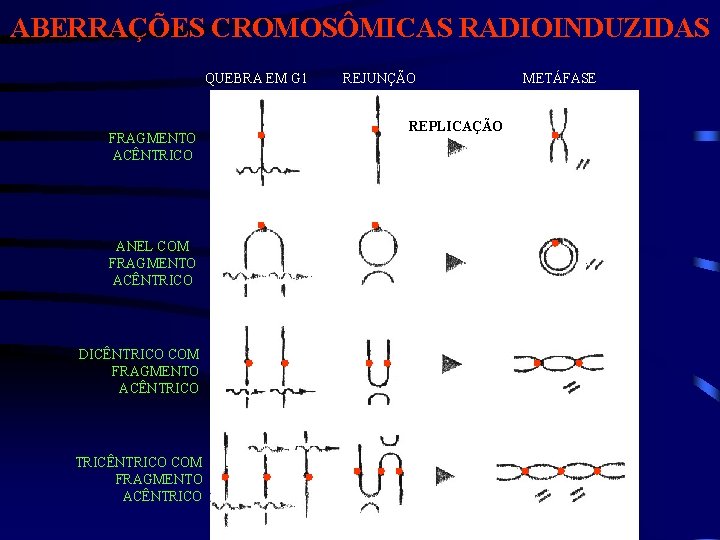
ABERRAÇÕES CROMOSÔMICAS RADIOINDUZIDAS QUEBRA EM G 1 FRAGMENTO ACÊNTRICO ANEL COM FRAGMENTO ACÊNTRICO DICÊNTRICO COM FRAGMENTO ACÊNTRICO TRICÊNTRICO COM FRAGMENTO ACÊNTRICO REJUNÇÃO REPLICAÇÃO METÁFASE

DOSIMETRIA BIOLÓGICA ESTIMATIVA DE DOSE ABSORVIDA frequência de aberrações encontadas em linfócitos de indivíduos expostos frequência observada em lifócitos irradiados in vitro com doses conhecidas Curvas dose - resposta LINFÓCITOS “dosímetros biológicos” - altamente radiossensíveis - população naturalmente sincrônica de células - ampla distribuição corpórea (G 0 G 1) - facilmente coletadas - in vitro = in vivo

Moorhead et al. (1960) - desenvolvimento de técnicas de cultivo de linfócitos humanos in vitro, utilizando um mitogênico. Linfócitos (G 0 G 1) células blásticas MITOSE PHA (Phaseolus vulgaris) Bender e Gooch (1962) - propuseram a análise de aberrações cromossômicas para a avaliação quantitativa de dose absorvida de radiação.

CULTURA DE LINFÓCITOS (48 h) (Construção de Curva de Calibração) - Coleta do sangue (5 m. L) - Fracionamento de amostras sanguíneas e irradiação com várias doses (10 -500 c. Gy) - Cultivo a 37 o. C sangue total + meio de + soro fetal + mitogênico + antibiótico (0, 5 m. L) cultura bovino PHA - Adição de colchicina (2 h antes da fixação) - Adição de solução hipotônica (KCl 0, 075 M) - Fixação com metanol + ácido acético (3: 1) - Preparação de l 6 aminas: fixação a 65 o. C - Coloração com Giemsa a 2% 1 a divisão em cultura: 40 Cada laboratório 54 h -Brd. U -critérios 48 h padronização da técnica obtenção de curva - padrão 2 a divisão: 72 h - Sensibilidade da técnica: estimativa de dose, da ordem de 5 c. Gy de radiação de baixa LET - para cada dose de radiação: pelo menos 100 metáfases analisadas

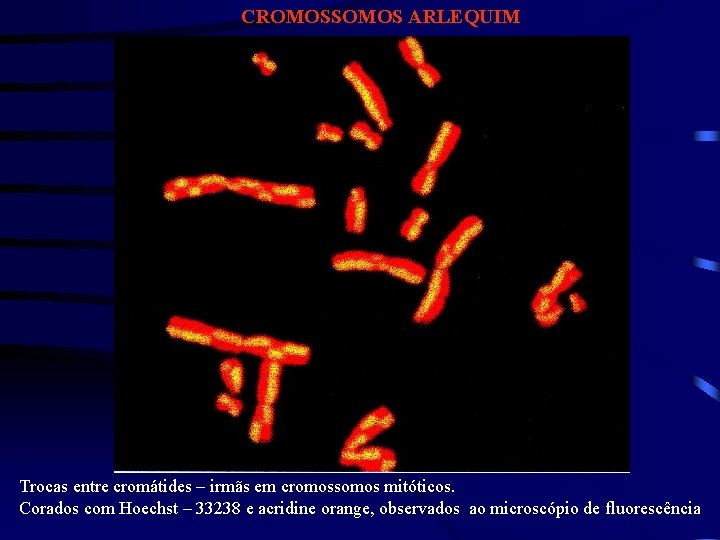
CROMOSSOMOS ARLEQUIM Trocas entre cromátides – irmãs em cromossomos mitóticos. Corados com Hoechst – 33238 e acridine orange, observados ao microscópio de fluorescência



CURVA DOSE-RESPOSTA Todos os tipos de radiação ionizante – mesmo tipo de aberrações cromossômicas em células expostas Frequência de aberrações induzidas – depende da dose, depende do tipo de radiação LET = quantidade de E depositada na matéria por unidade de comprimento do trajeto (ke. V/mm) alto LET baixo LET xxxx x x x x Ilustração diagramática da densidade de ionização relativa por alvo de uma trajetória simples para radiação de alta e baixa LET x

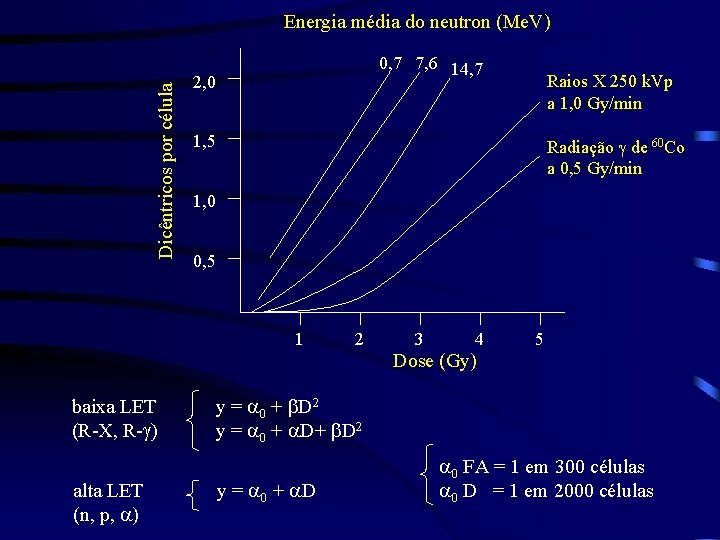
Dicêntricos por célula Energia média do neutron (Me. V) 0, 7 7, 6 14, 7 2, 0 Raios X 250 k. Vp a 1, 0 Gy/min 1, 5 Radiação g de 60 Co a 0, 5 Gy/min 1, 0 0, 5 1 2 3 4 5 Dose (Gy) baixa LET (R-X, R-g) alta LET (n, p, a) y = a 0 + b. D 2 y = a 0 + a. D a 0 FA = 1 em 300 células a 0 D = 1 em 2000 células

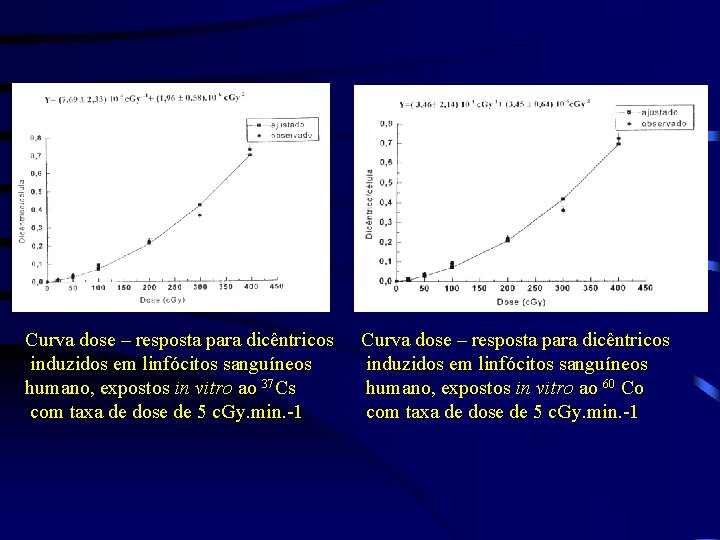
Curva dose – resposta para dicêntricos induzidos em linfócitos sanguíneos humano, expostos in vitro ao 37 Cs com taxa de dose de 5 c. Gy. min. -1 Curva dose – resposta para dicêntricos induzidos em linfócitos sanguíneos humano, expostos in vitro ao 60 Co com taxa de dose de 5 c. Gy. min. -1

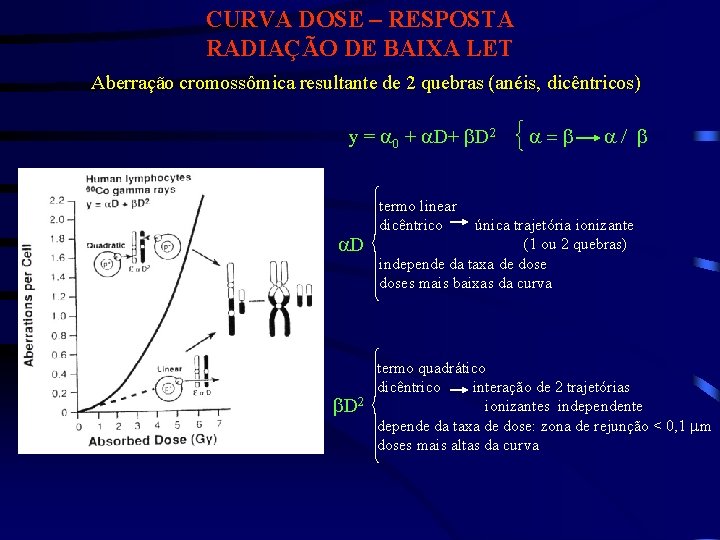
CURVA DOSE – RESPOSTA RADIAÇÃO DE BAIXA LET Aberração cromossômica resultante de 2 quebras (anéis, dicêntricos) y = a 0 + a. D+ b. D 2 a. D a=b a/ b termo linear dicêntrico única trajetória ionizante (1 ou 2 quebras) independe da taxa de doses mais baixas da curva termo quadrático dicêntrico interação de 2 trajetórias 2 ionizantes independente b. D depende da taxa de dose: zona de rejunção < 0, 1 mm doses mais altas da curva


MÉTODO DO MICRONÚCLEO Origem Tamanho- 1 - fragmentos acêntricos - cromossomos inteiros 20 a 1 5 de do núcleo principal Indicadores - agentes clastogênicos - agentes aneugêncios Schmidt (1975) – células da medula óssea de camundongos Countryman e Heddle (1976) – relação quantitativa entre a dose e a frequência de MN em linfócitos humanos

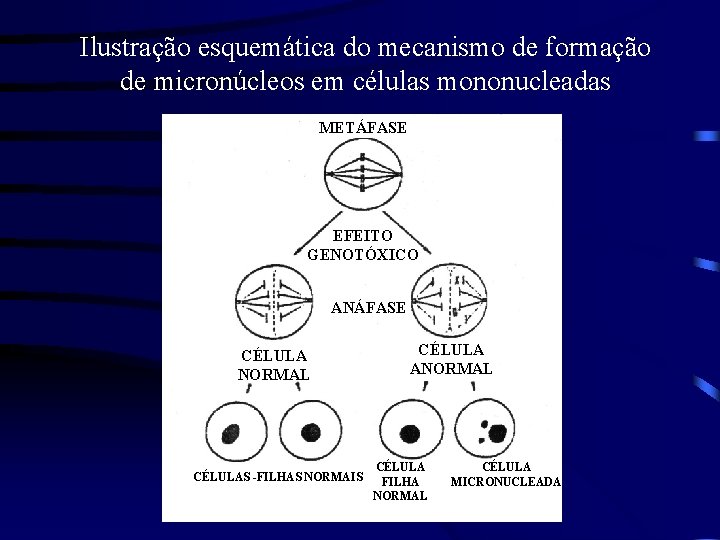
Ilustração esquemática do mecanismo de formação de micronúcleos em células mononucleadas METÁFASE EFEITO GENOTÓXICO ANÁFASE CÉLULA NORMAL CÉLULAS -FILHAS NORMAIS CÉLULA ANORMAL CÉLULA FILHA NORMAL CÉLULA MICRONUCLEADA

Fenech & Morley (1985) – “cytokinesis block method” Citocalasina B – Helminthosporum dematoideum inibe a citocinese, mas não a carciocinese célula binucleada (1 divisão nuclear) Cultivo: adição de cito B, 44 horas após tratamento isotônico – preservação do citoplasma para cada dose – 500 células binucleadas Desvantagem - não oferece toda a informação - 10 a 12 MN / 1000 binucleadas Vantagens - relativamente simples e sensível - análise mais rápida - bom indicador de dano genético - magnitude do dano ocorrido

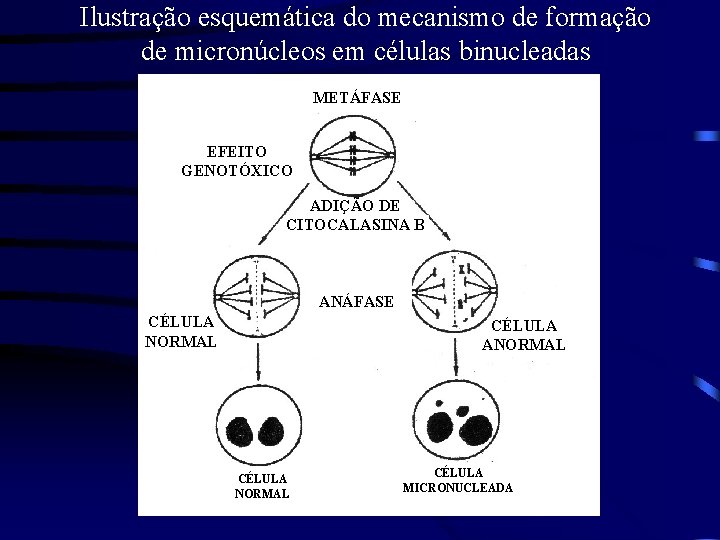
Ilustração esquemática do mecanismo de formação de micronúcleos em células binucleadas METÁFASE EFEITO GENOTÓXICO ADIÇÃO DE CITOCALASINA B ANÁFASE CÉLULA NORMAL CÉLULA ANORMAL CÉLULA MICRONUCLEADA

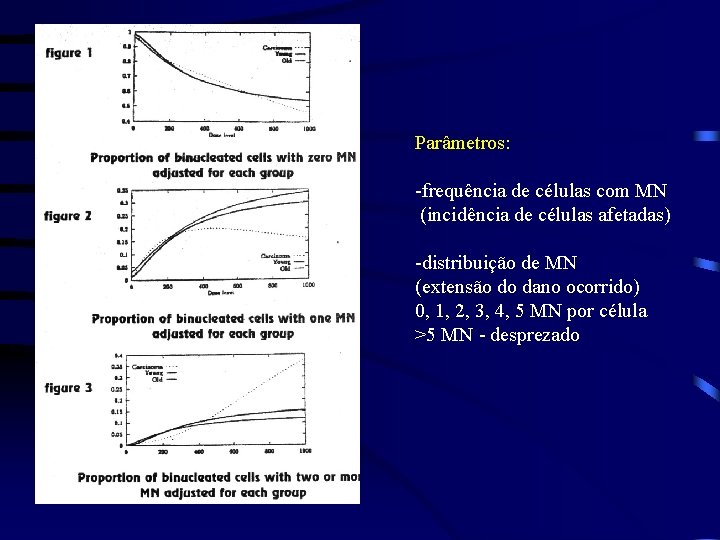
Parâmetros: -frequência de células com MN (incidência de células afetadas) -distribuição de MN (extensão do dano ocorrido) 0, 1, 2, 3, 4, 5 MN por célula >5 MN - desprezado



TESTE DO COMETA (“SINGLE CELL GEL ASSAY”) Ostling & Johanson (1984) – técnica eletroforética de microgel condição neutra quebra na dupla fita direta visualização do dano em nível de célula individual Singh et al. (1988) – condição alcalina quebra na fita simples sítios álcali-lábeis

Número e tipo de lesões radio – induzidas no DNA (Resnick (67), Warters e Childers (74) e Wlodek e Hittelman (75)) Tipo de lesão Número por gray Quebra fita dupla (dsb) Quebra simples fita (ssb) Dano na base Dano no acúcar ligações cruzadas (crosslinks) DNA – DNA ligações cruzadas DNA – proteínas Sítos álcali – lábeis 40 500 – 1000 – 2000 800 – 1600 30 150 200 - 300 1 Gy de radiação de baixa LET 1 quebra na fita dupla 25 quebras na fita simples / cromossomo

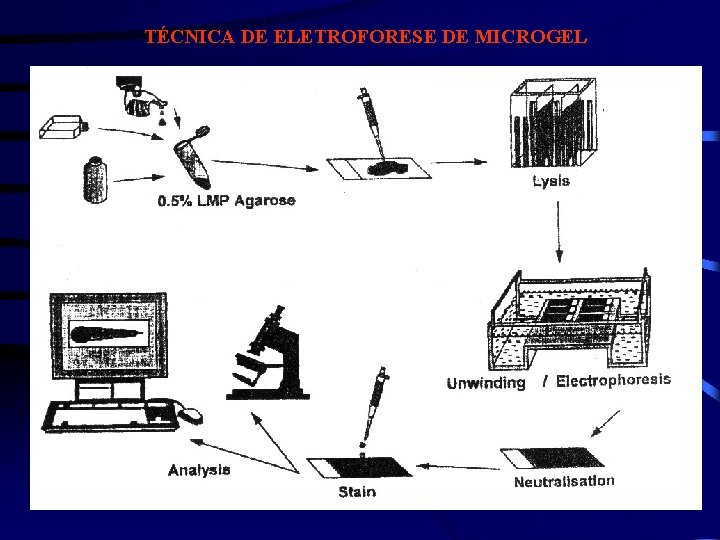
PRINCÍPIO DO MÉTODO -DNA nuclear altamente organizado -Molécula de DNA de células de eucarioto -(50 – 100 cm de comprimento) 105 x núcleo (5 -10 mm Interpretação esquemática do padrão de migração do DNA, formando estrutura semelhante ao do cometa )


TÉCNICA DE ELETROFORESE DE MICROGEL

PAR METROS - Comprimento da imagem ou do Cometa ( cabeça + cauda) DNA do nucleóide DNA que migrou - Comprimento da Cauda (distância de migração de DNA) magnitude de dano ocorrido - Área do Cometa - “Tail moment” = quantidade DNA X comprimento na cauda da cauda intensidade de fluorescência

VANTAGENS 1. Análise direta do dano no DNA em nível de célula individual 2. Quantidade pequena de células ( da ordem de m. L) 3. Relativa facilidade na obtenção de dados 4. Análise de 50 células / dose 5. Sensibilidade: 5 c. Gy de radiação de baixa LET 6. Estudo de danos no DNA e reparo: danos oxidativos, dosimetria biológica, biomonitoramento e estudos de apoptose

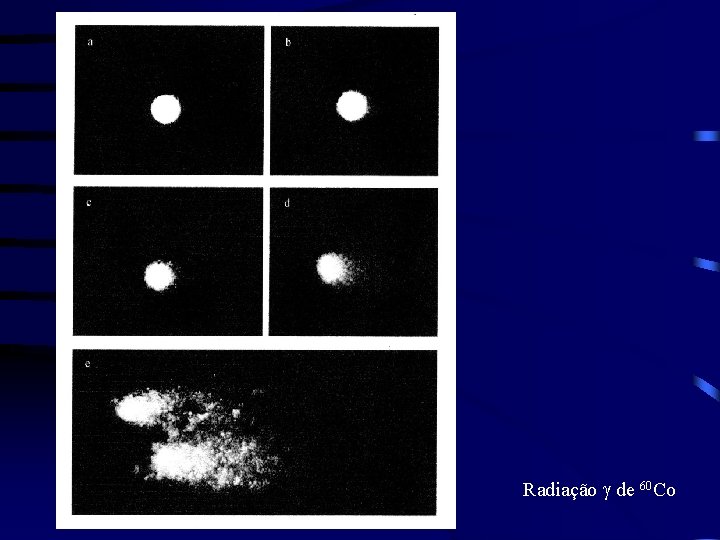
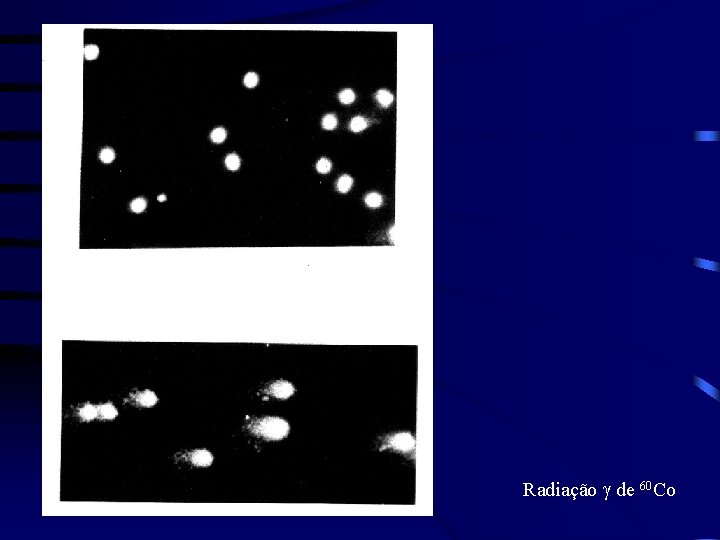
Radiação g de 60 Co

Radiação g de 60 Co

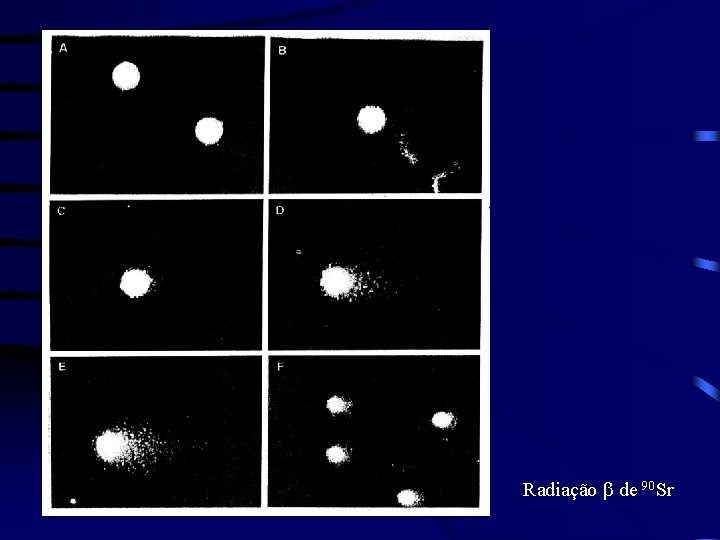
Radiação b de 90 Sr
 Compensação de slutsky
Compensação de slutsky Radiação ionizante
Radiação ionizante Onda ionizante
Onda ionizante Partes da eucaristia
Partes da eucaristia Te invitamos hacer parte
Te invitamos hacer parte Este parte aquele parte
Este parte aquele parte Tabla numeros decimales
Tabla numeros decimales Efeito de hiperconjugação
Efeito de hiperconjugação Efeito doppler
Efeito doppler Efeito de borda
Efeito de borda Efeito fotoelétrico
Efeito fotoelétrico Efeito tyndall
Efeito tyndall Efeito somogyi e alvorecer
Efeito somogyi e alvorecer Efeito marginal
Efeito marginal Ventilação alveolar fórmula
Ventilação alveolar fórmula Analise matematica
Analise matematica Gases de efeito estufa exemplos
Gases de efeito estufa exemplos Esquema de efeito estufa
Esquema de efeito estufa Efeito zeeman
Efeito zeeman Lei do efeito thorndike
Lei do efeito thorndike Coriolis
Coriolis Efeito horn
Efeito horn Efeito doppler
Efeito doppler A força e a exuberância das cores douradas
A força e a exuberância das cores douradas Lei do efeito thorndike
Lei do efeito thorndike Mutatio libelli e emendatio libelli
Mutatio libelli e emendatio libelli Hemoglobina
Hemoglobina Efeito
Efeito Lei do efeito thorndike
Lei do efeito thorndike Bordas
Bordas Efeito batocromico
Efeito batocromico Efeito halo
Efeito halo Efeito da posse
Efeito da posse Efeito compton
Efeito compton Transstores
Transstores