UNIDADE I Espetros radiao e energia Espetros radiao


















- Slides: 31

UNIDADE I Espetros, radiação e energia

Espetros, radiação e energia Na sequência do estudo do Universo, uma questão impõe-se: Como é possível obter informação sobre a composição química de astros tão distantes?

Espetros, radiação e energia • A energia produzida por uma estrela traduz-se pela radiação electromagnética emitida por esta e que percorre o espaço. • É essa radiação, que é recolhida na Terra, que fornece informação sobre a temperatura da estrela, bem como a sua composição química. • Mas, para conhecer a sua composição química, é necessário decompor essa luz, obtendo o seu espetro.

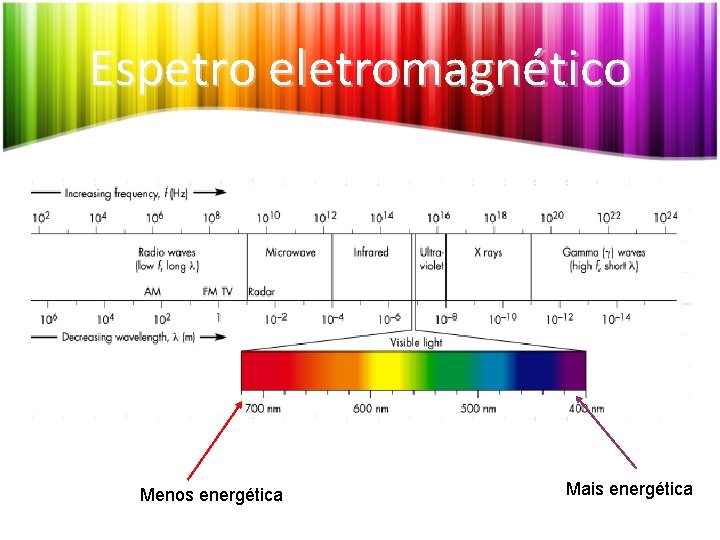
Espetros, radiação e energia • O espetro é o resultado da decomposição da luz. • A luz, ou radiação visível, é apenas uma pequena parte da chamada radiação eletromagnética. • Ao espetro total da luz chamamos espectro eletromagnético.

Espetro eletromagnético Menos energética Mais energética

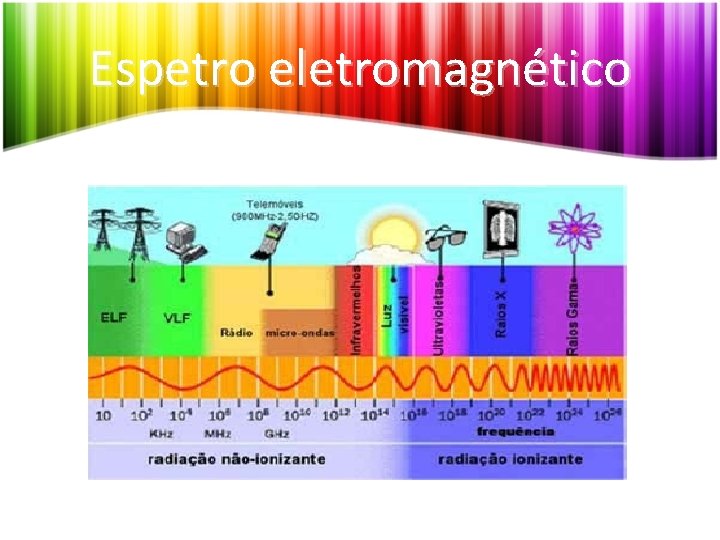
Espetro eletromagnético

Aplicações da radiação eletromagnética Ondas rádio: - Transmissão de rádio e televisão. - Radiotelescópios. Microondas: - Comunicação com veículos espaciais e radioastronomia. - Transmissões por satélite. - Deteção de excesso de velocidade (RADAR). - Fornos microondas.

Aplicações da radiação eletromagnética Infravermelhos: - Tratamento de doenças como reumatismo. - Deteção de tumores no cérebro. - Sistemas de segurança anti-roubo. - Deteção de mísseis por satélite. - portas automáticas e controlos remotos. Ultra-violeta: - Responsáveis pelo bronzeamento. - Esterilização de produtos.

Aplicações da radiação eletromagnética Raios X: - Radiografias. - Controlo de bagagem nos aeroportos. Raios gamas: - Tratamento de certos cancros.

Como obter um espetro? A experiência de Newton Concluiu que a luz branca, por exemplo a luz solar visível, é composta radiações de todas as cores – o prisma simplesmente separa esses componentes. Espetro da luz branca (contínuo)

Como obter um espetro? Espetro da luz branca (contínuo) Espetro do átomo de hidrogénio (descontínuo)

Tipos de espetros Contínuos • Mostra uma gama invariada e ininterrupta de cores. Descontínuos ou de riscas • Mostra riscas correspondentes a radiações que são específicas dos elementos que os originam.

Tipos de espetros Contínuo Descontínuo Espectro de Emissão Descontínuo Espectro de Absorção Astronomy - spectroscopy - 1/3

Espetros das estrelas • Todos os corpos, incandescentes ou não, emitem radiações que originam um espetro de emissão contínuo. Estas radiações conferem-lhes cor, que depende da temperatura a que se encontram.

Espetros das estrelas Espetro de Absorção de uma estrela • Por observação da luz emitida por uma estrela é possível determinar que elementos esta possui na sua constituição. • Utilizando um espetroscópio é possível decompor a luz proveniente da estrela, obtendo o seu espetro. Espetroscópio

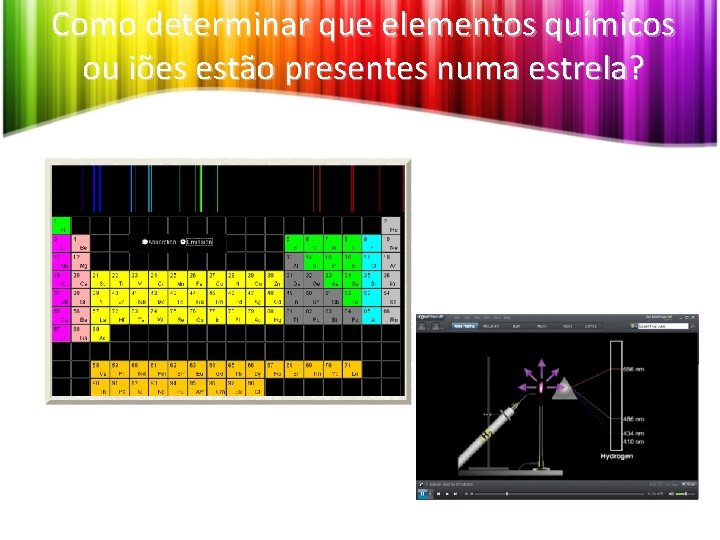
Como determinar que elementos químicos ou iões estão presentes numa estrela?

Como determinar que elementos químicos ou iões estão presentes numa estrela? H He Li Espetros de emissão de diferentes elementos químicos. • Comparando os espetros de absorção e emissão de diferentes elementos, verifica -se que cada elemento tem um único espetro de emissão e um único espetro de absorção, que são diferentes dos espetros dos outros elementos.

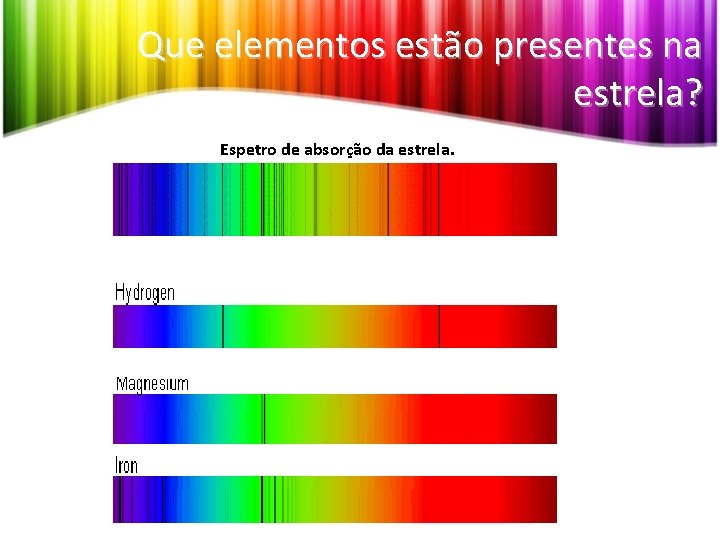
Que elementos estão presentes na estrela? Espetro de absorção da estrela.

Que elementos estão presentes na estrela? Espetro de absorção da estrela. • Comparando as riscas do espetro da estrela com os espetros diferentes elementos químicos (obtidos em laboratório), constata-se que algumas riscas coincidem com as observadas nos espetros de alguns elementos. • O espetro de riscas de um dado elemento é, portanto, característico desse elemento, constituindo uma espécie de “impressão digital” do mesmo e permitindo reconhecer a sua presença em qualquer material ou na atmosfera de uma estrela.

Por que razão se formam espetros de emissão e absorção? • A espetroscopia fotoelectrónica tem por base a análise da energia dos eletrões emitidos por amostras de matéria constituída por certos átomos ou moléculas. • Cada átomo (ou molécula) pode ser identificado por um conjunto de linhas espetrais. • Para compreender como se formam os espetros de emissão ou absorção é necessário estudar a estrutura atómica. Modelos atómicos

Interpretação do espetro de riscas Espetro de emissão do átomo de hidrogénio Foi o físico dinamarquês Niels Bohr quem propôs, pela primeira vez, uma teoria da estrutura atómica que explicava os espetros de emissão de riscas. Bohr (1885 -1962)

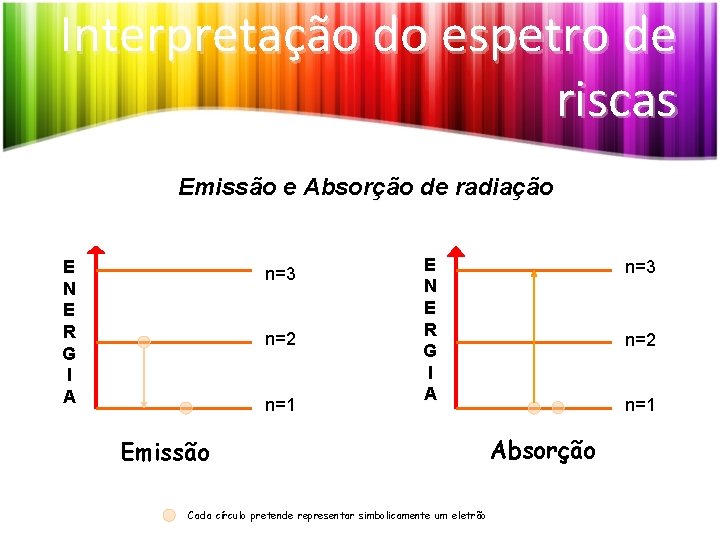
Interpretação do espetro de riscas Emissão e Absorção de radiação E N E R G I A n=3 n=2 n=1 E N E R G I A Emissão Cada círculo pretende representar simbolicamente um eletrão n=3 n=2 n=1 Absorção

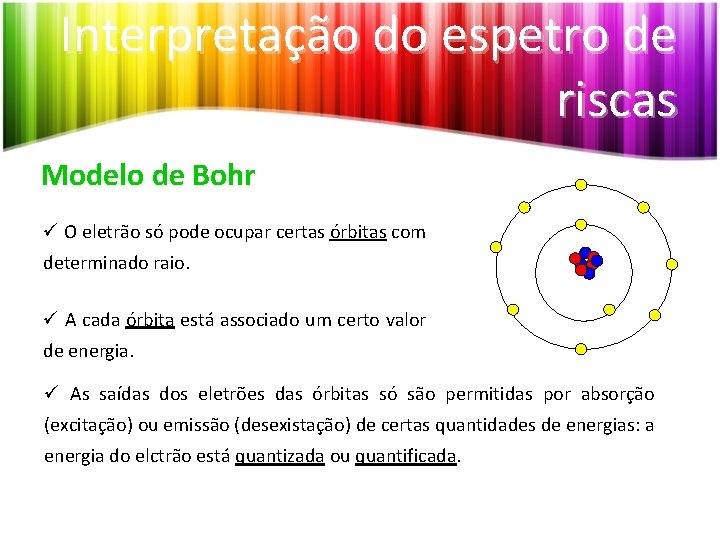
Interpretação do espetro de riscas Modelo de Bohr ü O eletrão só pode ocupar certas órbitas com determinado raio. ü A cada órbita está associado um certo valor de energia. ü As saídas dos eletrões das órbitas só são permitidas por absorção (excitação) ou emissão (desexistação) de certas quantidades de energias: a energia do elctrão está quantizada ou quantificada.

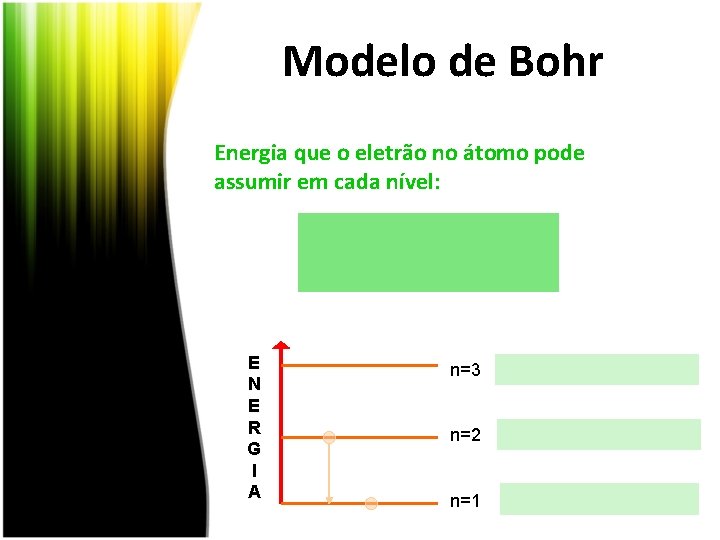
Modelo de Bohr Energia que o eletrão no átomo pode assumir em cada nível: E N E R G I A n=3 n=2 n=1

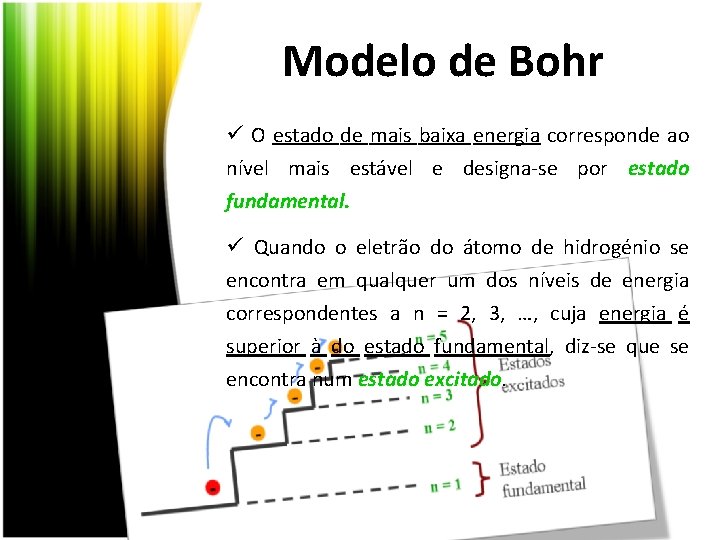
Modelo de Bohr ü O estado de mais baixa energia corresponde ao nível mais estável e designa-se por estado fundamental ü Quando o eletrão do átomo de hidrogénio se encontra em qualquer um dos níveis de energia correspondentes a n = 2, 3, …, cuja energia é superior à do estado fundamental, diz-se que se encontra num estado excitado.

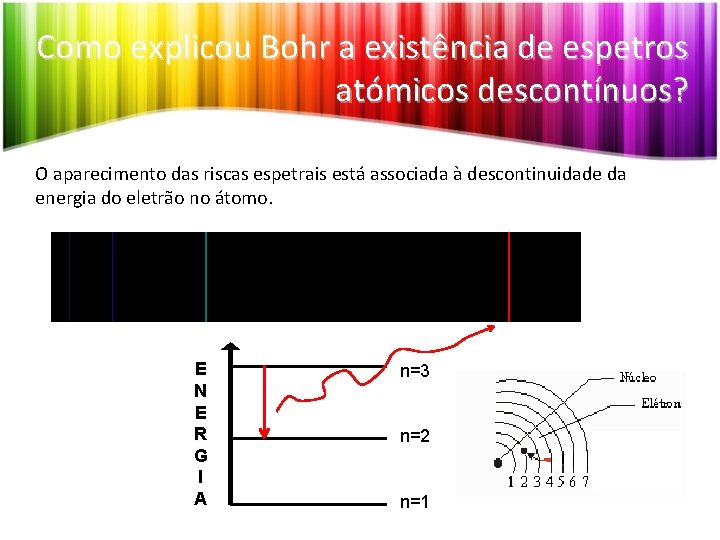
Como explicou Bohr a existência de espetros atómicos descontínuos? O aparecimento das riscas espetrais está associada à descontinuidade da energia do eletrão no átomo. E N E R G I A n=3 n=2 n=1

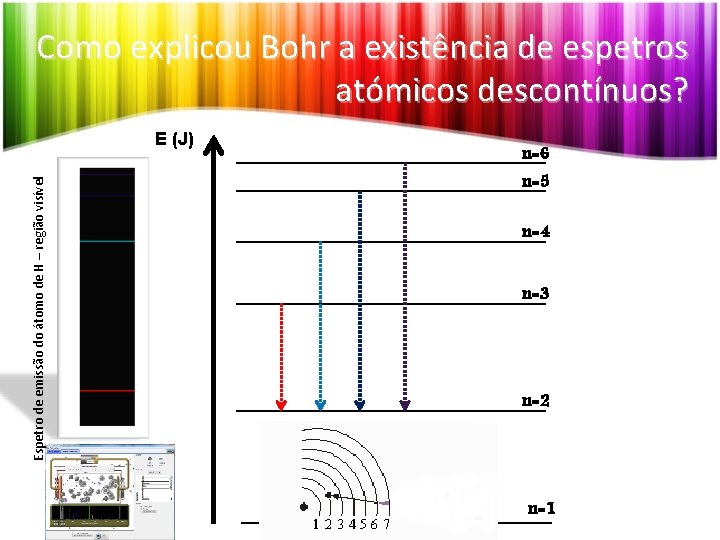
Como explicou Bohr a existência de espetros atómicos descontínuos? Espetro de emissão do átomo de H – região visível E (J) n=6 n=5 n=4 n=3 n=2 n=1

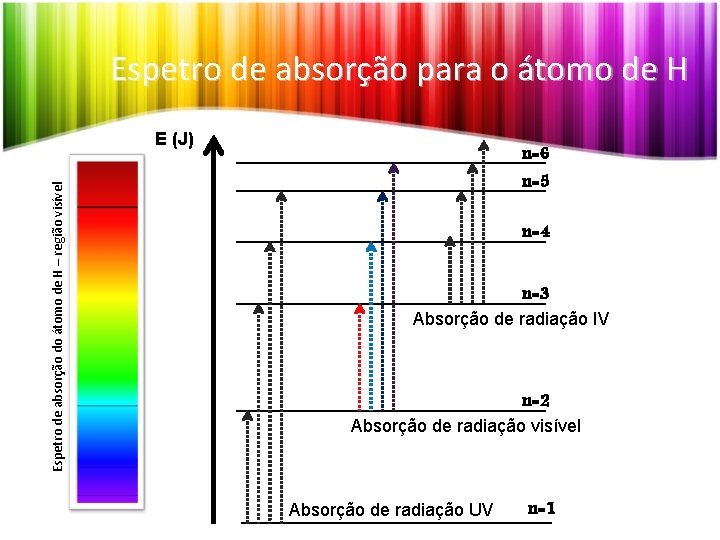
Espetro de absorção para o átomo de H Espetro de absorção do átomo de H – região visível E (J) n=6 n=5 n=4 n=3 Absorção de radiação IV n=2 Absorção de radiação visível Absorção de radiação UV n=1

Como explicou Bohr a existência de espetros atómicos descontínuos? • A emissão de radiação pelo átomo excitado está energeticamente associada à “queda” do eletrão de um nível energético superior para um nível energético inferior. • O valor da energia libertada é igual à diferença de energia entre os dois níveis de transição, o que explica o aparecimento de riscas no espectro. E N E R G I A n=3 n=2 n=1

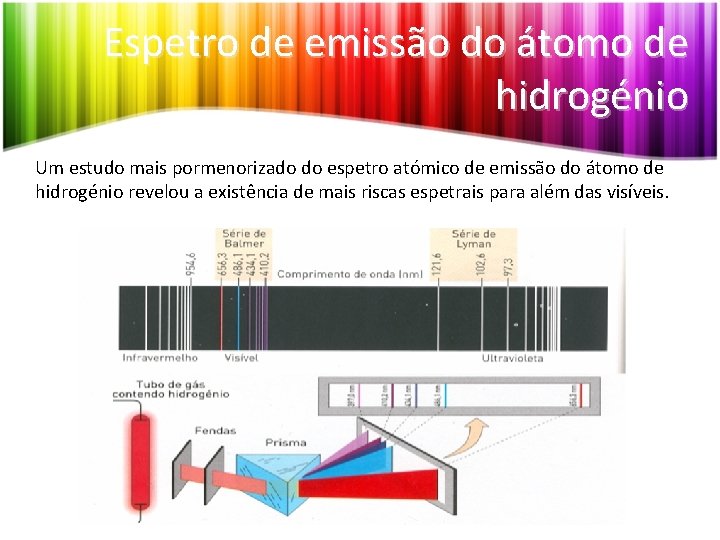
Espetro de emissão do átomo de hidrogénio Um estudo mais pormenorizado do espetro atómico de emissão do átomo de hidrogénio revelou a existência de mais riscas espetrais para além das visíveis.

Espetro de emissão do átomo de hidrogénio Séries Nível final Nível inicial Região do espectro Lyman 1 2, 3, 4, … Ultravioleta Balmer 2 3, 4, 5, … Visível Pachen 3 4, 5, 6, … Infravermelho Brackett 4 5, 6, 7, … Infravermelho
 Teorema de variatie a energiei mecanice
Teorema de variatie a energiei mecanice Bomba alternativa
Bomba alternativa Energia potenziale scuola primaria
Energia potenziale scuola primaria Unidade estilística
Unidade estilística Exercícios sobre unidades de medidas
Exercícios sobre unidades de medidas Citoplasma
Citoplasma Din newton
Din newton Primeira unidade de conservação do brasil
Primeira unidade de conservação do brasil Simbolo unidade de medida
Simbolo unidade de medida Refro
Refro Unidade de ensino superior dom bosco
Unidade de ensino superior dom bosco Constante de boltzmann unidade
Constante de boltzmann unidade Competição
Competição Tkm 50
Tkm 50 No presépio pequenino
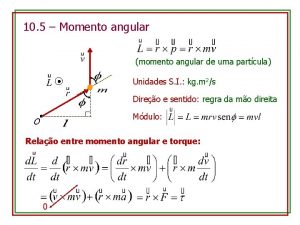
No presépio pequenino Momento angular unidade
Momento angular unidade Unidade central de processamento
Unidade central de processamento Unidade caloria
Unidade caloria Unidade de medida
Unidade de medida Unidade pastoral nova oeiras
Unidade pastoral nova oeiras Unidade de medida u
Unidade de medida u Unidade de ensino superior dom bosco
Unidade de ensino superior dom bosco Newton unidade
Newton unidade Principio de arquimedes
Principio de arquimedes Espetro fotoeletrónico
Espetro fotoeletrónico Energia online login
Energia online login Scelk
Scelk Sos energia elettrica
Sos energia elettrica Suma de energias
Suma de energias Teplo a využiteľná energia
Teplo a využiteľná energia Geotermalna energia
Geotermalna energia Energia térmica
Energia térmica