Diagnstico de virus Influenza y otros virus respiratorios
















- Slides: 25

Diagnóstico de virus Influenza y otros virus respiratorios Toma de muestra clínica, oportunidad, conservación y traslado. Métodos de laboratorio. Centro Nacional de Influenza Depto. de Laboratorios de Salud Publica

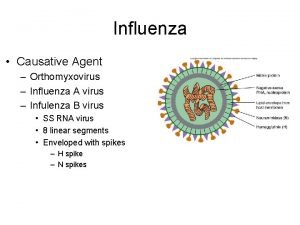
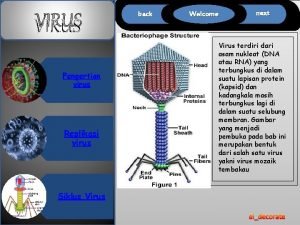
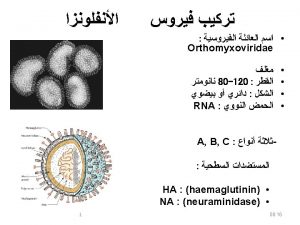
Aspectos de la biología del Virus Hay 3 tipos de virus Influenza: A, B y C. Influenza A, dividido en subtipos según la composición de 2 proteínas de la superficie del virus: Hemoaglutinina (H) 16 diferentes Neuraminidasa (N) 9 diferentes Contenido genético: ARN segmentado (8)

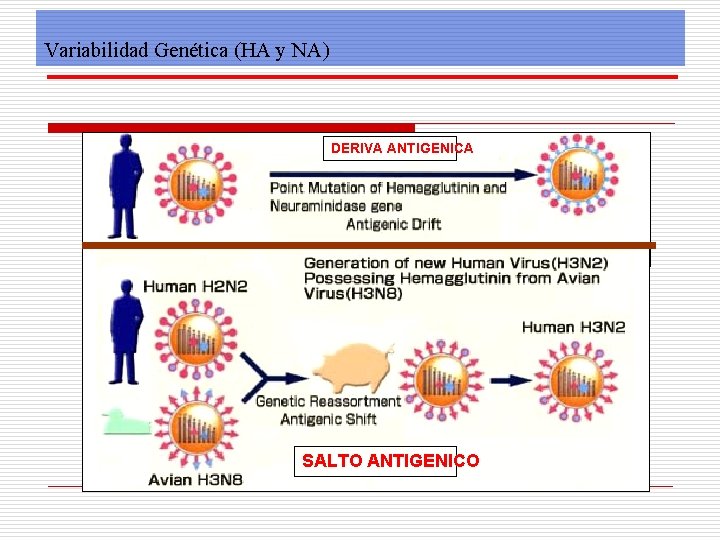
Variabilidad Genética (HA y NA) DERIVA ANTIGENICA SALTO ANTIGENICO

Condiciones para que una variante de influenza sea causa de una pandemia – AÑO 2009 – Influenza A/H 1 N 1 v Emerge un nuevo virus de influenza para el cual la población no tiene inmunidad El nuevo virus es capaz de replicarse en humanos y causar enfermedad El nuevo virus puede ser transmitido eficientemente de persona a persona

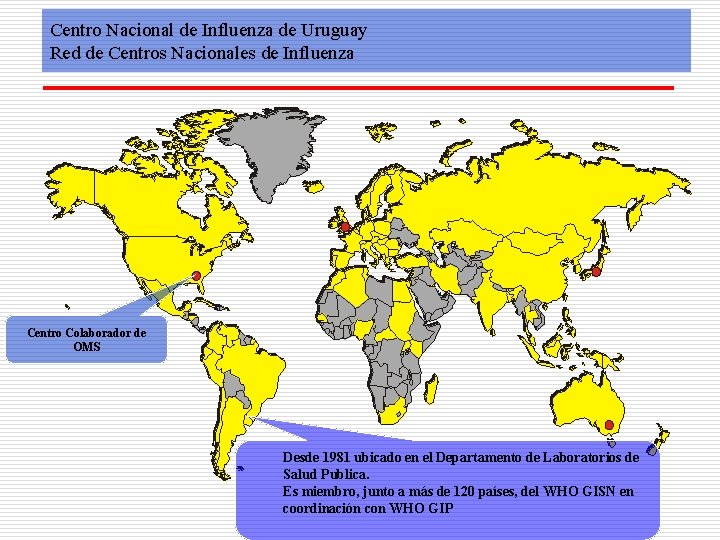
Centro Nacional de Influenza de Uruguay Red de Centros Nacionales de Influenza Centro Colaborador de OMS Desde 1981 ubicado en el Departamento de Laboratorios de Salud Publica. Es miembro, junto a más de 120 países, del WHO GISN en coordinación con WHO GIP

Roles del Centro Nacional de Influenza • Caracterización molecular (Tipificación y subtipificación) • Aislamiento viral y caracterización antigénica (subtipificación) • Conservación de muestras clínicas y cepas virales • Envío de cepas a los laboratorios colaboradores de OMS para caracterización final. • Contribución a la reformulación de vacunas antigripales • Selección de tipo de muestra clínica • Responsable de entrenamientos y asesoramientos • Coordinación con Unidad de Vigilancia en Salud Publica (UVISAP)

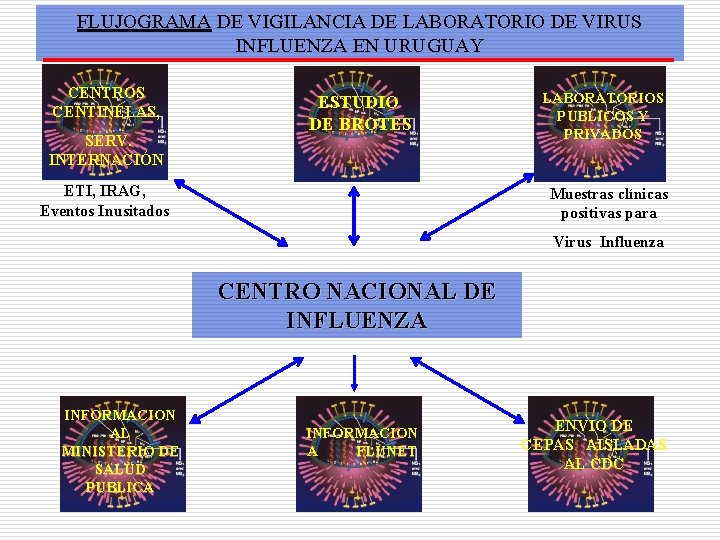
FLUJOGRAMA DE VIGILANCIA DE LABORATORIO DE VIRUS INFLUENZA EN URUGUAY CENTROS CENTINELAS, SERV. INTERNACIÓN ESTUDIO DE BROTES ETI, IRAG, Eventos Inusitados LABORATORIOS PUBLICOS Y PRIVADOS Muestras clínicas positivas para Virus Influenza CENTRO NACIONAL DE INFLUENZA INFORMACION AL MINISTERIO DE SALUD PUBLICA INFORMACION A FLUNET ENVIO DE CEPAS AISLADAS AL CDC

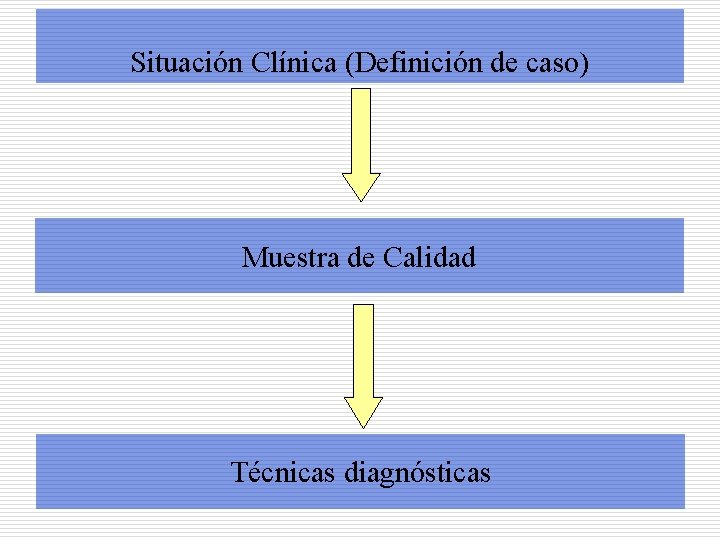
Situación Clínica (Definición de caso) Muestra de Calidad Técnicas diagnósticas

Muestra de Calidad • OPORTUNIDAD: ¿Cuándo tomar la muestra clínica? • Hasta 72 horas de iniciado los síntomas • TIPO: ¿Cuál muestra clínica? • Hisopado Nasal (paciente mayor de 5 años) • Aspirado Nasofaríngeo (paciente menor de 5 años) • TOMA DE MUESTRA: Conocimiento del procedimiento técnico • TRANSPORTE Y CONSERVACIÓN: Condiciones de conservación y transporte. El tiempo máximo de envío de las muestras al DLSP no puede superar a las 72 horas.

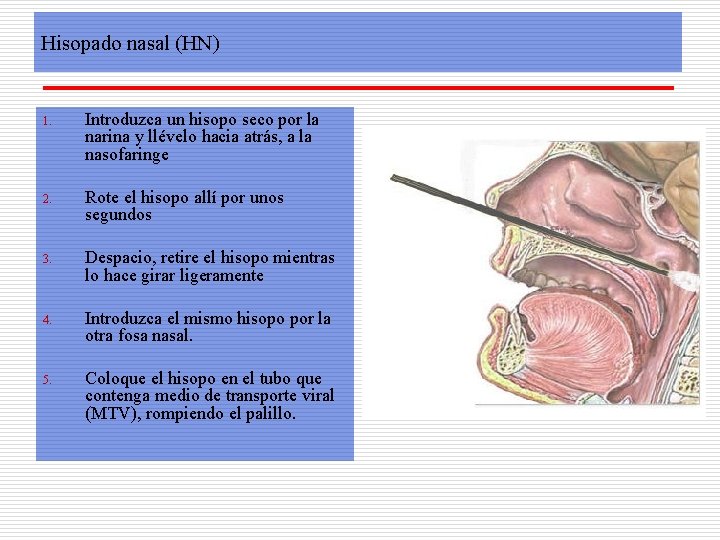
Hisopado nasal (HN) 1. Introduzca un hisopo seco por la narina y llévelo hacia atrás, a la nasofaringe 2. Rote el hisopo allí por unos segundos 3. Despacio, retire el hisopo mientras lo hace girar ligeramente 4. Introduzca el mismo hisopo por la otra fosa nasal. 5. Coloque el hisopo en el tubo que contenga medio de transporte viral (MTV), rompiendo el palillo.

HISOPADO NASAL Ø Ø Ø Hisopos con punta sintética (poliéster o dacron) y mango de plástico. No son aceptables hisopos con: punta de algodón, alginato de calcio, y mango de madera. No son aceptables: Hisopos bacteriológicos.

Aspirado nasofaríngeo (ANF) 1. 2. 3. 4. 5. 6. 7. 8. Una la trampa de moco con la fuente de vacío Introduzca la sonda a través de las narinas Aplique el vacío Retire despacio la sonda Repita el procedimiento con la otra fosa nasal, usando la misma sonda Después de tomar la muestra, aspire con la sonda el MTV (lavado de la sonda) Retire la tapa con la doble tubuladura y coloque tapón bien cerrado. Acondicione el tubo con las secreciones para el envío para el laboratorio.

54 67 1 2 3

ETAPA PRE-ANALITICA Verificar que: Ø Ø la muestra a obtener sea la adecuada y que este acompañada por ficha epidemiológica (nombre, procedencia, edad, fecha de toma, etc ). El envió hacia el laboratorio haya sido correcto : 4 °C, triple envoltura , y rapido.

MEDIO DE TRANSPORTE VIRAL Ø Ø Las muestras se colocan previo envió en Medio Transporte Viral. La finalidad es mantener viable el virus condición necesaria para su posterior caracterización. 1 -3 ml por muestras. Compuesto por proteínas estabilizadoras, ATB, antimicoticos y solución buffer.

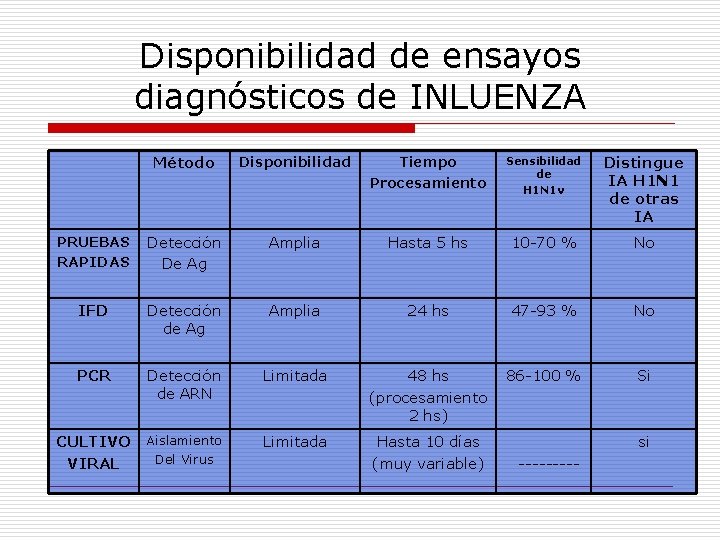
PRUEBAS DE DIAGNOSTICO PARA INFLUENZA Ø Pruebas Rápidas (inmunológicas). Ø Inmunoflurescencia Indirecta (IFI). Ø Amplificación de Ácidos Nucleicos (PCR). Ø Aislamiento (Cultivo celular).

Disponibilidad de ensayos diagnósticos de INLUENZA Método Disponibilidad Tiempo Procesamiento Sensibilidad de H 1 N 1 v Distingue IA H 1 N 1 de otras IA PRUEBAS RAPIDAS Detección De Ag Amplia Hasta 5 hs 10 -70 % No IFD Detección de Ag Amplia 24 hs 47 -93 % No PCR Detección de ARN Limitada 48 hs (procesamiento 2 hs) 86 -100 % Si CULTIVO VIRAL Aislamiento Del Virus Limitada Hasta 10 días (muy variable) si -----

INMUNOFLURESCENCIA INDIRECTA (IFI) Ø Detección de Antigenos usando: Ø Ø Anticuerpos monoclonales específicos y Anti anticuerpos conjugado a Isotiocianto de Fluoresceína. Ø Panel de Virus Respiratorios : IA, IB, Adenovirus, Virus Respiratorio Sicicial, Parainfluenza 1, 2 y 3. Ø Sensibilidad: 65 -93 %. Ø Alta especificidad : >96 %. Ø No discrimina diferentes subtipos de Inluenza A.

Amplificación de ARN por Reacción en Cadena de la Polimerasa (PCR) Ø Extracción de ARN Ø Ø Muestra + Buffer de Lisis

Donde y como se prepara la PCR Ø Zona Mix o Pre-PCR. Ø Condiciones de frío. Ø Ø Vestimenta y materiales solo de esta zona. No circulación de personal. Preparación de mezcla de reactivos (MIX). Pipeteo de Mix en eppendorf PCR convencional o en capilares si es PCR en tiempo real.

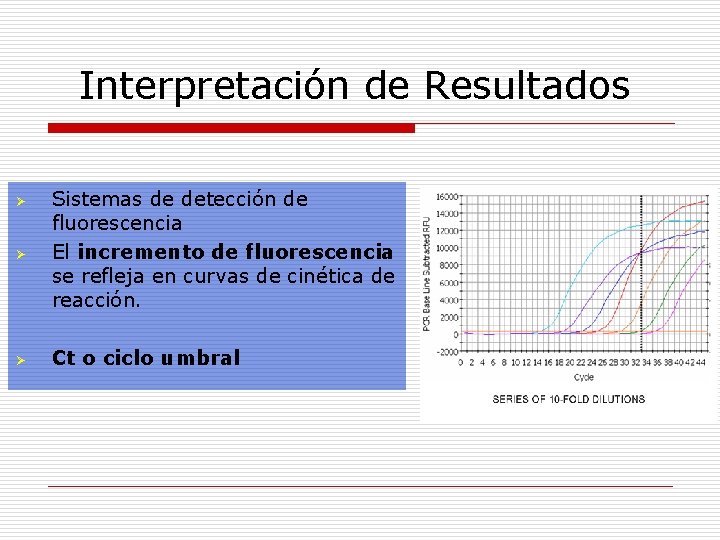
Amplificación propiamente dicha PCR-Tiempo Real Ø Ø Ø Los procesos de amplificación y detección son simultáneos. Equipos compuestos por : termociclador + lector de flurescencia acoplado a un sistema informático. La fluorescencia de cada reacción es proporcional al ADN formado.

Interpretación de Resultados Ø Sistemas de detección de fluorescencia El incremento de fluorescencia se refleja en curvas de cinética de reacción. Ø Ct o ciclo umbral Ø

Aislamiento Viral Cultivo en Biosustrato Ø Envió a CDC para caracterización final Colaboración en la reformulación de vacuna antigripal. Ø Sensibilidad alta. Ø Especificidad alta. Ø Aumenta a gran escala el virus. Ø

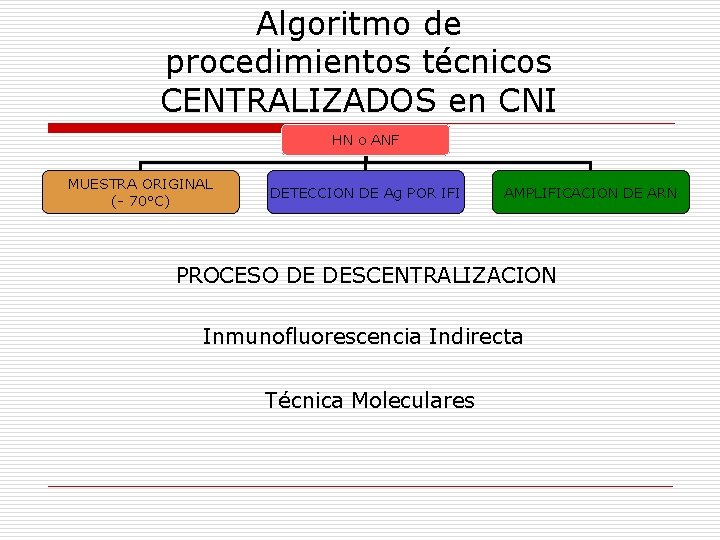
Algoritmo de procedimientos técnicos CENTRALIZADOS en CNI HN o ANF MUESTRA ORIGINAL (- 70°C) DETECCION DE Ag POR IFI AMPLIFICACION DE ARN PROCESO DE DESCENTRALIZACION Inmunofluorescencia Indirecta Técnica Moleculares

EQUIPO TECNICO Y HUMANO Ms. C. Natalia Goñi Lic. Leticia Coppola Lic. Viviana Ramas Lic. Dora Ruchansky Lic. Mariana López Lic. Noelia Morel Lic. Rosa Flieler Lic. Analía Burgueño Aux. Rommy Pilati Aux. Roque Cámera Tec. Silvana Somma Dra. Adriana Varela Dra. Elena Cánepa QF. Maria T Perez Dra. Silvana Brasso Dr. Héctor Chiparelli Centro Nacional de Referencia de Influenza Unidad de Virología – DLSP Avda. Alfredo Navarro 3051 (Acceso Norte) Tel. : 487 25 16/26 16 Fax. : 480 70 14 E-mail: virologiamsp@adinet. com. uy, hchiparelli@msp. gub. uy,
 Virus respiratorios
Virus respiratorios Rimantidina
Rimantidina Influenza virus replication
Influenza virus replication El aparato respiratorio
El aparato respiratorio Signos y sintomas
Signos y sintomas Estado de gasping
Estado de gasping Quais são os movimentos responsáveis pela respiração
Quais são os movimentos responsáveis pela respiração Musculos respiratorios
Musculos respiratorios Onde fica o pulmão
Onde fica o pulmão Vertical
Vertical Is influenza a airborne disease
Is influenza a airborne disease Olfactory mucosa
Olfactory mucosa Raggio di influenza materozza
Raggio di influenza materozza Influenza vaccine dosage chart 2019-2020
Influenza vaccine dosage chart 2019-2020 Influenza
Influenza Causative organism
Causative organism Influenza ww1
Influenza ww1 The great influenza rhetorical analysis
The great influenza rhetorical analysis Stomach flu vs influenza
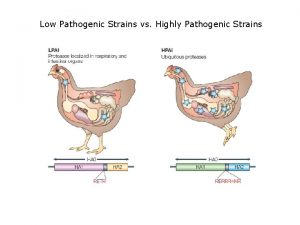
Stomach flu vs influenza Low pathogenic avian influenza
Low pathogenic avian influenza Razón circulante ejemplo
Razón circulante ejemplo Ingresos cobrados por anticipado
Ingresos cobrados por anticipado Farmatic madrid
Farmatic madrid Características de la profesora thompson
Características de la profesora thompson Pronombre personal clasificacion
Pronombre personal clasificacion Otros servicios habarcelo.es
Otros servicios habarcelo.es