Definiie clasificare OXIZII sunt compui ai nemetalelor i








- Slides: 10


Definiție, clasificare OXIZII sunt compuși ai nemetalelor și metalelor cu oxigenul Oxizii se clasifică în: Oxizi acizi (nemetalici) – conțin atomi ai unor nemetale și oxigen, de exemplu, oxizi ai carbonului (CO; CO 2), siliciului (Si. O 2), oxizi ai azotului(N 2 O, N 2 O 3, NO 2, N 2 O 5), ai sulfului (SO 2) etc. Oxizi bazici (metalici) – conțin atomi ai unor metale și oxigen, de exemplu: oxizi ai metalelor alcaline (Na 2 O, K 2 O), oxizi ai metalelor alcalino-pământoase (Ca. O, Mg. O, Ba. O), oxizi ai metalelor din blocul p (Al 2 O 3, Pb. O 2), oxizi ai metalelor tranziționale (Fe 2 O 3, Fe. O, Cu 2 O, Cu. O, Mn. O 2 ) etc.

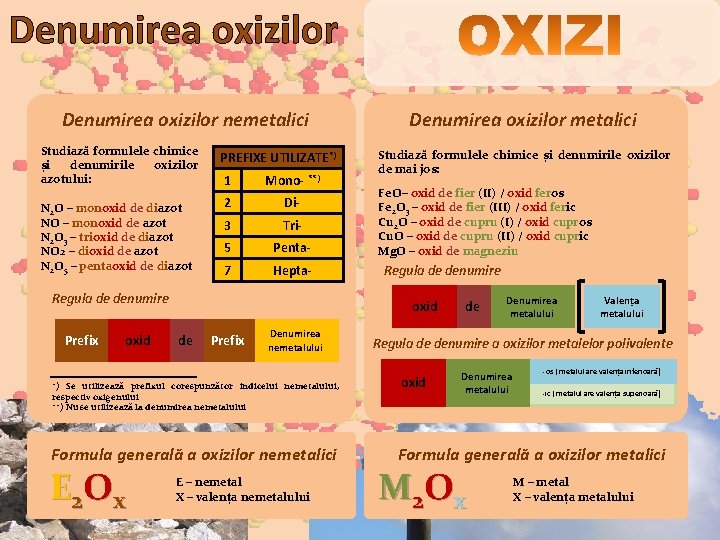
Denumirea oxizilor nemetalici Studiază formulele chimice și denumirile oxizilor azotului: N 2 O – monoxid de diazot NO – monoxid de azot N 2 O 3 – trioxid de diazot NO 2 – dioxid de azot N 2 O 5 – pentaoxid de diazot PREFIXE UTILIZATE*) 1 Mono- **) 2 Di- 3 Tri- 5 Penta- 7 Hepta- Regula de denumire Prefix oxid Studiază formulele chimice și denumirile oxizilor de mai jos: Fe. O– oxid de fier (II) / oxid feros Fe 2 O 3 – oxid de fier (III) / oxid feric Cu 2 O – oxid de cupru (I) / oxid cupros Cu. O – oxid de cupru (II) / oxid cupric Mg. O – oxid de magneziu Regula de denumire oxid de Prefix Denumirea nemetalului *) Se utilizează prefixul corespunzător indicelui nemetalului, respectiv oxigenului **) Nu se utilizează la denumirea nemetalului Formula generală a oxizilor nemetalici E 2 O x Denumirea oxizilor metalici E – nemetal X – valența nemetalului de Denumirea metalului Valența metalului Regula de denumire a oxizilor metalelor polivalente oxid Denumirea metalului -os ( metalul are valența inferioară) -ic ( metalul are valența superioară) Formula generală a oxizilor metalici M 2 O x M – metal X – valența metalului

Metode de obținere Obținerea din reacții de combinare Încălzeşte cu ajutorul unui cleşte un fir de cupru. Ce observi după un anumit timp? Cuprul se acoperă de un strat de culoare neagră. Cuprul a reacţionat cu oxigenul din aer, formând oxidul de cupru (Cu. O). 2 Cu + O 2 → 2 Cu. O Aprinde o panglică de magneziu, ținută cu un clește metalic la flacăra unei spirtiere. Ce se observă? ATENȚIE! Nu privi flacăra insistent! Magneziul arde cu flacără albă, orbitoare. Se formează oxidul de magneziu (Mg. O), de culoare albă. 2 Mg + O 2 → 2 Mg. O Marea majoritate a metalelor și nemetalelor se combină direct cu oxigenul, formând oxizi. Obținerea din reacții de descompunere Introdu într-o eprubetă o spatulă de carbonat de cupru, substanţă solidă de culoare verde. Încălzeşte cu atenţie eprubeta. Ce se observă? Adu apoi la gura eprubetei o aşchie de brad cu punct incandescent. De ce s-a stins? După puţin timp, apare o substanţă nouă de culoare neagră – oxidul de cupru (Cu. O). Aşchia de brad se stinge la gura eprubetei datorită celuilalt produs rezultat – dioxidul de carbon (CO 2) – gaz care nu întreţine arderea. Cu. CO 3→Cu. O + CO 2↑ În zona munților Apuseni, lunii locuitori culeg piatra de var (Ca. CO 3) și o ard în cuptoare special construite de ei, obținând astfel var nestins (Ca. O). Scrie ecuația reacției ce are loc. Dă click apoi pe buton pentru confruntarea răspunsului. Ca. CO 3→Ca. O + CO 2↑

Proprietăți fizice Starea de agregare La temperaturi obișnuite, majoritatea oxizilor sunt: • gazoși (CO 2, SO 2, NO 2) • Solizi (Ca. O, P 2 O 5, Si. O 2) Culoarea • Incolori (CO 2, Si. O 2); • Colorați (Ca. O – alb, Cu. O – negru, Hg. O – roșu, Cr 2 O 3 – verde, Pb 3 O 4 – portocaliu, Pb. O – galben ș. a. ) Un oxid special – cuarțul • unele varietăți sunt transparente, refractă lumina; • luciu sticlos pe fețele prismei, gras pe suprafața de spărtură; • duritate mare (7 pe scara Mohs) • punct de topire ridicat (1713 o. C) • prezintă proprietăți piezoelectrice. P 2 O 5

Proprietăți chimice Reacția oxizilor acizi cu apa Într-o capsulă de porțelan introdu o cantitate mică de sulf. Aprinde sulful și apropie o hârtie albastră de turnesol umezită. Ce observi? Prin arderea sulfului se degajă dioxid de sulf, SO 2. Acesta reacționează cu apa impregnată în hârtia de turnesol, formând acid sulfuros H 2 SO 3, lucru pus în evidență de modificarea culorii hârtiei în roșu. S + O 2 →SO 2 + H 2 O →H 2 SO 3 Reacția oxizilor bazici cu apa Aprinde o panglică de magneziu, ținută cu un clește metalic la flacăra unei spirtiere. Introdu apoi oxidul de magneziu rezultat într-un pahar cu apă și adaugă 3 – 4 picături de fenolftaleină. Ce observi? Oxidul de magneziu reacționează parțial cu apa, formându-se hidroxidul de magneziu, Mg(OH)2, fapt pus în evidență de colorarea fenolftaleinei în roșu 2 Mg. O + H 2 O → Mg(OH)2 Reacția oxizilor acizi cu bazele Introdu o soluție limpede de apă de var diluată, și adaugă apoi 3 – 4 picături de fenolftaleină. Apoi, suflă cu ajutorul unui pai în soluția obținută. Ce observi după un timp? Soluția de culoare roșie se decolorează, semn că hidroxidul de calciu a reacționat cu dioxidul de carbon din aerul expirat. Se obține carbonat de calciu, care se lasă la fundul paharului și apă. CO 2 + Ca(OH)2→Ca. CO 3↓ + H 2 O Reacția oxizilor bazici cu acizii Într-o eprubetă, introdu un vârf de spatulă de oxid de cupru, și toarnă apoi soluție de acid clorhidric? Ce remarci? La sfârșitul reacției se observă culoarea verde a soluției, datorită clorurii de cupru formate, Cu. Cl 2. Cu. O + 2 HCl → Cu. Cl 2 + H 2 O Ploile acide rezultă în urma reacțiilor poluanților atmosferici (oxizi de C, N, S) cu apa de ploaie. Efectul acestora poate fi devastator pentru ecosisteme!

Utilizări Zăpadă carbonică Catalizatori Pigmenți Utilizări generale Materii prime pentru substanțe Abrazive pe bază de Al 2 O 3 Pietre semiprețioase Stingătoare Tratarea unor boli (mofete) Substanță criogenă CO 2 Sifoane Băuturi carbogazoase Decoloranți Sticlă de cuarț Metalurgie Văruire pomi SO 2 Dezinfectanți Refractometre Materiale construcții Si. O 2 Ceasuri electronice Ind. Sticlei Rafinarea petrolului Compuși ai Si Acid sulfuric Rafinarea zahărului Ca. O Agricultură Materiale construcții

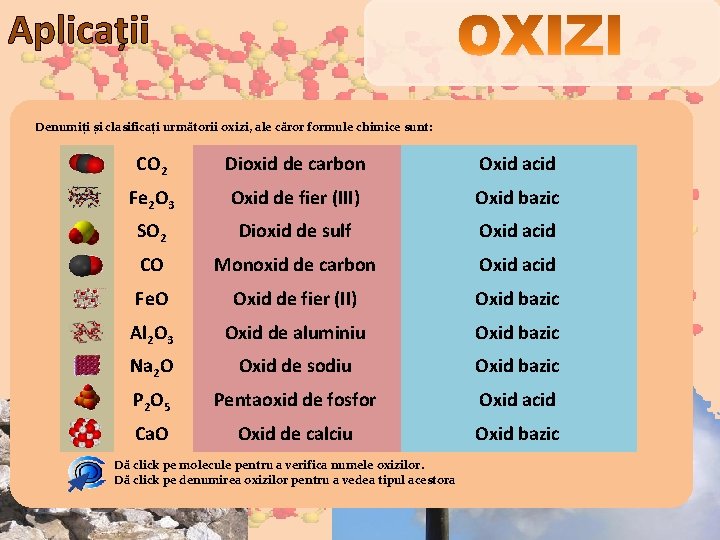
Aplicații Denumiți și clasificați următorii oxizi, ale căror formule chimice sunt: CO 2 Dioxid de carbon Oxid acid Fe 2 O 3 Oxid de fier (III) Oxid bazic SO 2 Dioxid de sulf Oxid acid CO Monoxid de carbon Oxid acid Fe. O Oxid de fier (II) Oxid bazic Al 2 O 3 Oxid de aluminiu Oxid bazic Na 2 O Oxid de sodiu Oxid bazic P 2 O 5 Pentaoxid de fosfor Oxid acid Ca. O Oxid de calciu Oxid bazic Dă click pe molecule pentru a verifica numele oxizilor. Dă click pe denumirea oxizilor pentru a vedea tipul acestora

Aplicații Răspunde în ordine întrebărilor de mai jos și află denumirile uzuale oxizilor din imagini! Pentru a vedea întrebările, apăsați pe numerele de mai jos. ATENȚIE! Aplicația nu funcționează corect dacă nu se răspunde în ordine la întrebări! 1 5 2 6 3 7 H 2 O 2 (30%) Perhidrol CO 2 solid Zăpadă carbonică Fe 2 O 3 Hematit Al 2 O 3 Corindon Mn. O 2 Piroluzit Si. O 2 Nisip, Cuarț Pb. O Litargă 4 8 Întrebarea 8 5 76 Întrebarea 4 1. 32. La descompunerea oxidului de mercur, Compusul Cantitatea La reacția Cu. O rezultat necesară cu Haîn SO urma Ca(OH) reacției finală dintre va 2 de 4, soluția 2 necesară starea agregare metalului rezultat Formula Dioxidul Nu La descompunerea estede oxid generală de azot, metalic: NO a. Cu. CO oxizilor prezintă se metalici obțin: culoarea: este: 3 SO reacției avea culoarea: apă, cu colorează 0, 3 moli CO 2 hârtia 2 și 2 este: de turnesol în: este: a)a)Dioxid Cu brun și a) CORECT! GREȘIT! a) a) a)roșu a)E lichidă verde 44, 4 g O 2 x deroșcat CO siliciu 2 Ca. O Var nestins b) Dioxid Cu. O și b) b)albastru b) CORECT! b) CORECT GREȘIT! b)albastră incolor solidă M 22, 2 g 2 O x de CO plumb 2

BIBLIOGRAFIE: 1. Constantinescu, R. , Râpă, M. ”Chimie – manual pentru clasa a VIII-a”, Editura Sigma, București, 2000 2. Gheorghiu, C. , Panait, C. , ”Chimie – manual pentru clasa a VIII-a”, Editura Didactică și Pedagogică, București, 1995 3. Fătu, S. Stroe, F. , Stroe, C. ”Chimie – manual pentru clasa a VIII-a”, Editura Corint, București 4. Oxizi – Prezentare Powerpoint realizată de eleva Bianca Pantia, Școala Generală Măgureni, jud. Prahova ( site: www. 78 chimie. wikispaces. com) La realizarea materialului s-au folosit imagini de pe site-urile: www. sciencephoto. com, www. wikipedia. org, www. research. ibm. com, www. clubafaceri. ro, www. cesel. ro, www. romchim. ro, www. mengenchem. com, www. theodoregray. com, www. agrofm. ro, www. ecomagazin. ro, www. ildoro. ro, www. cosafety. com, www. twitter. com, www. telegraph. co. uk, www. geo. mtu. edu, www. elogiodelabelleza. it, www. resources. journ. ac. uk, www. adevarul. ro, www. kbf. ee, www. hkasme. org, www. ltp. learnetic. com, www. visualphotos. com, www. woelen. nl, www. margelesibijuterii. ro, www. cadasegsa. com. tr. Realizat de prof. Florin Viu Școala Gimnazială ”Ion Lovinescu” Rădășeni Noiembrie 2012
 Oxizi denumire
Oxizi denumire Care sunt simturile prin care sunt evocate
Care sunt simturile prin care sunt evocate Cand sunt mic atunci sunt mare
Cand sunt mic atunci sunt mare Antiaritmice clasificare
Antiaritmice clasificare Clasificare studii superioare isced
Clasificare studii superioare isced Detergenti clasificare
Detergenti clasificare Clasificarea statelor dupa nr de locuitori
Clasificarea statelor dupa nr de locuitori Clasificarea tesutului epitelial
Clasificarea tesutului epitelial Ochi negri vazuti la microscop
Ochi negri vazuti la microscop Dioda cu contact punctiform
Dioda cu contact punctiform Imc clasificare
Imc clasificare


















