ACIZI ACIZI Definiie Clasificare Denumire ACIZII sunt compui








- Slides: 11

ACIZI

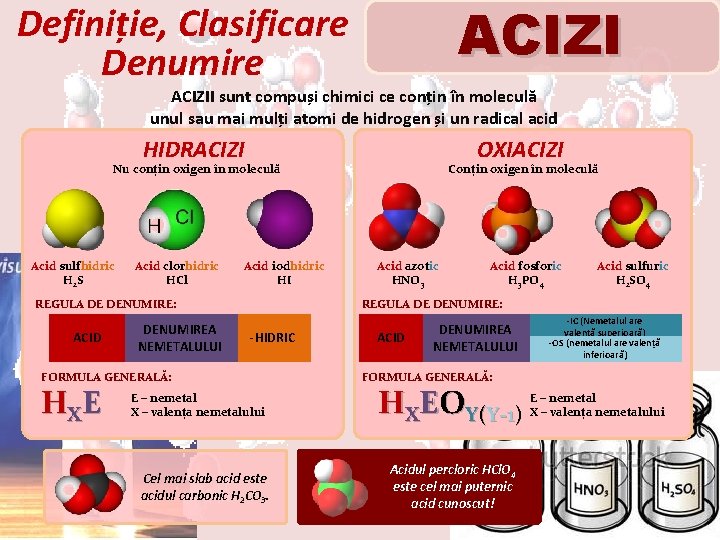
ACIZI Definiție, Clasificare Denumire ACIZII sunt compuși chimici ce conțin în moleculă unul sau mai mulți atomi de hidrogen și un radical acid HIDRACIZI OXIACIZI Nu conțin oxigen în moleculă Acid sulfhidric H 2 S Acid clorhidric HCl Acid iodhidric HI REGULA DE DENUMIRE: ACID DENUMIREA NEMETALULUI Acid azotic HNO 3 Acid fosforic H 3 PO 4 Acid sulfuric H 2 SO 4 REGULA DE DENUMIRE: -HIDRIC FORMULA GENERALĂ: H XE Conțin oxigen în moleculă E – nemetal X – valența nemetalului Cel mai slab acid este acidul carbonic H 2 CO 3. ACID DENUMIREA NEMETALULUI -IC (Nemetalul are valență superioară) -OS (nemetalul are valență inferioară) FORMULA GENERALĂ: HXEOY(Y-1) Acidul percloric HCl. O 4 este cel mai puternic acid cunoscut! E – nemetal X – valența nemetalului

Stare naturală Acidul clorhidric (HCl): • liber: foarte puțin în emanațiile vulcanice și în sucul gastric; • compuși: săruri, numite cloruri: Na. Cl, KCl, Mg. Cl 2 etc. Acidul sulfuric (H 2 SO 4): • liber: foarte puțin, în glandele unor moluște; • compuși: săruri numite sulfați: Ca. SO 4, Mg. SO 4, Cu. SO 4 etc. Acidul nitric (HNO 3): • liber: foarte puțin, în atmosferă și în apa de ploaie; • compuși: săruri numite nitrați: KNO 3, Na. NO 3, NH 4 NO 3 etc. Acidul carbonic (H 2 CO 3): • se găsește în apele minerale carbogazoase și în sărurile acestuia, carbonații (Na 2 CO 3, Ca. CO 3, Cu. CO 3 etc. ) România este țara cu cele mai mari resurse de ape minerale carbogazoase din Europa. ACIZI

ACIZI Obținerea industrială a HCl Acidul clorhidric se obține prin sinteză din elementele componente, prin arderea hidrogenului în atmosferă de clor. Obținerea industrială a H 2 SO 4 Pentru obținerea H 2 SO 4 se utilizează procedeul prin contact. Procesul are loc în trei etape: 1. Obținerea dioxidului de sulf prin prăjirea piritei: H 2 + Cl 2 → 2 HCl(g)↑ Obținerea în laborator a HCl Într-un balon se introduce clorură de sodiu (Na. Cl). Se astupă balonul cu un dop prevăzut cu două orificii, în care se montează o pâlnie de separare și un tub de culegere. Prin pâlnie se toarnă soluție de H 2 SO 4, se încălzeşte cu grijă balonul, pe o sită şi se culege produsul de reacţie gazos rezultat într-un cilindru, astupat cu un dop de vată. Ce observi? 4 Fe. S 2 + 11 O 2 → 2 Fe 2 O 3 + 8 SO 2↑ 2. Oxidarea dioxidului de sulf la trioxid de sulf: 2 SO 2 + O 2 → 2 SO 3↑ 3. Absorbția trioxidului de sulf în apă: SO 3 + H 2 O → H 2 SO 4 Acidul sulfuric pune în libertate acidul clorhidric (HCl) din sarea sa, Na. Cl. Prezența acidului clorhidric se pune în evidență cu ajutorul unei hârtii albastre de turnesol, care se înroșește când este adusă la gura cilindrului 2 Na. Cl(s) + H 2 SO 4 → Na 2 SO 4 + 2 HCl(g)↑ Experimentul se va realiza sub nișă sau în spațiu bine aerisit!

Proprietăți fizice • Acizii pot fi substanțe gazoase (HCl, H 2 S), lichide (HNO 3, H 2 SO 4) sau solide (H 3 PO 4) • Toți acizii sunt solubili în apă; • Soluțiile acizilor prezintă gust acru; • Soluțiile acizilor sunt bune conducătoare de electricitate (se mai numesc și electroliți) ACIZI Proprietăți fizice ale HCl • gaz incolor, miros caracteristic înțepător; • densitate mai mare decât apa; • foarte solubil în apă (soluțiile de acid clorhidric fumegă în aer). Proprietăți fizice ale H 2 SO 4 • lichid uleios, incolor, inodor; • densitate mai mare decât apa; • solubil în apă; la dizolvare se degajă căldură; • foarte avid de apă; La prepararea soluțiilor de acid sulfuric nu se toarnă niciodată apă în acid! Se va turna prin prelingere acidul în apă. Proprietăți fizice ale HNO 3 • lichid, incolor, miros înțepător; • densitate mai mare decât apa; • solubil în apă. Acizii tari sunt substanțe corozive. Ei provoacă puternice leziuni ale pielii și țesuturilor!

ACIZI Proprietăți chimice Turnați soluții de HCl și H 2 SO 4 în două eprubete. Adăugați în fiecare eprubetă 2 – 3 picături de soluție de turnesol. Ce observați? Repetați apoi experimentul, utilizând soluții de fenolftaleină și metiloranj. Acizii înroșesc turnesolul și metiloranjul și lasă incoloră fenolftaleina. Reacția HCl cu metalele Pune într-o eprubetă pulbere de zinc, într-o alta pulbere de aluminiu şi într-o a treia pulbere de cupru. Toarnă apoi, cu atenţie, o soluţie de acid clorhidric (HCl). Ce observi, dacă apropii un băţ de chibrit deasupra fiecărei eprubete? Zincul şi aluminiul reacționează cu acidul clorhidric rezultând hidrogen. Acesta se aprinde când se apropie chibritul de gura eprubetelor În a treia eprubetă nu are loc o reacție, deoarece, cuprul nu poate înlocui hidrogenul din acizi. Zn + 2 HCl → Zn. Cl 2 + H 2↑ 2 Al + 6 HCl → 2 Al. Cl 3 + 3 H 2↑ Cu + HCl → nu reacționează TURNESOL FENOLFTALEINĂ în mediu acid METILORANJ Reacția H 2 SO 4 cu metalele În cinci eprubete pune în ordine: aluminiu(eprubeta 1), pilitură de fier (2 și 3) și cupru (4 și 5). Adaugă apoi acid sulfuric diluat în eprubetele 1, 2 și 4. Ce observi? Adaugă apoi acid sulfuric concentrat în eprubetele 3 și 5. Notează-ți observațiile. Încălzește apoi eprubetele. Are loc vreo reacție? Acidul sulfuric diluat la rece atacă doar aluminiul și fierul. , cu degajare de hidrogen. Acidul sulfuric concentrat nu atacă fierul și cuprul la rece. La cald, acidul sulfuric reacționează cu cuprul, fără degajare de hidrogen. 2 Al + 3 H 2 SO 4(dil, conc) → Al 2(SO 4)3 + 3 H 2↑ Fe + H 2 SO 4(dil, rece) → Fe. SO 4 + H 2↑ Cu + 2 H 2 SO 4(conc, t) → Cu. SO 4 + SO 2 +2 H 2 O

Proprietăți chimice Reacția cu oxizii bazici În două eprubete, pune câte o spatulă de carbonat de cupru (Cu. CO 3). Toarnă apoi soluție de acid clorhidric în prima eprubetă și soluție de acid sulfuric în cea de-a doua. Ce observi? În prima eprubetă rezultă o soluție de culoare verde, datorită clorurii cuprice (Cu. Cl 2) iar în cea de-a doua o soluție de culoare albastră, datorită sulfatului de cupru (Cu. SO 4). Cu. O + 2 HCl → Cu. Cl 2 + H 2 O Cu. O + H 2 SO 4 → Cu. SO 4 + H 2 O Reacția cu bazele (neutralizarea) În două eprubete, pune soluție de hidroxid de sodiu(Na. OH) și câte o picătură de fenolftaleină. Adăugați apoi picătură cu picătură și sub agitare, soluție de acid clorhidric respectiv acid sulfuric. Ce observi? La adăugarea fenolftaleinei peste Na. OH, soluția se înroșește, . La adăugarea acizilor în picături, soluția se decolorează. Se formează clorura de sodiu, respectiv sulfatul de sodiu și apă. Na. OH + HCl → Na. Cl + H 2 O Na. OH + H 2 SO 4 → Na 2 SO 4 + H 2 O ACIZI Identificarea acidului clorhidric Tratează într-o eprubetă o soluție de acid clorhidric cu nitrat de argint(Ag. NO 3). Atenție la manevrarea nitratului de argint. Se formează un precipitat alb-brânzos, fotosensibil de clorură de argint. Ag. NO 3 + HCl → Ag. Cl↓ + HNO 3 Identificarea acidului sulfuric Tratează într-o eprubetă o soluție de acid sulfuric cu o soluție de clorură de bariu (Ba. Cl 2) Se formează un precipitat alb, sulfatul de bariu. Ba. Cl 2 + H 2 SO 4 → Ba. SO 4↓ + 2 HCl Reacția acizilor cu carbonații Într-o eprubetă ce conține carbonat de sodiu (Na 2 CO 3), turnați o soluție de HCl. Ce observați? Încercați natura gazului degajat cu un chibrit aprins. Are loc o reacție cu efervescență. Dioxidul de carbon format stinge flacăra chibritului. Na 2 CO 3 + 2 HCl → 2 Na. Cl + CO 2↑ + H 2 O

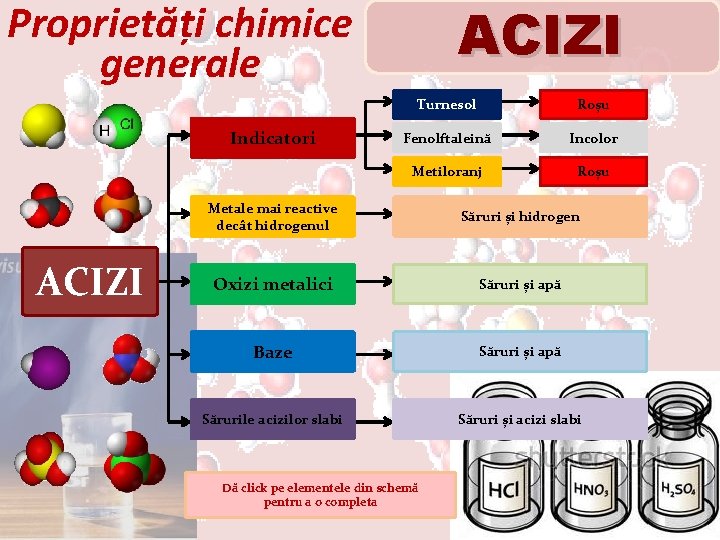
ACIZI Proprietăți chimice generale Indicatori ACIZI Turnesol Roșu Fenolftaleină Incolor Metiloranj Roșu Metale mai reactive decât hidrogenul Săruri și hidrogen Oxizi metalici Săruri și apă Baze Săruri și apă Sărurile acizilor slabi Săruri și acizi slabi Dă click pe elementele din schemă pentru a o completa

ACIZI Utilizări Medicamente Solvenți Coloranți HCl Detergenți Acumulatori Gelatina Mase plastice H 2 SO 4 Oxidant Decapanți Obținerea clorului H 2 CO 3 Mase plastice HNO 3 Băuturi carbogazoase H 3 PO 4 Îngrășăminte Detergenți Îngrășăminte Explozibili Îngrășăminte Decapanți Reactiv în laborator Lacuri și vopsele Reactiv în laborator

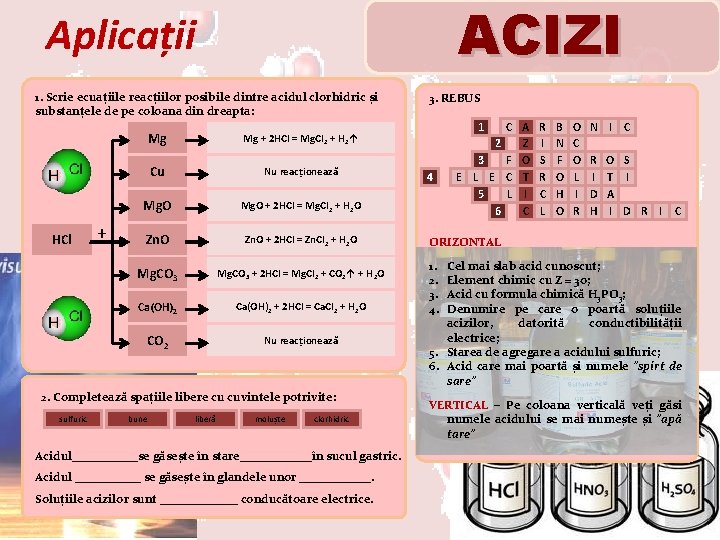
ACIZI Aplicații 1. Scrie ecuațiile reacțiilor posibile dintre acidul clorhidric și substanțele de pe coloana din dreapta: HCl + Mg Mg + 2 HCl = Mg. Cl 2 + H 2↑ Cu Nu reacționează Mg. O + 2 HCl = Mg. Cl 2 + H 2 O Zn. O + 2 HCl = Zn. Cl 2 + H 2 O Mg. CO 3 + 2 HCl = Mg. Cl 2 + CO 2↑ + H 2 O Ca(OH)2 + 2 HCl = Ca. Cl 2 + H 2 O CO 2 Nu reacționează 2. Completează spațiile libere cu cuvintele potrivite: sulfuric bune liberă moluște clorhidric Acidul______se găsește în stare______în sucul gastric. Acidul ______ se găsește în glandele unor ______. Soluțiile acizilor sunt _______ conducătoare electrice. 3. REBUS 1 4 C A 2 Z 3 F O E L E C T 5 L I 6 C R I S R C L B N F O H O O C O L I R N I R I D H C O S T I A I D R I C ORIZONTAL 1. 2. 3. 4. Cel mai slab acid cunoscut; Element chimic cu Z = 3 o; Acid cu formula chimică H 3 PO 3; Denumire pe care o poartă soluțiile acizilor, datorită conductibilității electrice; 5. Starea de agregare a acidului sulfuric; 6. Acid care mai poartă și numele ”spirt de sare” VERTICAL – Pe coloana verticală veți găsi numele acidului se mai numește și ”apă tare”

Vă mulțumesc! BIBLIOGRAFIE: 1. Constantinescu, R. , Râpă, M. ”Chimie – manual pentru clasa a VIII-a”, Editura Sigma, București, 2000 2. Gheorghiu, C. , Panait, C. , ”Chimie – manual pentru clasa a VIII-a”, Editura Didactică și Pedagogică, București, 1995 3. Fătu, S. Stroe, F. , Stroe, C. ”Chimie – manual pentru clasa a VIII-a”, Editura Corint, București 4. Sitaru, V. , Fodor, I. , Rădăcină, M. ”Chimie, cls. VII-VIII, Olimpiade municipale, județene, naționale”, Ed. Corvin, Deva, 1996 La realizarea materialului s-au folosit imagini de pe site-urile: www. sciencephoto. org, www. wikipedia. org, www. snam. ro, www. paleowerkstatt. de, www. bayertechnology. com, www. fphotoshelter. com, www. amasci. net, www. chemmovies. unl. edu, www. clintarcher. com, www. dartmouth. edu, www. bioterapi. ro, www. ziarulring. ro, www. casazugravului. ro, www. ziarulring. ro, www. obiectivdesuceava. ro, www. radoxlab. ro, www. clubafaceri. ro, www. constantaconstruct. ro, www. chemistryland. com, www. econet. world, www. adelaida. ro. Realizat de prof. Florin Viu Școala Gimnazială ”Ion Lovinescu” Rădășeni Noiembrie 2012