Coltivazione dei virus animali in vitro colture cellulari


























- Slides: 44

Coltivazione dei virus animali in vitro: colture cellulari in vivo: sistemi animali 1

Colture cellulari rappresentano il metodo di elezione per la coltivazione dei virus animali coltivazione del virus su larga scala infezione sincrona condizioni chimico-fisiche standard 2

Colture cellulari condizioni chimico-fisiche • Condizioni chimiche - terreno di coltura chimicamente definito: soluzione isotonica di sali, glucosio, vitamine, aminoacidi, p. H 7. 3 (H 2 CO 3/CO 2), addizionato con siero per fornire fattori di crescita. • Condizioni fisiche - temperatura di 37°C 3

COLTIVAZIONE DI VIRUS SU LINEE CELLULARI - Linee di cellule primarie 5 -10 cicli di subcoltivazione - Linee di cellule diploidi da tessuto embrionale cicli di 40 -50 generazioni - Linee cellulari permanenti* crescono in monostrato o in sospensione producono tumori solidi negli animali * - Trasformazione spontanea - Trasformazione con virus oncogeni - Linee tumorali Non utilizzabili per produrre vaccini 4

Colture cellulari Cellule in monostrato crescono su superfici solide (plastica, vetro). Sono le più usate in virologia. Cellule in sospensione 5

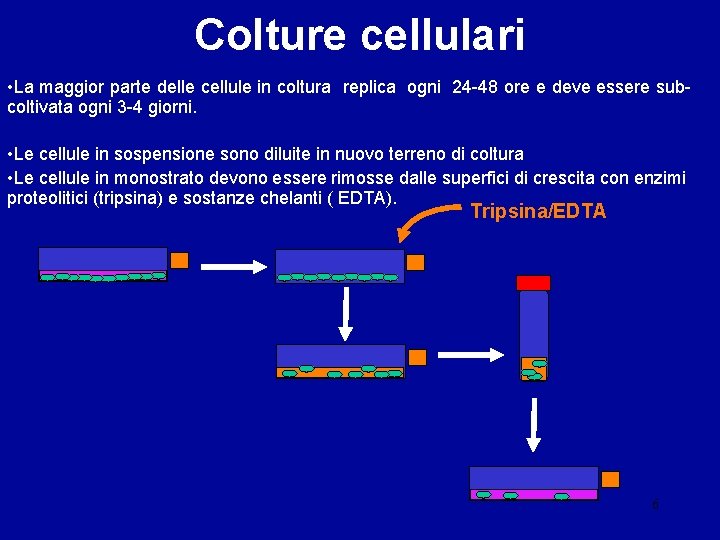
Colture cellulari • La maggior parte delle cellule in coltura replica ogni 24 -48 ore e deve essere subcoltivata ogni 3 -4 giorni. • Le cellule in sospensione sono diluite in nuovo terreno di coltura • Le cellule in monostrato devono essere rimosse dalle superfici di crescita con enzimi proteolitici (tripsina) e sostanze chelanti ( EDTA). Tripsina/EDTA 6

Cappa a flusso laminare biohazard sterilità sicurezza 7

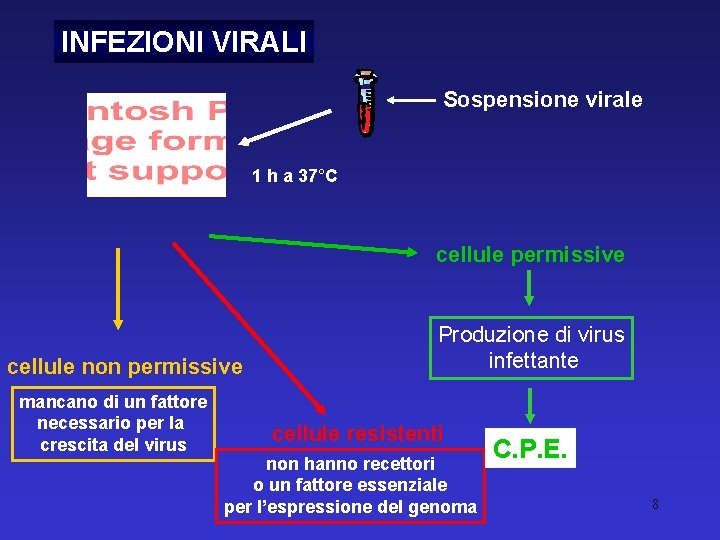
INFEZIONI VIRALI Sospensione virale 1 h a 37°C cellule permissive cellule non permissive mancano di un fattore necessario per la crescita del virus Produzione di virus infettante cellule resistenti non hanno recettori o un fattore essenziale per l’espressione del genoma C. P. E. 8

Animali da laboratorio Storicamente il primo metodo per studiare la propagazione dei virus. – Svantaggi - 1) costoso, 2) non omogeneo, 3) porta alla generazione di mutanti virali, 4) problemi etici, – Vantaggi - 1) fornisce informazioni sui meccanismi patogenetici del virus, 2) alcuni virus possono essere studiati solo in vivo, 9

10

Titolazione virale • La quantità del virus è detta titolo (il titolo virale può cambiare a seconda del metodo usato) • Il titolo è la misura della concentrazione del virus e viene espressa in unità/ml • Può essere rilevata mediate vari saggi - saggio delle placche, saggio di formazione di foci di trasformazione, saggio di diluizione limite, saggio di emoagglutinazione. 11

Misurazione diretta del numero di virioni Microscopia Elettronica La sospensione virale è posta su un retino per ME e colorato. L’inclusione di una quantità conosciuta di sfere di latex permette la quantizzazione del virus sfere di latex poxvirus (a forma di mattone e leggermente più piccoli) 12

Particelle virali vs. virioni infettanti • Non tutte le particelle virali sono infettanti. In molti casi la maggior parte dei virioni non è infettante • il rappoto tra il n° totale di particelle virali e i virioni infettanti è definito come rapporto particelle/PFU 13 From Principles of Virology , Flint et al ASM press

CICLO UNICO di REPLICAZIONE “One-Step” growth VIRUS BATTERI Number of viable bacteria inoculated Amount of virus inoculated Time Replication in progress Production of infective virus Lag phase Time Exponential growth Latency 14

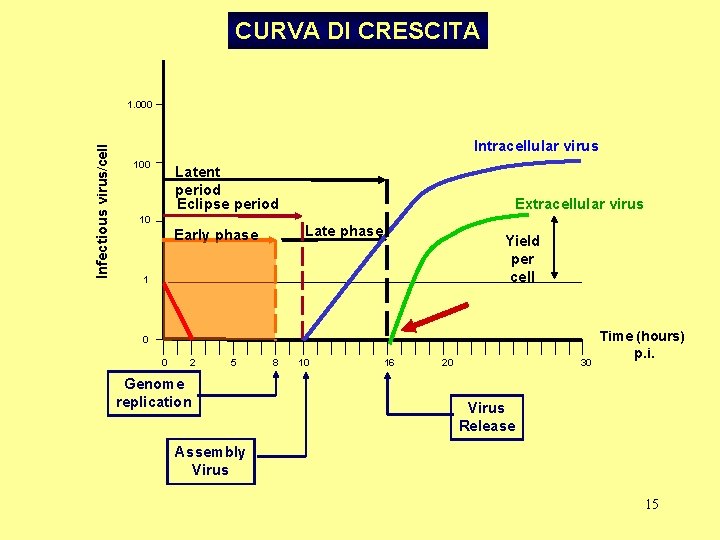
CURVA DI CRESCITA Infectious virus/cell 1. 000 Intracellular virus 100 Latent period Eclipse period 10 Extracellular virus Late phase Early phase Yield per cell 1 0 0 2 5 Genome replication 8 10 16 20 30 Time (hours) p. i. Virus Release Assembly Virus 15

-Penetrazione • Tutti i virus devono attraversare il doppio strato lipidico (i virus delle piante e dei batteri devono attraversare anche la parete cellulare). • La presenza o l’assenza dell’ involucro virale determina una notevole differenza nel meccanismo di penetrazione 16

- Adsorbimento virale primo evento del ciclo di replicazione virale Riconoscimento della cellula target da parte di proteine virali (VAP) VAP = Virus Attachment Proteins interazione elettrostatica - seguita da interazione idrofobica localizzata • - limita l’infezione a specifici tipi di cellule (cellule permissive) • determina il tropismo del virus – Tropismo tissutale - es. : rosolia (cellule epidermiche). morbillo (ghiandole salivari) – Tropismo di specie - es. : . influenza (cellule di mammifero e di uccelli), poliovirus (cellule di primati) 17

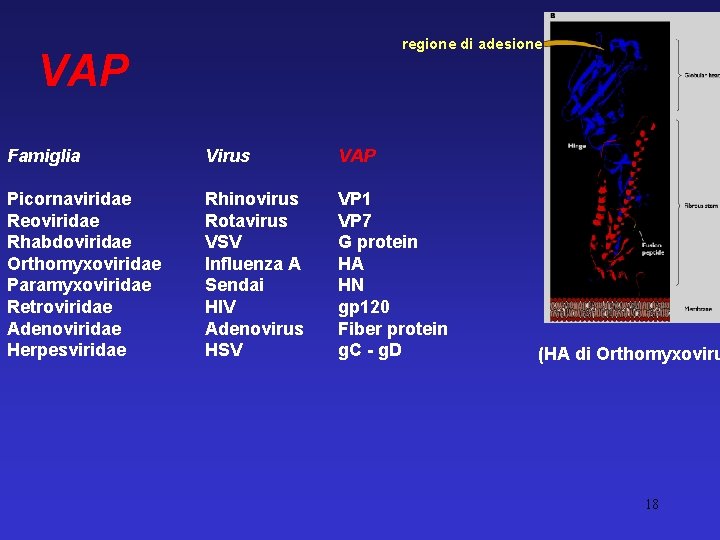
regione di adesione VAP Famiglia Virus VAP Picornaviridae Reoviridae Rhabdoviridae Orthomyxoviridae Paramyxoviridae Retroviridae Adenoviridae Herpesviridae Rhinovirus Rotavirus VSV Influenza A Sendai HIV Adenovirus HSV VP 1 VP 7 G protein HA HN gp 120 Fiber protein g. C - g. D (HA di Orthomyxoviru 18

Recettori di VIRUS ANIMALI Virus Recettore funzione Influenza virus acido sialico Usato anche da Reo- e corona- virus carboidrato Virus del Morbillo CD 46 e SLAM Usato anche da HHV 6 proteina di superficie dei linfociti B e T Poliovirus tipo molecolare Pvr proteina simile a Ig Rhinovirus ICAM-1 adesione intercellulare proteina simile a Ig Virus della Rabbia recettore per acetilcolina proteina neuronale 19

ENDOCITOSI • Semliki Forest virus (SFV), un togavirus rappresenta il primo esempio di penetrazione per endocitosi • Studi di microscopia elettronica (1980) dimostravano che il virus penetra mediante vescicole - oggi note come vescicole ricoperte di clatrina o CCV) A. Helenius 20

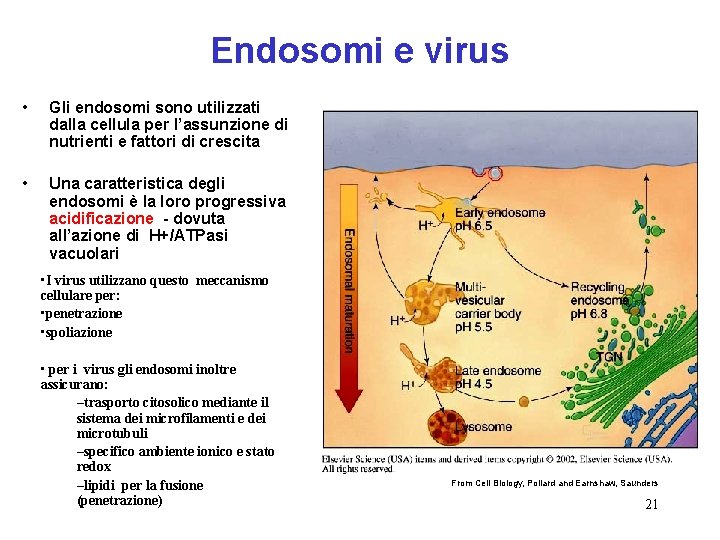
Endosomi e virus • Gli endosomi sono utilizzati dalla cellula per l’assunzione di nutrienti e fattori di crescita • Una caratteristica degli endosomi è la loro progressiva acidificazione - dovuta all’azione di H+/ATPasi vacuolari • I virus utilizzano questo meccanismo cellulare per: • penetrazione • spoliazione • per i virus gli endosomi inoltre assicurano: –trasporto citosolico mediante il sistema dei microfilamenti e dei microtubuli –specifico ambiente ionico e stato redox –lipidi per la fusione (penetrazione) From Cell Biology, Pollard and Earnshaw, Saunders 21

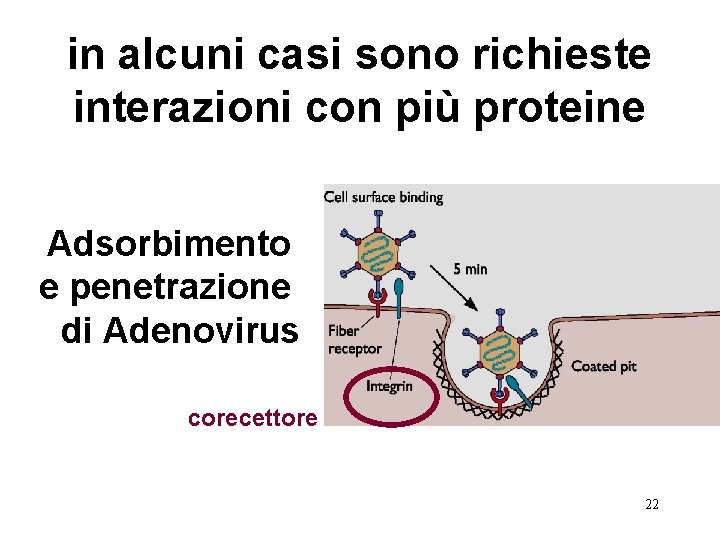
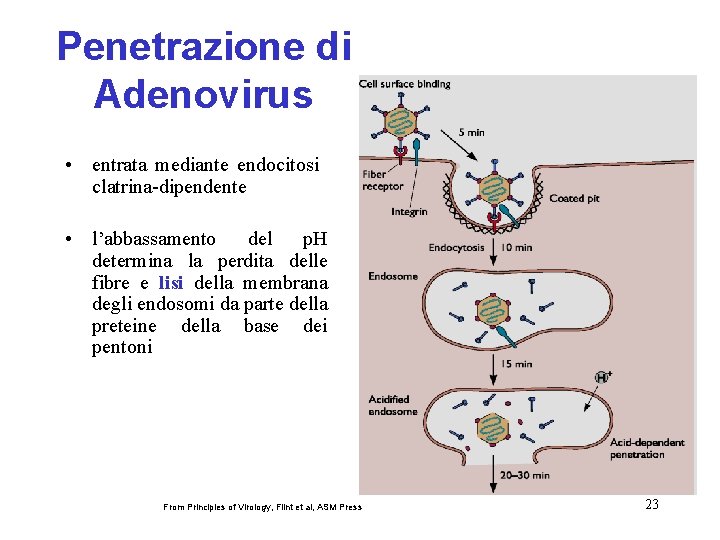
in alcuni casi sono richieste interazioni con più proteine Adsorbimento e penetrazione di Adenovirus corecettore 22

Penetrazione di Adenovirus • entrata mediante endocitosi clatrina-dipendente • l’abbassamento del p. H determina la perdita delle fibre e lisi della membrana degli endosomi da parte della preteine della base dei pentoni From Principles of Virology, Flint et al, ASM Press 23

Reovirus • Raro esempio di virus che richiede la fusione degli endosomi con i lisosomi • I Reovirus hanno un doppio capside, stabile a p. H bassi (virus gastrointestinali; rotavirus) • Le proteasi lisosomiali degradano il capside esterno - formazione della particella subvirale • Le fasi successive del processo di penetrazione non sono ancora del tutto conosciute 24 From Principles of Virology, Flint et al, ASM Press

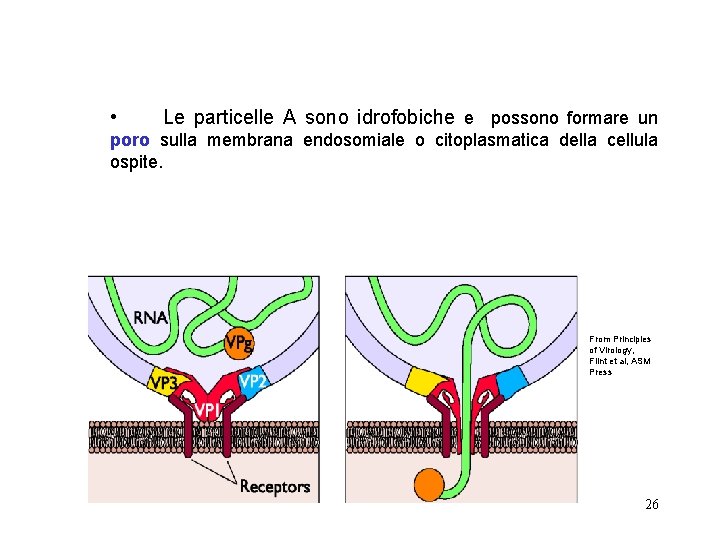
Picornaviridae penetrano per endocitosi in maniera p. H indipendente l’interazione con il recettore determina cambi conformazionali nella struttura del virione perdita della VP 4 e formazione della particella A (meno densa e più rilassata) From Principles of Virology, Flint et al, ASM Press 25

• Le particelle A sono idrofobiche e possono formare un poro sulla membrana endosomiale o citoplasmatica della cellula ospite. From Principles of Virology, Flint et al, ASM Press 26

Meccanismi di penetrazione: FUSIONE • 1) Fusione sulla plasmamembrana (p. H-indipenden • 2) Fusione negli endosomi (p. H-dipendente) 1 2 27

PARAMYXOVIRIDAE Struttura dei virioni PARAMYXOVIRUS 28

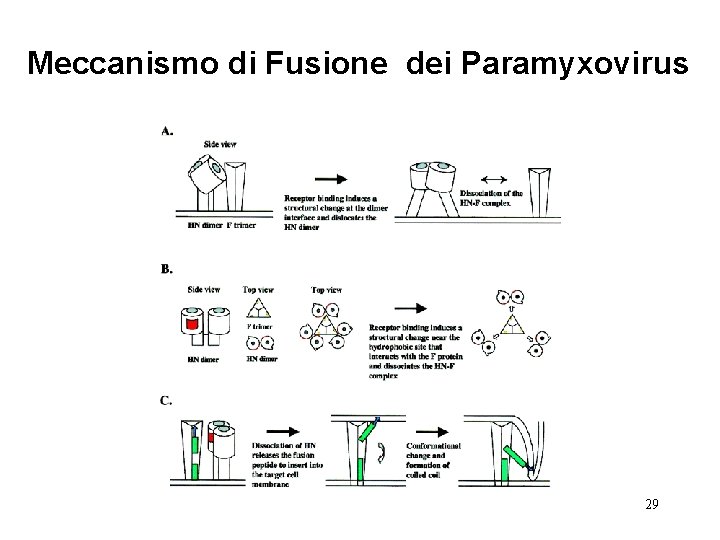
Meccanismo di Fusione dei Paramyxovirus 29

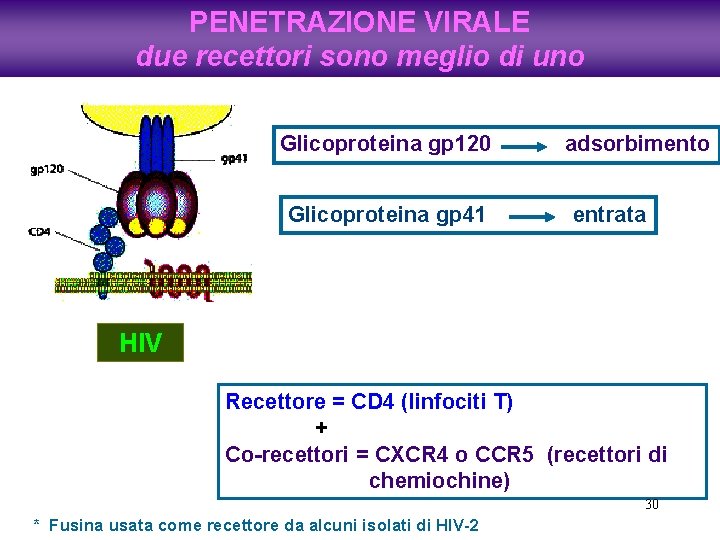
PENETRAZIONE VIRALE due recettori sono meglio di uno Glicoproteina gp 120 Glicoproteina gp 41 adsorbimento entrata HIV Recettore = CD 4 (linfociti T) + Co-recettori = CXCR 4 o CCR 5 (recettori di chemiochine) 30 * Fusina usata come recettore da alcuni isolati di HIV-2

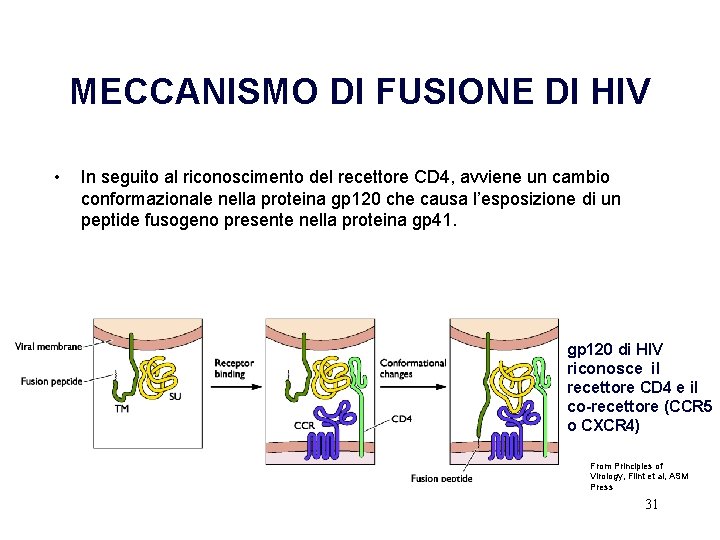
MECCANISMO DI FUSIONE DI HIV • In seguito al riconoscimento del recettore CD 4, avviene un cambio conformazionale nella proteina gp 120 che causa l’esposizione di un peptide fusogeno presente nella proteina gp 41. gp 120 di HIV riconosce il recettore CD 4 e il co-recettore (CCR 5 o CXCR 4) From Principles of Virology, Flint et al, ASM Press 31

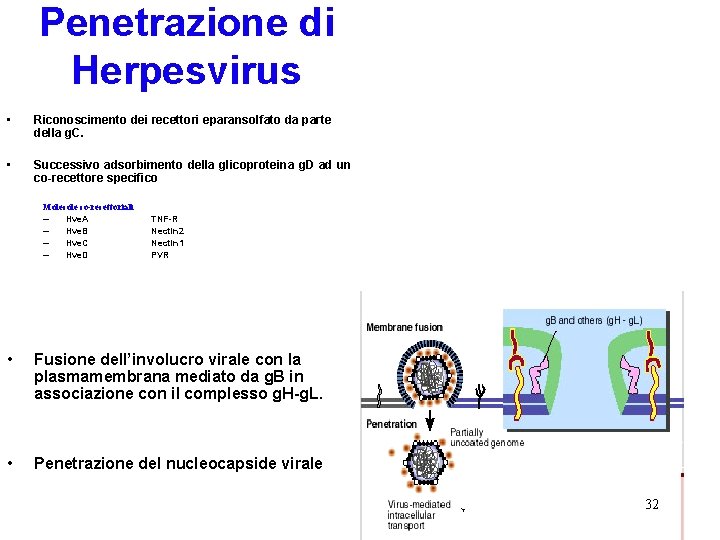
Penetrazione di Herpesvirus • Riconoscimento dei recettori eparansolfato da parte della g. C. • Successivo adsorbimento della glicoproteina g. D ad un co-recettore specifico Molecole co-recettoriali – Hve. A – Hve. B – Hve. C – Hve. D TNF-R Nectin 2 Nectin 1 PVR • Fusione dell’involucro virale con la plasmamembrana mediato da g. B in associazione con il complesso g. H-g. L. • Penetrazione del nucleocapside virale 32

FUSIONE p. H-DIPENDENTE Virus influenzale 33 FUSIONE SULLA MEMBRANA ENDOSOMIALE

Il cambio di p. H nell’endosoma ha un ruolo importante per la fusione del virus influenzale. Infatti, il virus presenta sul suo involucro la proteina M 2 che a p. H acido forma un canale ionico che permette l’acidificazione del virione, e promuove cambi conformazionali della proteina HA ed il distacco di M 1 dai complessi M 1/RNP Sostanze che bloccano la proteina M 2 inibiscono la penetrazione del virus influenzale - amantadina (altamente specifica per i canali ionici M 2 virali, non ha effetto sui canali cellulari H+/ATPasi) 34

Fusione del virus influenzale Cambio conformazionale di HA estensione peptide fusogeno p. H neutro p. H acido Virus Rotazione C-D 180 a. Monomero HA 0 (550 aa) in presenza di proteasi = subunita’ HA 1 (VAP) + HA 2 (Fusione), legate da legami S-S. N-term di HA 2 = peptide fusogeno (20 aa) b. Struttura del dominio solubile di HA 2 a p. H neutro c. Struttura del dominio solubile di HA 2 a p. H acido Box A-C-D = a-eliche 35

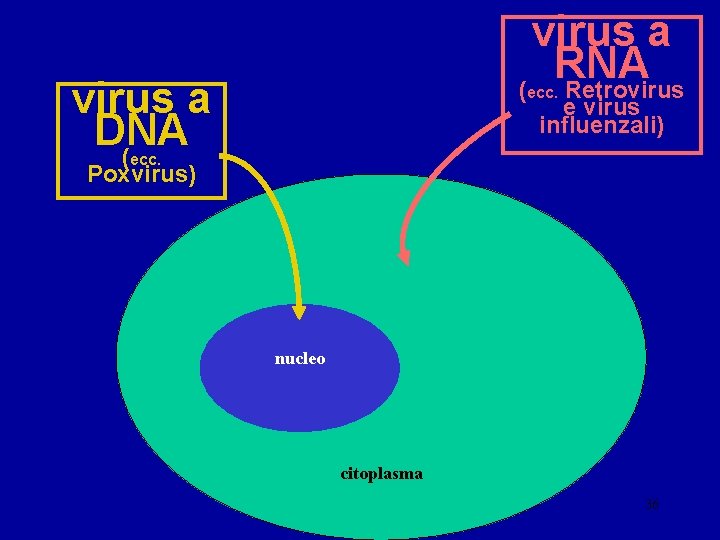
virus a RNA ( Retrovirus a DNA ( ecc. e virus influenzali) ecc. Poxvirus) nucleo citoplasma 36

REPLICAZIONE DEI VIRUS a DNA Tutti i virus eucariotici a DNA replicano nel nucleo • eccezione: poxvirus VANTAGGI • utilizzo di enzimi cellulari per la trascrizione degli m. RNA virali n n n RNA polimerasi II Attivatori e co-attivatori trascrizionali Enzimi per la sintesi del cap e per il processamento (splicing) dei trascritti • utilizzo di enzimi cellulari per la replicazione del genoma n DNA polimerasi ed enzimi associati (girasi, ATPasi, elicasi, primasi, RNasi, enzimi di riparo, ligasi) 37

Il trasporto citoplasmatico Adenovirus Herpesvirus • I capsidi (o nucleocapsidi) si legano al citoscheletro e utilizzano proteine dinamiche associate ai microtubuli (i. e. dineina) per facilitare il loro trasporto intracellulare 38

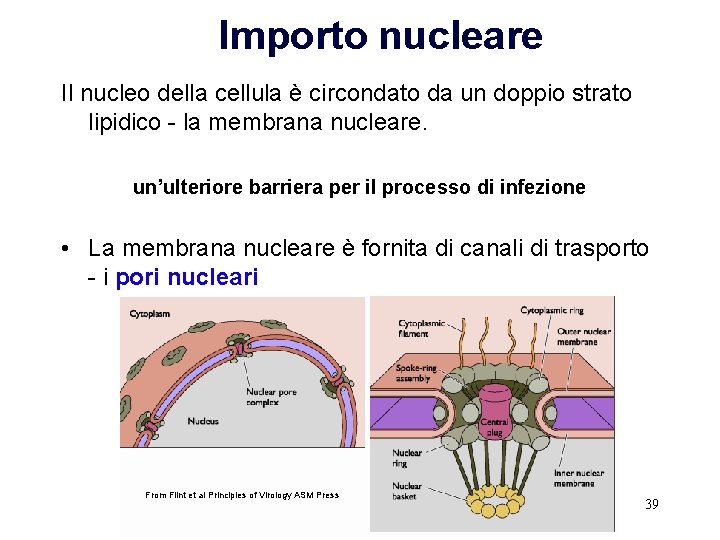
Importo nucleare Il nucleo della cellula è circondato da un doppio strato lipidico - la membrana nucleare. un’ulteriore barriera per il processo di infezione • La membrana nucleare è fornita di canali di trasporto - i pori nucleari From Flint et al Principles of Virology ASM Press 39

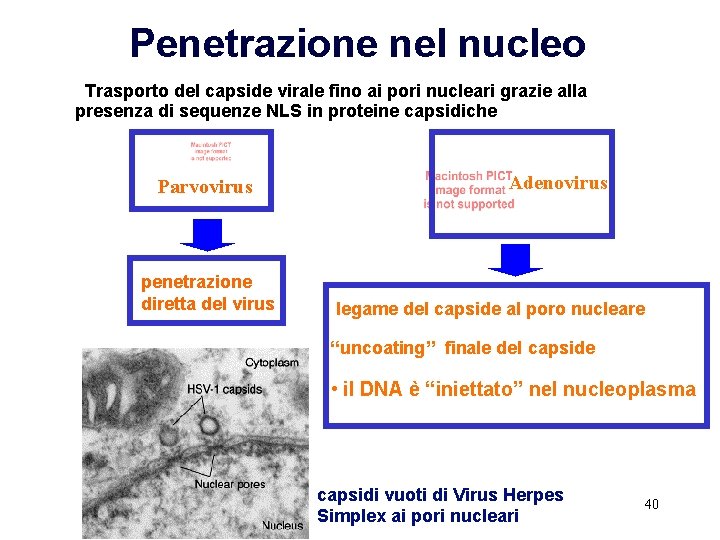
Penetrazione nel nucleo Trasporto del capside virale fino ai pori nucleari grazie alla presenza di sequenze NLS in proteine capsidiche Parvovirus penetrazione diretta del virus Adenovirus legame del capside al poro nucleare “uncoating” finale del capside • il DNA è “iniettato” nel nucleoplasma capsidi vuoti di Virus Herpes Simplex ai pori nucleari 40

Parvovirus • • Esempio di entrata diretta nel nucleo Piccolo virus a ss. DNA a simmetria icosaedrica (diametro 18 -26 nm) Penetrazione mediata endocitosi p. H-dipendente Il capside è formato da VP 1, VP 2 e VP 3 • VP 1 contiene una sequenza di segnale di localizzazione nucleare (NLS) • La sequenza NLS si lega a recettori dei PORI NUCLEARI (carioferine o importine) che permettono l’entrata diretta del virus nel nucleo dove avviene la spoliazione 41

Uncoating di Adenovirus • Trasporto mediato da dineina • Presenza di sequenze NLS in proteine del capside (100 nm) • I capsidi vengono trasportati fino ai pori. ma………la massima grandezza funzionale del poro nucleare è di 26 nm • Il capside si lega al poro nucleare, subisce il disassemblaggio finale e il DNA viene “iniettato” nel nucleo. From Principles of Virology, Flint et al, ASM Press 42

Herpesvirus presenza di sequenze NLS nelle proteine che formano il capside virale viene trasportato ai pori nucleari • si lega al poro nucleare e subisce “uncoating” finale • il DNA è “iniettato” nel nucleoplasma. Notare i capsidi vuoti ai pori nucleari From Whittaker Trends Microbiol 6: 178 43

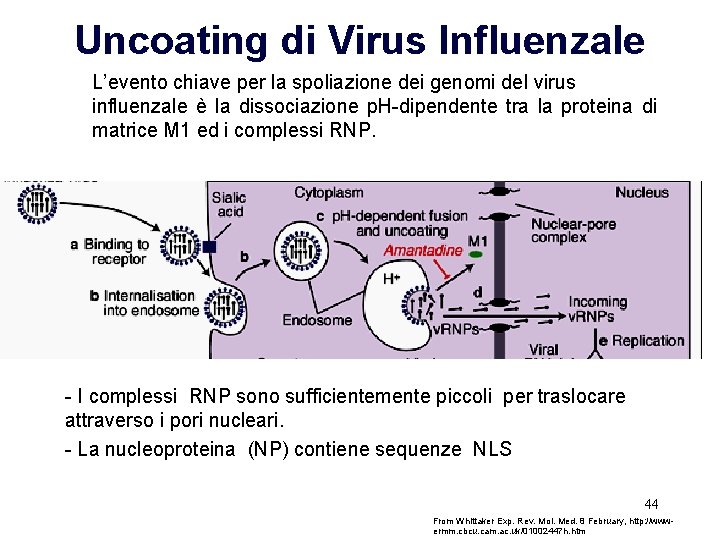
Uncoating di Virus Influenzale L’evento chiave per la spoliazione dei genomi del virus influenzale è la dissociazione p. H-dipendente tra la proteina di matrice M 1 ed i complessi RNP. - I complessi RNP sono sufficientemente piccoli per traslocare attraverso i pori nucleari. - La nucleoproteina (NP) contiene sequenze NLS 44 From Whittaker Exp. Rev. Mol. Med. 8 February, http: //wwwermm. cbcu. cam. ac. uk/01002447 h. htm
 Coltivazione del pioppo ciclo breve
Coltivazione del pioppo ciclo breve Giunzioni cellulari
Giunzioni cellulari Biocatalizzatori cellulari
Biocatalizzatori cellulari Cellulari 3
Cellulari 3 Organuli cellulari
Organuli cellulari Dimensioni organuli cellulari
Dimensioni organuli cellulari Giunzioni cellulari zanichelli
Giunzioni cellulari zanichelli Dipendenza da cellulare test
Dipendenza da cellulare test Molécule simple
Molécule simple Tumacenje ige
Tumacenje ige Procedure for isolation of cell for in vitro culture
Procedure for isolation of cell for in vitro culture Iman siadat
Iman siadat University of pittsburgh
University of pittsburgh Felice shieh
Felice shieh Pembuahan in vitro
Pembuahan in vitro Concorso foto animali
Concorso foto animali Lapbook fiume
Lapbook fiume Bruco assassino
Bruco assassino Protozoi
Protozoi Primo levi impruneta
Primo levi impruneta Classi di animali
Classi di animali Celomati
Celomati Arctocefalo
Arctocefalo Quali sono gli animali omeotermi
Quali sono gli animali omeotermi Simmetria raggiata significato
Simmetria raggiata significato Ruminant animals
Ruminant animals Eterotermi
Eterotermi Omeotermi animali
Omeotermi animali Corpo artropodi
Corpo artropodi Molti son li animali a cui s'ammoglia
Molti son li animali a cui s'ammoglia Simmetria raggiata significato
Simmetria raggiata significato Animali del bosco in inverno
Animali del bosco in inverno Animali invertebrati
Animali invertebrati Studio animali
Studio animali Simmetria bilaterale
Simmetria bilaterale I 5 regni della natura
I 5 regni della natura Esempi di animali cordati
Esempi di animali cordati Simmetria biradiale
Simmetria biradiale Cefalocordati
Cefalocordati Qui tollis peccata mundi miserere nobis
Qui tollis peccata mundi miserere nobis Canzoncina dei diritti dei bambini
Canzoncina dei diritti dei bambini Tabella dei numeri fissi dei poligoni regolari
Tabella dei numeri fissi dei poligoni regolari Virus family
Virus family Stomach virus
Stomach virus Conclusión de virus y bacterias
Conclusión de virus y bacterias