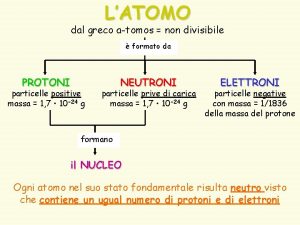
Clase N 3 tomos molculas y iones Compuestos





















- Slides: 41

Clase Nº 3 Átomos, moléculas y iones Compuestos iónicos Tópicos de nomenclatura inorgánica Estequiometría Masa atómica, masa molar y número de avogadro. Conce mol Ecuaciones y reacciones químicas Composicion porcentual de los compuestos.

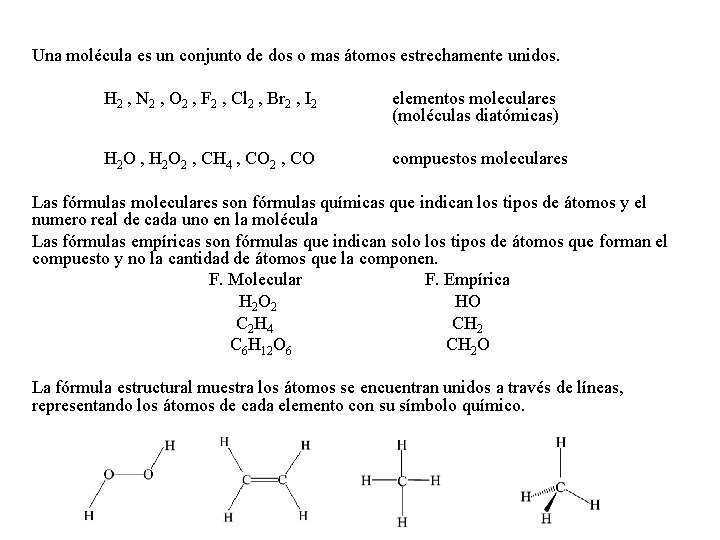
Moléculas y Fórmulas Químicas Una molécula es un conjunto de dos o mas átomos estrechamente unidos. H 2 , N 2 , O 2 , F 2 , Cl 2 , Br 2 , I 2 elementos moleculares (moléculas diatómicas) H 2 O , H 2 O 2 , CH 4 , CO 2 , CO compuestos moleculares Las fórmulas moleculares son fórmulas químicas que indican los tipos de átomos y el numero real de cada uno en la molécula Las fórmulas empíricas son fórmulas que indican solo los tipos de átomos que forman el compuesto y no la cantidad de átomos que la componen. F. Molecular F. Empírica H 2 O 2 HO C 2 H 4 CH 2 C 6 H 12 O 6 CH 2 O La fórmula estructural muestra los átomos se encuentran unidos a través de líneas, representando los átomos de cada elemento con su símbolo químico.

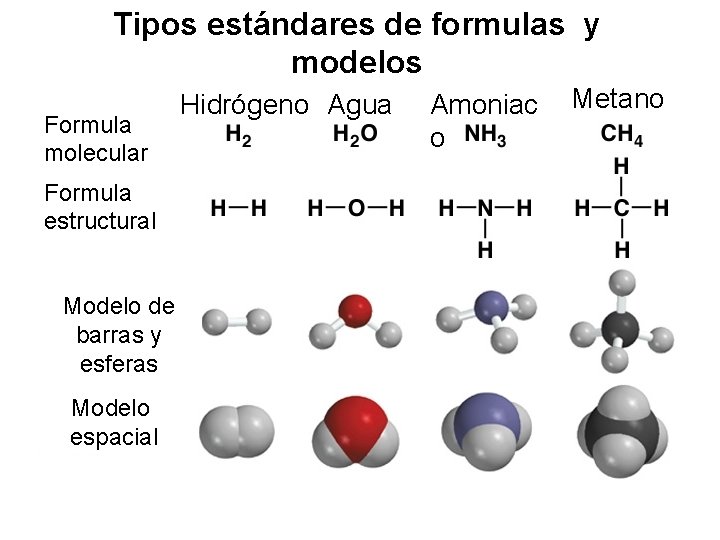
Tipos estándares de formulas y modelos Formula molecular Formula estructural Modelo de barras y esferas Modelo espacial Hidrógeno Agua Amoniac o Metano

Los Compuestos Iónicos son compuestos que contienen iones con carga positiva (cationes) y con carga negativa (aniones), Generalmente, se forman por la transferencia electrónica desde los metales a los no-metales. En la forma molecular se coloca primero el metal y luego el nometal Ejemplo: KCl - Na 2 O - Ca. Cl 2 Los compuestos moleculares sólo contienen elementos no-metales Ejemplo: CH 4 - CCl 4 - HCCl 3 - SO 2

Los compuestos químicos son eléctricamente neutros. Los iones de un compuesto iónico siempre se encuentran en una proporción tal que la carga positiva total es igual a la carga negativa total. Ejemplo: Na. Cl, Ba. Br 2, Al. I 3 , Fe. S Cuando las cargas de los cationes y aniones sean desiguales estos se combinan según la fórmula Catión Mm+ - Anión Nn- Compuesto Iónico Mn Nm Ejemplo: Zn 2+ Na+ Cu 2+ Fe 3+ SO 42 PO 43 NO 3 Cl. Cl- Zn. SO 4 Na 3 PO 4 Cu(NO 3)2 Fe. Cl 3 sulfato de zinc fosfato de sodio nitrato de cobre (II) cloruro de hierro (III)

Tópicos de Nomenclatura Inorgánica

Nombres y Fórmulas de compuestos iónicos 1. Ø Iones Positivos (Cationes) Son iones que se forman a partir de átomos metálicos y mantienen el nombre del metal. Na+ ion sodio ; Zn 2+ ion cinc ; Al 3+ ion aluminio Ø Si un metal forma cationes con diferente carga, la carga positiva se indica con números romanos entre paréntesis Fe 2+ ion hierro (II) Cu+ ion cobre (I) Fe 3+ ion hierro (III) Cu 2+ ion cobre (II) Nomenclatura antigua que aun se utiliza son las terminaciones –oso e –ico Fe 2+ ion ferroso Fe 3+ ion férrico Cu+ ion cuproso Cu 2+ ion cúprico

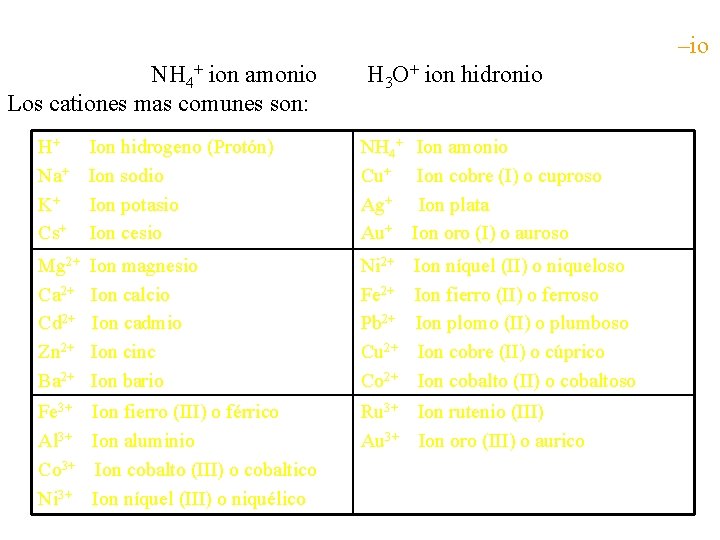
ØLos cationes formados a partir de átomos no-metálicos terminan en –io NH 4+ ion amonio H 3 O+ ion hidronio Los cationes mas comunes son: H+ Ion hidrogeno (Protón) Na+ Ion sodio K+ Ion potasio Cs+ Ion cesio NH 4+ Cu+ Ag+ Au+ Ion amonio Ion cobre (I) o cuproso Ion plata Ion oro (I) o auroso Mg 2+ Ca 2+ Cd 2+ Zn 2+ Ba 2+ Ion magnesio Ion calcio Ion cadmio Ion cinc Ion bario Ni 2+ Fe 2+ Pb 2+ Cu 2+ Co 2+ Ion níquel (II) o niqueloso Ion fierro (II) o ferroso Ion plomo (II) o plumboso Ion cobre (II) o cúprico Ion cobalto (II) o cobaltoso Fe 3+ Al 3+ Co 3+ Ni 3+ Ion fierro (III) o férrico Ion aluminio Ion cobalto (III) o cobaltico Ion níquel (III) o niquélico Ru 3+ Ion rutenio (III) Au 3+ Ion oro (III) o aurico

2. Iones negativos Aniones Los Iones negativos monoatómicos y poliatómicos llevan nombres terminados en -uro. Los iones de oxígeno terminan en –ido H- ion hidruro N 3 - ion nitruro Cl- ion cloruro O 2 - ion óxido OH- ion hidróxido CN- ion cianuro O 22 - ion peróxido Los aniones poliatómicos que contienen oxigeno (oxianión) terminan en –ato o –ito NO 3 - nitrato SO 42 - sulfato NO 2 - nitrito SO 32 - sulfito Los oxianiones que contienen halógenos se utilizan los prefijos per- e hipo- además de las terminaciones –ato e –ito Cl. O 4 - perclorato Cl. O 2 - clorito Cl. O 3 - clorato Cl. O- hipoclorito

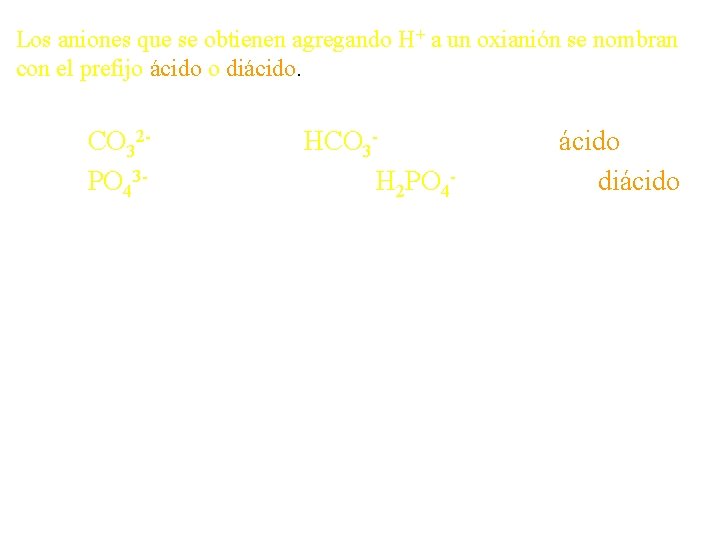
Los aniones que se obtienen agregando H+ a un oxianión se nombran con el prefijo ácido o diácido. CO 32 - carbonato PO 43 - fosfato HCO 3 - ion carbonato ácido H 2 PO 4 - ion fosfato diácido

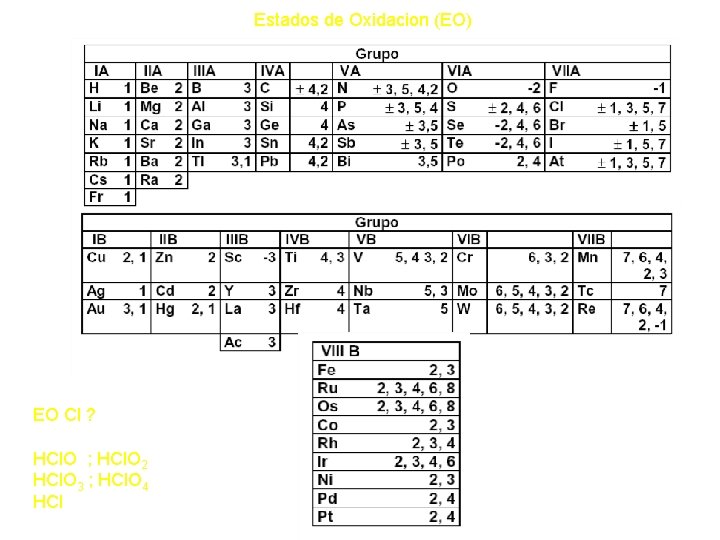
Números de Oxidación o Estados de Oxidación(EO) Es la carga eléctrica neta que presenta el átomo en una molécula o ión. Las siguientes reglas ayudan a asignar el EO de los elementos. 1. - Sus valores pueden ser positivos o negativos. 2. - Un elemento puede tener uno ó más EO. Todos los Metales alcalinos (Grupo IA) tienen EO + 1. Todos los metales Alcalinos Térreos (Grupo II A) tienen EO + 2. El aluminio siempre tiene EO + 3 en todos sus compuestos. 3. - En los elementos libres (que no están combinados) el EO es cero. 4. - En una molécula neutra, la suma de los EO de todos los átomos debe ser cero. 5. - Para los iones formados por un sólo átomo el EO es igual a la carga del ión. (Para Li+ su EO es +1 y O 2 - su EO – 2) 6. - En un ión poliatómico la suma de los EO de todos los elementos debe ser igual a la carga neta del ión. Por ejemplo, en el ión amonio NH 4+; N (-3), H (+1). La suma de los EO es – 3 + 4 (+1)= +1, que es la carga neta del ión. 7. - El EO del oxigeno en la mayoría de sus componentes es – 2 excepto en los peróxido donde actúa con su EO-1 8. - El EO del hidrógeno en la mayoría de sus compuestos es +1 excepto cuando esta formando hidruros (unido a un metal) donde actúa con su EO-1

Estados de Oxidacion (EO) EO Cl ? HCl. O ; HCl. O 2 HCl. O 3 ; HCl. O 4 HCl


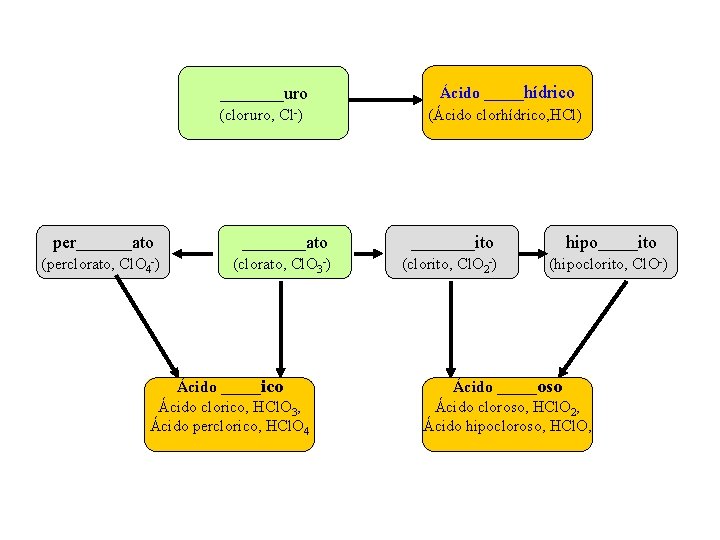
Aniones simples ____uro (cloruro, Cl-) + H+ Ácido _____hídrico (Ácido clorhídrico, HCl) Oxianiones + átomo O per_______ato (perclorato, Cl. O 4 -) + H+ Oxiácidos - átomo O ____ato ____ito hipo_____ito (clorato, Cl. O 3 -) + H+ Ácido _____ico Ácido clorico, HCl. O 3, Ácido perclorico, HCl. O 4 (clorito, Cl. O 2 -) (hipoclorito, Cl. O-) + H+ Ácido _____oso Ácido cloroso, HCl. O 2, Ácido hipocloroso, HCl. O, Si el atomo tiene tres valencias en el nombre no se considera la terminación per ato o ico

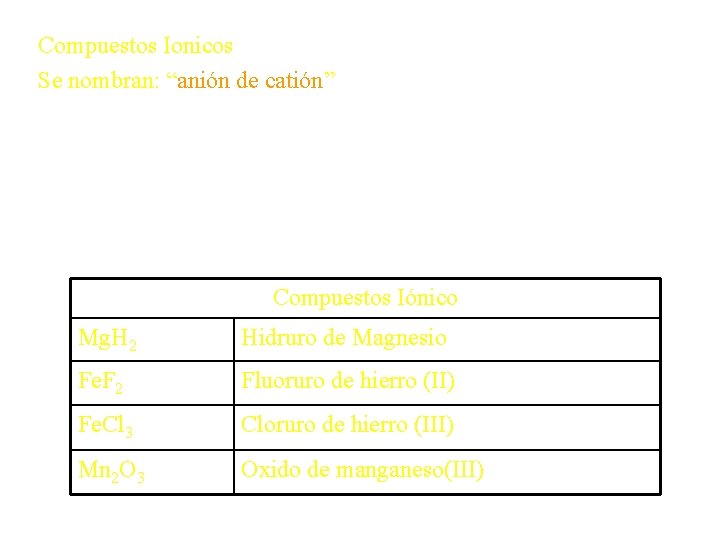
Compuestos Ionicos Se nombran: “anión de catión” Ba. Br 2 bromuro de bario Al(NO 3)2 nitrato de aluminio Cu(Cl. O 4)2 perclorato de cobre (II) Compuestos Iónico Mg. H 2 Hidruro de Magnesio Fe. F 2 Fluoruro de hierro (II) Fe. Cl 3 Cloruro de hierro (III) Mn 2 O 3 Oxido de manganeso(III)

H 2 S NF 3 Compuesto Molecular (No-Metales) Sulfuro de hidrogeno o ácido sulfhídrico Trifluoruro de nitrógeno N 2 O Monóxido de dinitrógeno SO 2 Dióxido de azufre

Estequiometría

Relaciones de masa en las reacciones químicas Se ha visto que las unidades de masa atómica (uma) constituyen una escala relativa de las masas de losdado elementos. Pero que las masas de los átomos son tan pequeñas. Por ejemplo, la masa de un átomo de 12 C es 1, 993 x 10 -23 g No es posible diseñar Las muestras materiales balanza alguna que manejadas en el mundo real pueda medirlas en contienen una enorme unidades cantidad convencionales de átomos Por estas razones se inventó una unidad para manejar una gran cantidad de átomos

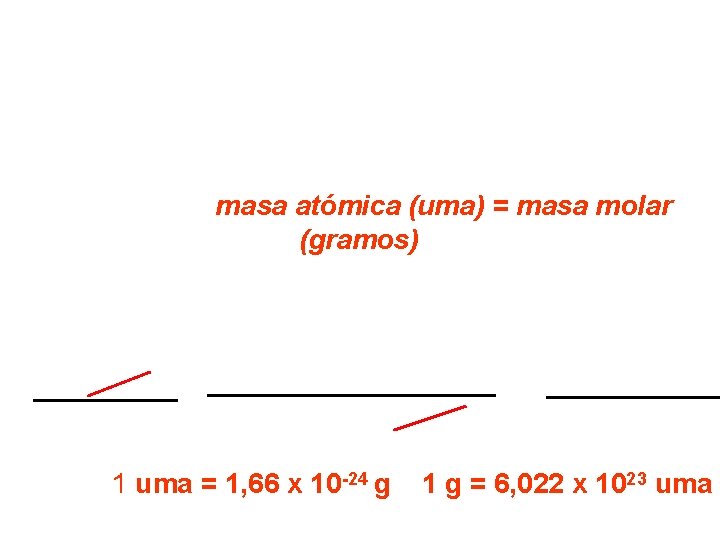
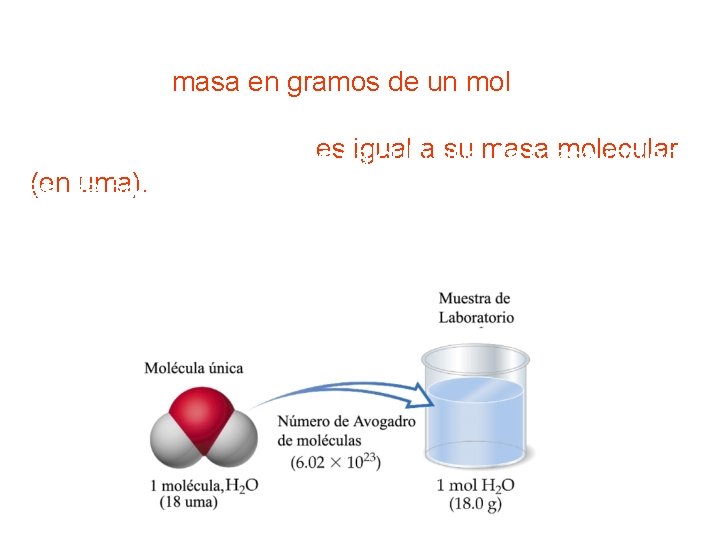
La unidad SI definida para dicho propósito es e El mol es la cantidad de una sustancia que contiene tantas entidades elementales (átomos, moléculas u otras partículas) como átomos hay exactamente en 12, 00 g de 12 C 1 mol = 6, 022045 x 1023 partículas Número de Avogadro Entonces, un mol de átomos de carbono 12 tiene exactamente una masa de 12 g y contiene 6, 02 x 1023 átomos. Esta cantidad se llama masa molar del carbono 12, que numéricamente es igual a su masa atómica

Análogamente, para masa molar = 22, 99 Na: masa atómica =22, 99 uma; luego g Cu: masa atómica = 63, 55 uma; entonces masa molar = 63, 5 Por consiguiente, para cualquier elemento: masa atómica (uma) = masa molar (gramos) Relación entre uma y gramo Se obtiene de la siguiente manera: 12, 00 g 1, 66 x 10= 24 x 23 12 g 1 uma 12, 00 uma 6, 022 x 10 átomos C 1 átomo 12 C 1 uma = 1, 66 x 10 -24 g 1 g = 6, 022 x 1023 uma

Ejemplo. Calcular el número de átomos que hay en 0, 55 potasio (K) Se sabe que: 1 mol átomos de K = 39, 10 g de K 1 mol de K = 6, 022 x 1023 átomos de K Entonces, el Nº de átomos de potasio es: 1 mol K 6, 022 x 1023 átomos K x 0, 551 g Kx 1 mol K 39, 10 g K Nº de átomo de K=8, 49 x 1021 átomos K

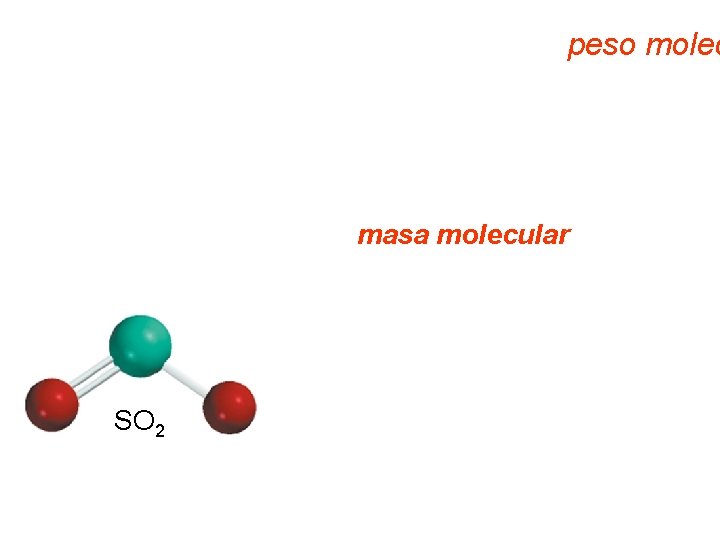
Masa molecular, también llamado peso molec Recordar que una molécula es un agregado de dos o más átomos, que las moléculas (de elementos y de compuestos) se representan por fórmulas químicas y que para las moléculas de los compuestos su usan tanto formulas moleculares como empíricas. Entonces, se define como masa molecular a la suma de las masas atómicas (en uma) en una molécula. Ejemplo, 32, 07 uma 1 S 2 O + (2 x 16, 00 uma) SO 2 64, 07 uma = masa molec

Masa molar de un compuesto Es la masa en gramos de un mol de compuesto y numéricamente escalculó igual aque su masa molecular En el ejemplo anterior se la masa molecular (ende uma). Por consiguiente, su masa molar es 64, 07 uma. Análogamente, dado que la masa molecular del agua es 18, 02 uma, su masa molar es de 18, 02 g.

Ejemplo Calcular el N° de átomos de H que hay en 72, 5 de C 3 que H 8 O: Se sabe 1 mol C 3 H 8 O = (3 x 12) + (8 x 1) + 16 = 60 1 moléculas C 3 H 8 O = 8 átomos H 1 mol H = 6, 022 x 1023 átomos H - Con esto se obtiene que el Nº de átomos de H estará da 23 átms H 8 mol átms H 6, 022 x 10 1 mol C H O 3 8 x 72, 5 g C 3 H 8 x. O x 60 g C 3 H 8 O 1 mol átms H = Nº de átomos de H = 5, 82 x 1024 átomos H

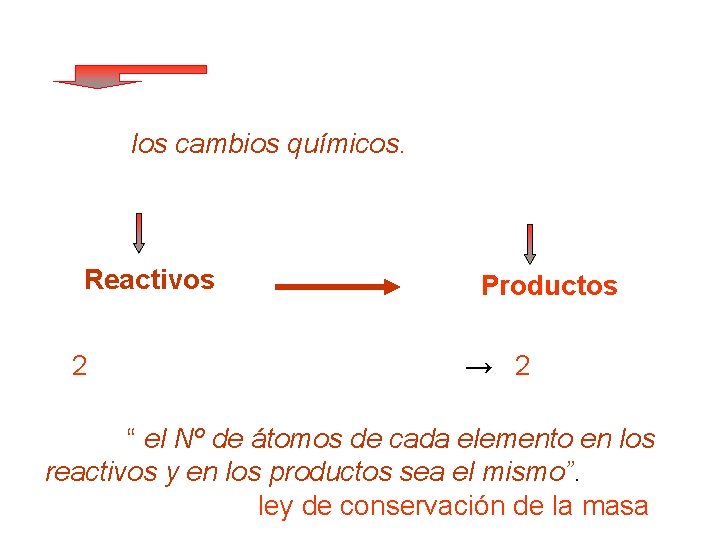
Ecuaciones químicas La forma convencional para representar las reacciones Esto es, los cambios químicos. Sustancias que cambian Reactivos Sustancias que se forman Productos Ejemplo 2 H 2 + O 2 → 2 H 2 O Deben balancearse utilizando coeficientes, de modo que: “ el Nº de átomos de cada elemento en los reactivos y en los productos sea el mismo”. Así, se cumple con la ley de conservación de la masa

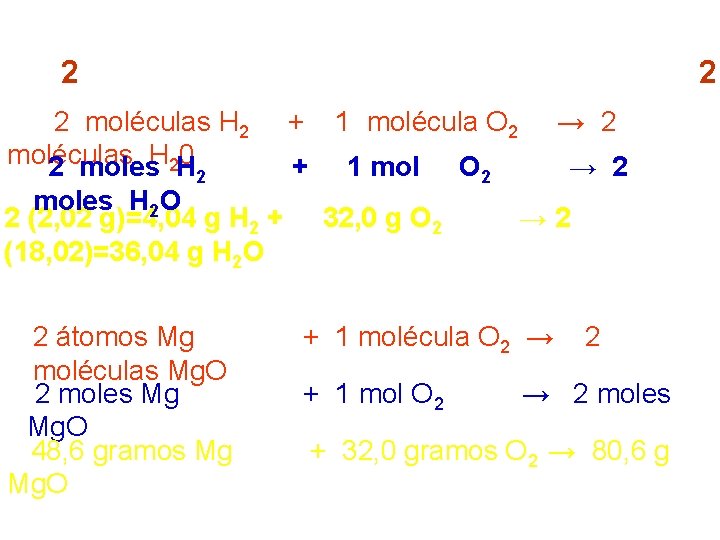
Lectura de una ecuación química: Ejemplos: 2 H 2 + 2 moléculas H 2 moléculas 0 2 moles. H 2 H 2 + + moles H 2 O 2 (2, 02 g)=4, 04 g H 2 + (18, 02)=36, 04 g H 2 O 2 Mg Mg. O 2 átomos Mg moléculas Mg. O 2 moles Mg Mg. O 48, 6 gramos Mg Mg. O + O 2 → 1 molécula O 2 1 mol → 2 O 2 32, 0 g O 2 → 2 O 2 → + 1 molécula O 2 → + 1 mol O 2 2 2 → 2 moles + 32, 0 gramos O 2 → 80, 6 g 2 H

A menudo se indica también el estado físico (solido, líquido o gaseoso) de los reactivos y productos. Ejemplo 2 P (s + 3 Cl(g) → (l) 2 PCl 3 2 ) Si las especies de la reacción están disueltas en agua. en ambiente acuoso KBr(ac) + Ag. Br Ag. NO (ac) 3 → (ac) KNO 3 + (s ) das las ecuaciones químicas deben cumplir con la ley conservación de la masa

Balanceo de ecuaciones químicas Se deben seguir los siguiente pasos: 1º- Se identifica a todos los reactivos y producto con sus respetivas formulas correctas. Ejemplo: Para la reacción entre etano (C 2 H 6) y oxígeno (O 2) para formar dióxido de carbono (CO 2) y agua (H 2 O), se escribe: C 2 H 6 + O 2 → CO 2 + H 2 O 2º- Se identifican los elementos que aparecen una sola vez en cada lado de la ecuación y con igual números de átomos. Las fórmulas que contengan estos elementos deben tener el mismo coeficiente

3º- Se identifican los elementos que están una sola vez en cada lado de la ecuación con distintos números de átomos; procediéndose a balancearlos en primer lugar. C 2 H 6 + O 2 → CO 2 + H 2 O Es el caso del H y el C en el ejemplo. - Para balancear el H se coloca un 3 delante del H 2 O C 2 H 6 + O 2 2→ CO 23 + H 2 O - El C se balancea colocando un 2 delante del CO 2 En ningún caso se modifican los subíndices de las fórmulas !!!!!!!

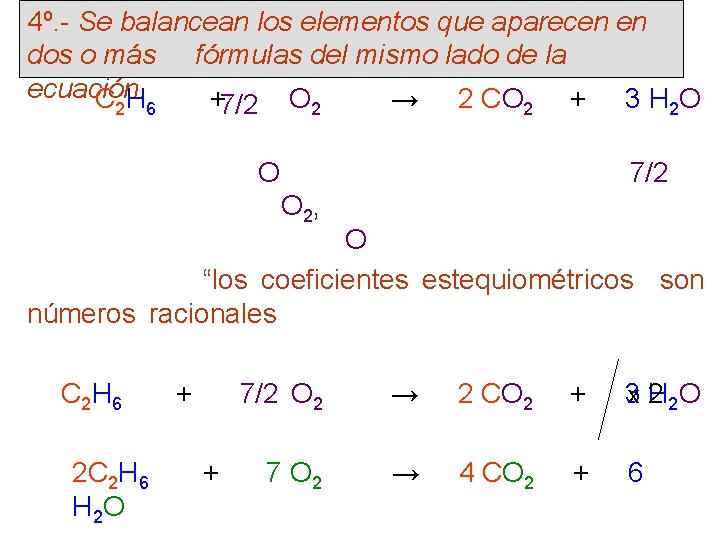
4º. - Se balancean los elementos que aparecen en dos o más fórmulas del mismo lado de la ecuación. C 2 H 6 +7/2 O 2 → 2 CO 2 + 3 H 2 O Es el caso del O que aparece en dos productos Para balancear el O la única manera es colocar 7/2 delante del reactivo O 2, ya que al lado de los productos hay 7 átomos O y 2 Se al lado de los reactivos ve que “los coeficientes estequiométricos son números racionales”; siendo preferibles expresarlos como números Para el efecto, enteros. se multiplica toda la ecuación por 2 C 2 H 6 + 7/2 O 2 → 2 CO 2 + 3 x 2 H 2 O Así, finalmente queda como: 2 C 2 H 6 + 7 O 2 → 4 CO 2 + 6 H 2 O

5º. - Finalmente se verifica el número de átomos de cada elemento sea el mismo a ambos lados de la ecuación balanceada 2 C 2 H 6 + H 2 O (2 x 2)= 4 C 7 O 2 → 4 CO 2 + 6 4 C (2 x 6)= 12 H (6 x 2) = 12 H (7 x 2) = 14 O (4 x 2) + ( 6 x 2) = 14 O La ecuación cumple con la ley de conservación de la masa !!!!!

Puede darse casos en que aparezcan elementos una sola vez en cada lado de la ecuación y con igual número de Porátomos. ejemplo en: KCl. O 3 (s) → KCl(s) + O 2 (g) Es el caso del K y del Cl En estos casos se identifica primero a estos elementos para asignarle el mismo coeficiente a las fórmulas que los contengan En el ejemplo KCl. O 3 y KCl deben tener el mismo coeficiente. El paso siguiente es igualar el número de átomos de O 2 KCl. O 3 → 2 KCl +3 O 2 Ecuación balanceada !!!!!

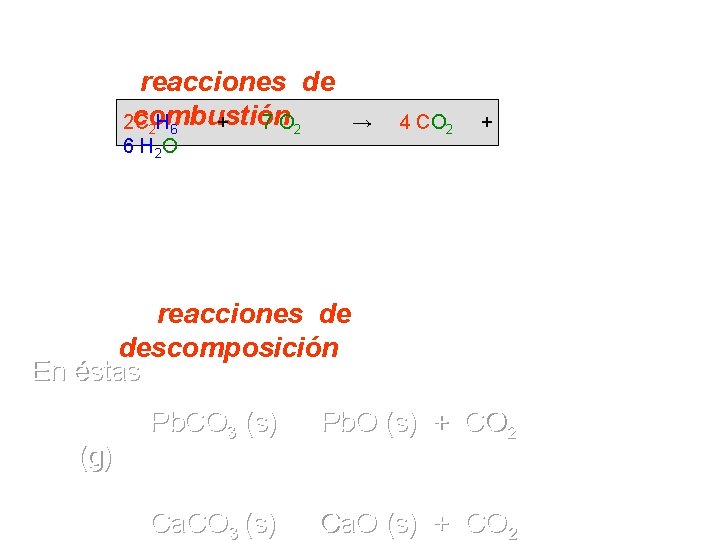
Tipos de reacciones de combustión 2 C + 7 O 2 2 H 6 6 H 2 O → 4 CO 2 + En éstas siempre interviene el oxígeno como reactivo los productos CO 2 y H 2 O. Otro ejemplo típico es: C 3 H 8 (g) + 5 O 2 (g) → 3 CO 2 (g) + 4 H 2 O (l) reacciones de descomposición En éstas hay siempre más productos que reactantes. Ej (g) Pb. CO 3 (s) → Pb. O (s) + CO 2 Ca. CO 3 (s) → Ca. O (s) + CO 2

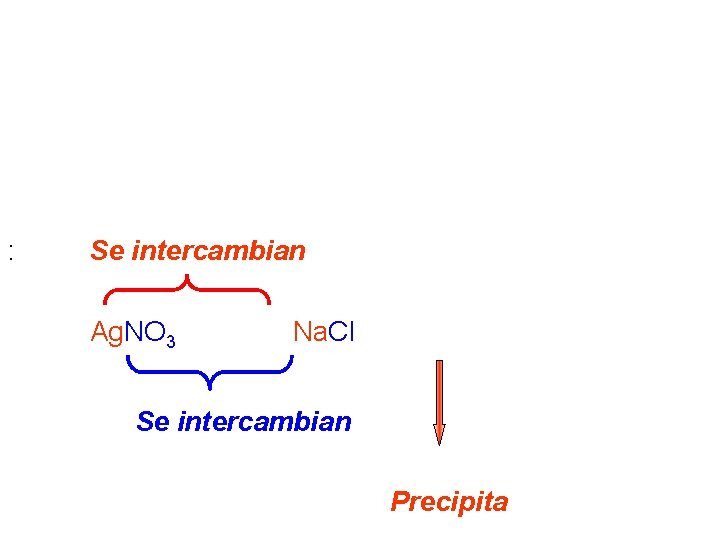
Un tercer tipo de reacciones son las de reacciones de metátesis (intercambio). Se dan generalmente entre compuestos iónicos e involucran el intercambio de aniones y cationes, formándose un producto que precipita Ejemplo: . : Se intercambian Ag. NO 3 (ac) + Na. Cl (ac) → Ag. Cl(s) + Na. NO 3 (a Se intercambian Precipita

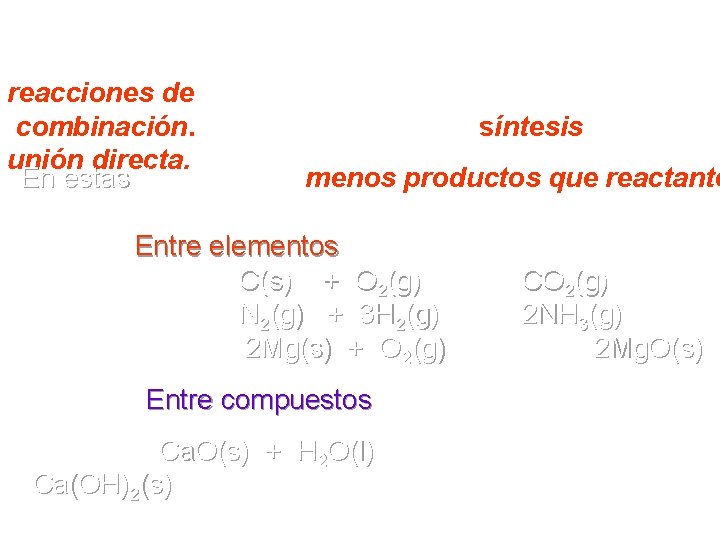
Además de las reacciones anteriores, existen las reacciones de combinación. También llamadas de síntesis o de unión directa. En estas hay siempre menos productos que reactante Ejemplos: Entre elementos C(s) + O 2(g) → CO 2(g) N 2(g) + 3 H 2(g) → 2 NH 3(g) 2 Mg(s) + O 2(g) → 2 Mg. O(s) Entre compuestos Ca. O(s) + H 2 O(l) Ca(OH)2(s) →

Composición porcentual en masa de los comp Como se ha visto, la fórmula de un compuesto indica su composición. La composición se puede expresar convenientemente como el porcentaje en masa de cada elemento presente en el compuesto. Así, del elemento x Peso. Atomico del elemento % elemento. Atomos = x 100% Peso de la fórmula del compuesto

Ejemplo: La fórmula molecular del peróxido de hidrógeno, (H 2 O 2), indica que en un mol de este compuesto hay 2 átomos de H y 2 átomos de O. Además, se sabe que. molar H 2 = 1, 008 g masa molar H 2 O 2 = 34, 02 masa g masa molar O 2 = 16, 00 g Entonces la composición porcentual se calcula como sigue 2 x (1, 008 g) %H = x 100% = 34, 02 g 5, 926% Sumando 2 x (16, 00 g) %O = x 100% = 94, 06% 34, 02 g Total 99, 99%

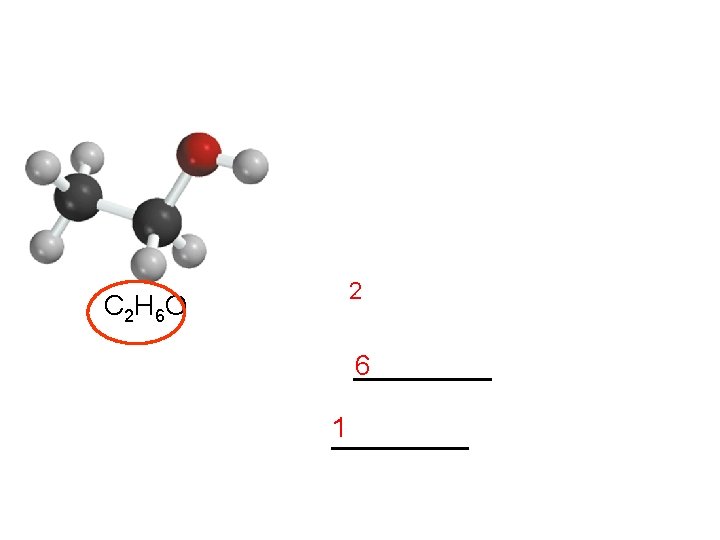
Otro ejemplo. El etanol es un compuesto presente en las bebidas alcohólicas De acuerdo a su fórmula su masa molar es 46, 07 g Entonces, C 2 H 6 O 2 x (12, 01 g) %C = x 100% = 52, 14% 46, 07 g (1, 008 g) %H =6 x 46, 07 x 100% = 13, 13% g 1 x (16. 00 g) %O = x 100% = 34, 73% 46. 07 g Total = 100%

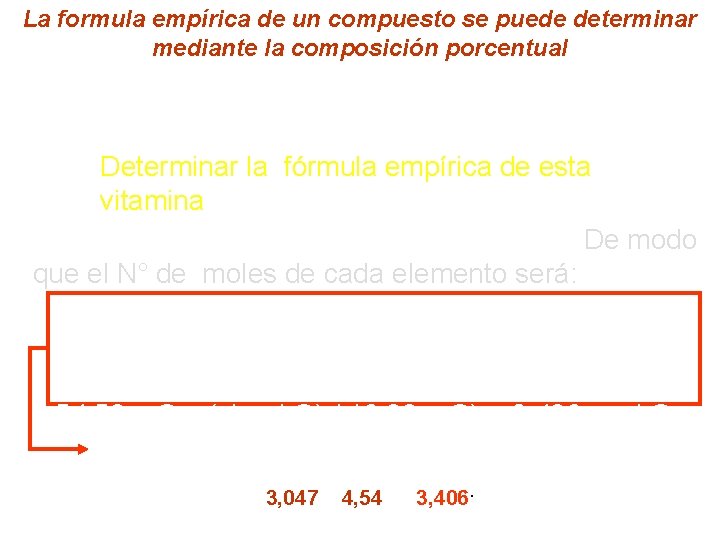
La formula empírica de un compuesto se puede determinar mediante la composición porcentual Ej. La composición porcentual del ácido ascórbico (vitamina C ) es de 40, 92 % de C y 4, 58% de H y 54, 50 % de O. Determinar la fórmula empírica de esta vitamina indica que en 100 g del ácido hay La información 40, 92 g de C; 4, 58 g de H y 54, 50 g de O. De modo que el N° de moles de cada elemento será: n de C = 40, 92 g C x (1 mol C / 12, 01 g C) = 3, 407 mol C n de H = 4, 58 g H x ( 1 mol H / 1, 008 g H) = 4, 54 mol H n de O = 54, 50 g O x ( 1 mol O) / 16, 00 g O) = 3, 406 mol O Con estos resultados se llega a la fórmula empíric C 3, 047 H 4, 54 O 3, 406.

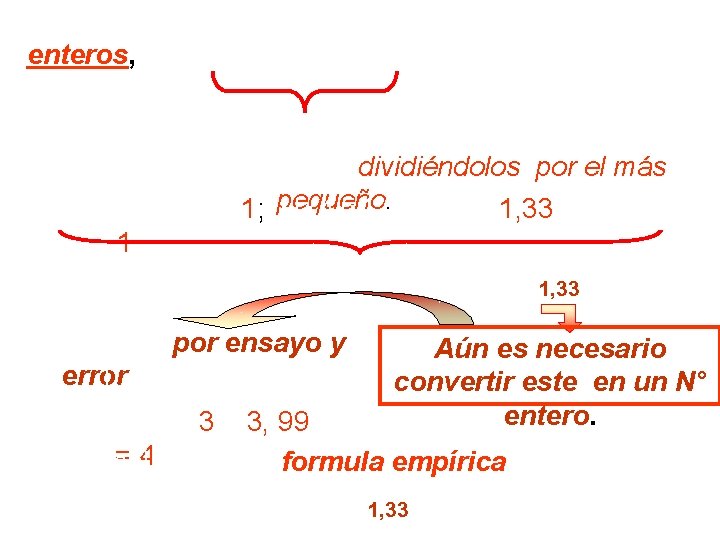
Como las formulas se escriben con números enteros, no es posible tener 3, 407; 4, 54 y 3, 406 átomos de C, H y O, respectivamente. Algunos de estos subíndices se pueden transformar en enteros dividiéndolos por el más Así, =1, 33 y O: (3, 406 C: (3, 407/ 3, 406) = 1; pequeño. H: (4, 54 / 3, 406) /3, 406 = 1 Con esto la fórmula empírica CH 1, 33 sería: O Se hace por ensayo y Aún es necesario error 1, 33 x 2 = 2, 66 convertir este en un N° entero. 1, 33 x 3 = 3, 99 =4 Así, finalmente la formula empírica es: (CH 1, 33 O) x 3 C 3 H 4 O 3

FIN
 Tomos trivia answers
Tomos trivia answers Tomos greco
Tomos greco Molculas
Molculas Como se forma un cation
Como se forma un cation Molculas
Molculas Dipolo
Dipolo Molculas
Molculas Iones
Iones Como se forma un cation
Como se forma un cation V quimica
V quimica Molculas
Molculas Los hidrocarburos son compuestos binarios formados por
Los hidrocarburos son compuestos binarios formados por Los hidrocarburos son compuestos binarios formados por:
Los hidrocarburos son compuestos binarios formados por: Fruto monocárpico seco y dehiscente
Fruto monocárpico seco y dehiscente Materiales compuestos aplicaciones
Materiales compuestos aplicaciones Son compuestos heterogéneos imprescindibles para la vida
Son compuestos heterogéneos imprescindibles para la vida Propiedades de los compuestos covalentes
Propiedades de los compuestos covalentes Clases de carbono
Clases de carbono Compuestos ionicos
Compuestos ionicos Compuestos ternarios acidos
Compuestos ternarios acidos Que son las palabras parasinteticas
Que son las palabras parasinteticas Sustancias
Sustancias Son compuestos heterogéneos imprescindibles para la vida
Son compuestos heterogéneos imprescindibles para la vida Sustancias puras elementos y compuestos
Sustancias puras elementos y compuestos ácido fluoroso
ácido fluoroso Conductores compuestos
Conductores compuestos Qué es el verbo
Qué es el verbo Los compuestos nitrogenados
Los compuestos nitrogenados Grupo funcional
Grupo funcional Sustantivo abstracto
Sustantivo abstracto Conclusion sobre los compuestos organicos e inorganicos
Conclusion sobre los compuestos organicos e inorganicos Entidad debil modelo relacional
Entidad debil modelo relacional Al2o3nomenclatura
Al2o3nomenclatura 2-metildecano
2-metildecano El enlace sigma
El enlace sigma Son compuestos heterogéneos imprescindibles para la vida
Son compuestos heterogéneos imprescindibles para la vida Materiales compuestos aplicaciones
Materiales compuestos aplicaciones Lista de atomos
Lista de atomos Nomenclatura de los hidruros
Nomenclatura de los hidruros Las formas verbales que no son compuestas se llaman formas
Las formas verbales que no son compuestas se llaman formas Propiedades generales de los compuestos orgánicos
Propiedades generales de los compuestos orgánicos Clases de vitaminas
Clases de vitaminas