COMPUESTOS TERNARIOS CIDOS Se forma de la reaccin











- Slides: 13

COMPUESTOS TERNARIOS ÁCIDOS • Se forma de la reacción de un óxido ácido con el agua • Combinación del agua con un anhídrido u óxido ácido Anhídrido + Agua → oxácido SO 3 + H 2 O → H 2 SO 4 Su fórmula general es: Hx. NMy. Oz

COMPUESTOS TERNARIOS ÁCIDOS • En el sistema tradicional se les nombra con las reglas generales para los anhídridos sustituyendo la palabra anhídrido por ácido (ya que de los anhídridos se originan). H 2 SO 4 ácido sulfúrico H 2 Cl. O 4 ácido perclórico H 2 SO 2 ácido hiposulfuroso

COMPUESTOS TERNARIOS ÁCIDOS • Para el sistema Stock se nombra al no metal con el sufijo –ato, luego el número de oxidación del no metal y por último se agrega “de hidrógeno”. H 2 SO 4 sulfato (VI) de hidrógeno H 2 Cl. O 4 clorato (VII) de hidrógeno H 2 SO 2 sulfato (II) de hidrógeno

COMPUESTOS TERNARIOS ÁCIDOS • El sistema estequiometrico se indica el número de átomos de oxígeno con el prefijo correspondiente seguido de la partícula “oxo” unida al nombre del no metal y el sufijo –ato, por último se agrega al nombre las palabras “de hidrógeno”. Compuesto Nomenclatura sistemática H 2 SO 4 tetraoxosulfato de hidrógeno H 2 Cl. O 4 ácido tetraoxoclórato de hidrógeno H 2 SO 2 ácido dioxosulfato de hidrógeno

Ejemplos de oxiácidos más comunes por grupos:

HALÓGENOS: números de oxidación: +1, +3, +5, +7. Dan oxiácidos con Cl, Br, I.

CALCÓGENOS: números de oxidación: +4, +6. Estudiaremos los oxiácidos de S, Se, Te.

NITROGENOIDES: números de oxidación: +3, +5. Estudiaremos los oxiácidos del N, P, As.

CROMO

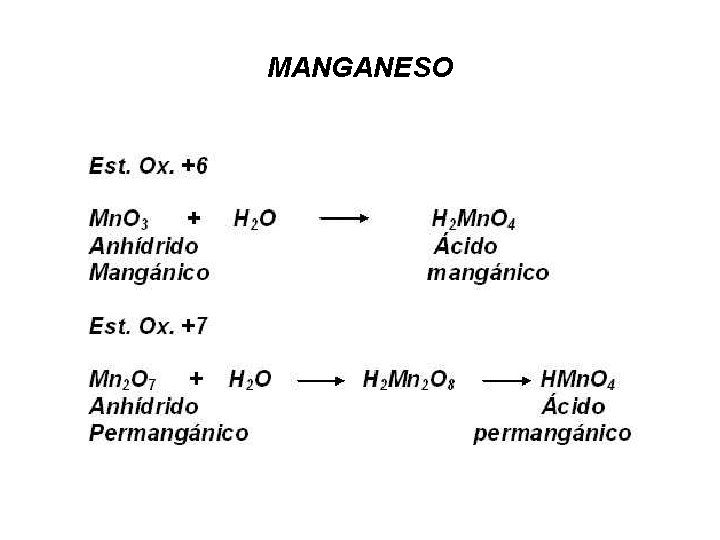
MANGANESO

a) Tioácidos: El prefijo tio delante del nombre de un ácido significa la sustitución de oxígeno por azufre. b) Peroxoácidos: El prefijo peroxo delante del nombre de un ácido significa la sustitución de un grupo - O - por el grupo - O - (peroxo). c) Diácidos: Proceden de la condensación de dos moléculas de ácido con pérdida de una molécula de agua.

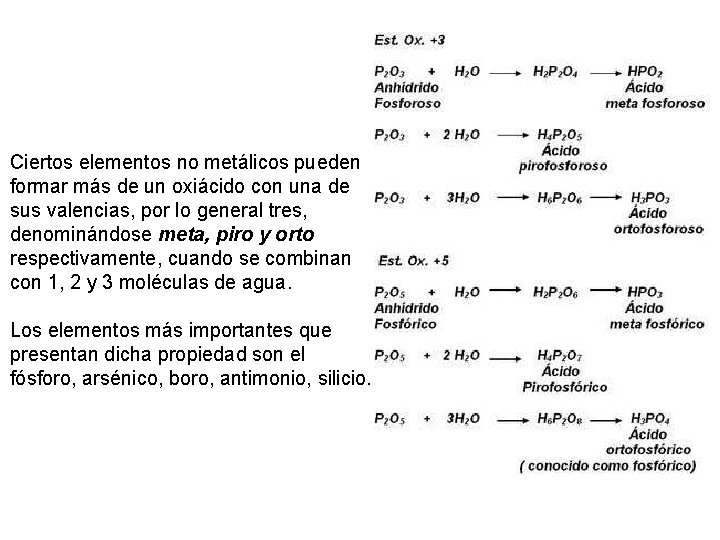
Ciertos elementos no metálicos pueden formar más de un oxiácido con una de sus valencias, por lo general tres, denominándose meta, piro y orto respectivamente, cuando se combinan con 1, 2 y 3 moléculas de agua. Los elementos más importantes que presentan dicha propiedad son el fósforo, arsénico, boro, antimonio, silicio.

EJERCICIOS • • • H Mn O 4 H 2 Cr 2 O 7 H 2 Mo O 4 H 2 W O 4 H 2 S O 3 H 2 C O 3 H Cl O 4 H N O 2
 Compuestos ternarios
Compuestos ternarios Clasificación de compuestos químicos
Clasificación de compuestos químicos Los hidrocarburos son compuestos ternarios
Los hidrocarburos son compuestos ternarios Compuestos binarios ternarios y cuaternarios
Compuestos binarios ternarios y cuaternarios Oxoacidos
Oxoacidos Los hidrocarburos son compuestos binarios
Los hidrocarburos son compuestos binarios Los hidrocarburos son compuestos binarios formados por
Los hidrocarburos son compuestos binarios formados por Dimetiñ
Dimetiñ Reaccin
Reaccin Reaccin
Reaccin Reaccin
Reaccin Vector physics problems and solutions
Vector physics problems and solutions Cidos psa
Cidos psa X cidos
X cidos






















