CALORIMETRIA DIAGRAMAS DE FASES DISCIPLINA FSICA TURMAS E













- Slides: 20

CALORIMETRIA – DIAGRAMAS DE FASES DISCIPLINA: FÍSICA TURMAS E DATAS: 2° A e 2° B PROFESSOR: EVERTON PAIXÃO

q ROTEIRO DE ESTUDOS Leia os itens abaixo com atenção: Ø Neste material você encontrará um planejamento para que tenhamos continuidade dos nossos estudos. Ø Nesta aula você encontrará um breve resumo do. Ø Aula correspondente às páginas 243 a 248 do material didático. Ø Para dúvidas ou o que eu puder auxiliá-lo, pode utilizar meu contato pessoal à vontade.

Ø O que vamos compreender?

Ø Assista a videoaula!!!


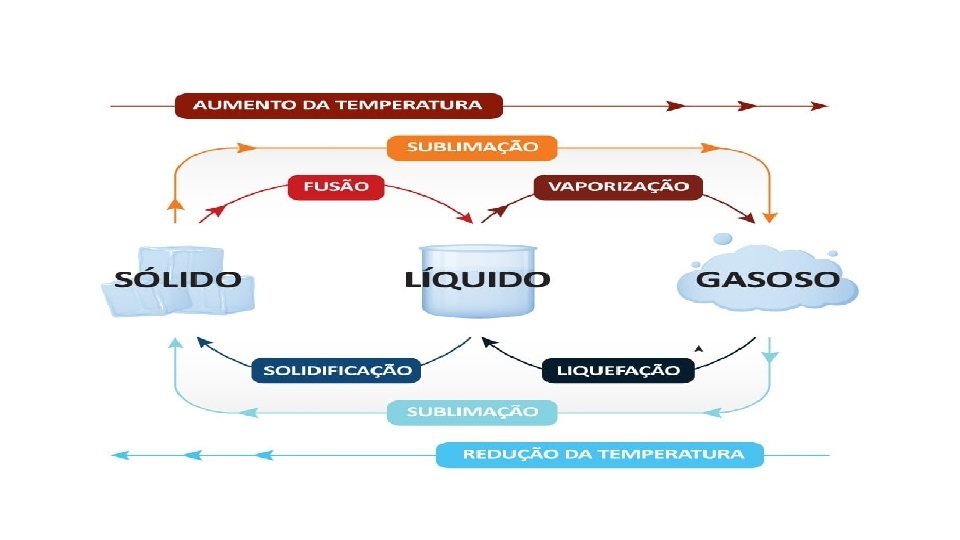
Ø DIAGRAMA DE FASES •

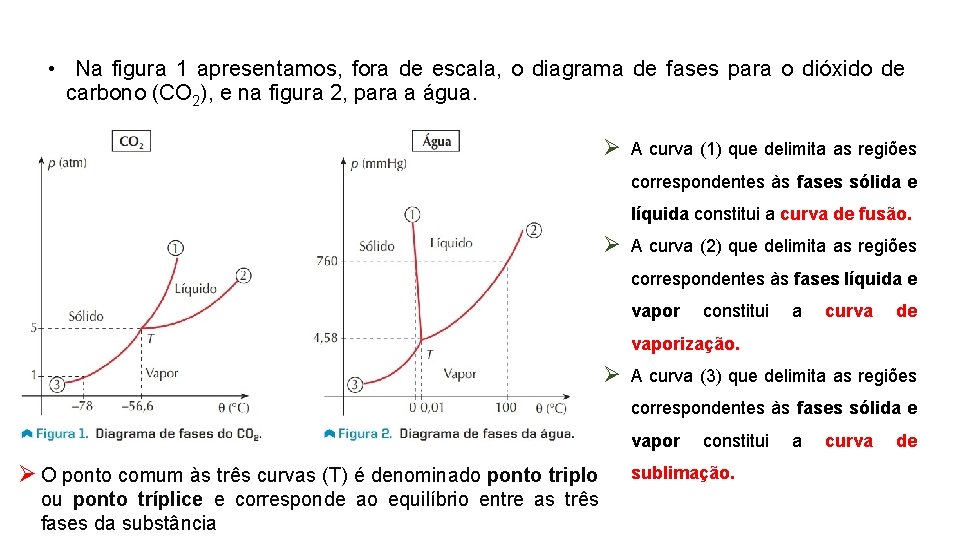
• Na figura 1 apresentamos, fora de escala, o diagrama de fases para o dióxido de carbono (CO 2), e na figura 2, para a água. Ø A curva (1) que delimita as regiões correspondentes às fases sólida e líquida constitui a curva de fusão. Ø A curva (2) que delimita as regiões correspondentes às fases líquida e vapor constitui a curva de vaporização. Ø A curva (3) que delimita as regiões correspondentes às fases sólida e vapor Ø O ponto comum às três curvas (T) é denominado ponto triplo ou ponto tríplice e corresponde ao equilíbrio entre as três fases da substância constitui sublimação. a curva de

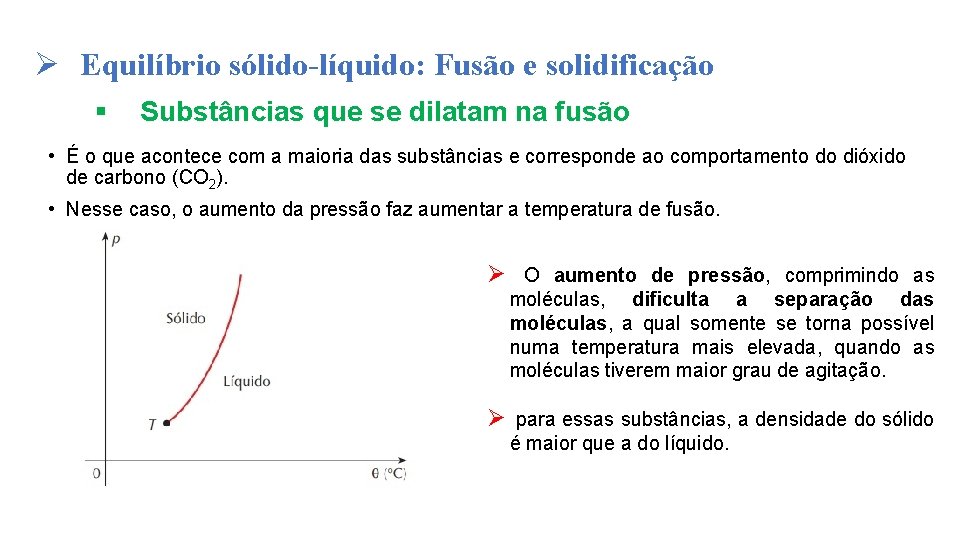
Ø Equilíbrio sólido-líquido: Fusão e solidificação § Substâncias que se dilatam na fusão • É o que acontece com a maioria das substâncias e corresponde ao comportamento do dióxido de carbono (CO 2). • Nesse caso, o aumento da pressão faz aumentar a temperatura de fusão. Ø O aumento de pressão, comprimindo as moléculas, dificulta a separação das moléculas, a qual somente se torna possível numa temperatura mais elevada, quando as moléculas tiverem maior grau de agitação. Ø para essas substâncias, a densidade do sólido é maior que a do líquido.

§ Substâncias que se contraem na fusão • Estão nesse caso, além da água, o bismuto, o ferro e o antimônio. • O aumento da pressão faz diminuir a temperatura de fusão dessas substâncias. • a compressão das moléculas favorece a tendência natural dessa mudança de fase, que é a diminuição de volume. • a fase sólida tem menor densidade que a fase líquida. Ø O gelo, sob pressão normal, funde-se a 0 °C. Sob pressões mais elevadas, sua temperatura de fusão se reduz. Por exemplo:

§ Experiência do Regelo • Se passarmos sobre um bloco de gelo, em temperatura pouco inferior a 0 °C, um fio fino de metal com pesos convenientemente colocados nas extremidades, o acréscimo de pressão no contato fio-gelo diminui a temperatura de fusão e produz derretimento do gelo sob o fio. • O fio se desloca através da água formada, a qual se congela ao voltar à pressão normal. Assim, o fio atravessa o gelo e este permanece íntegro. v Fenômeno também observado na patinação no gelo.

§ Avalanche

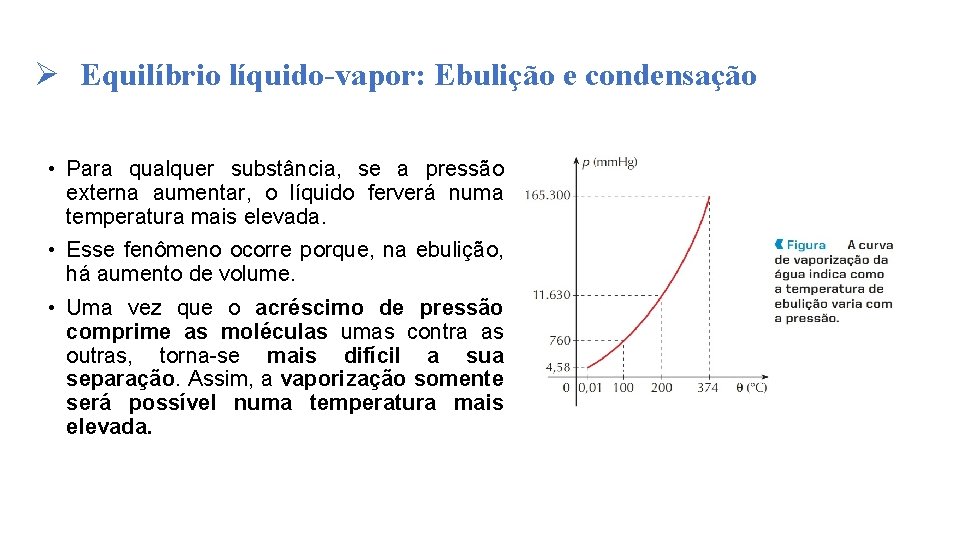
Ø Equilíbrio líquido-vapor: Ebulição e condensação • Para qualquer substância, se a pressão externa aumentar, o líquido ferverá numa temperatura mais elevada. • Esse fenômeno ocorre porque, na ebulição, há aumento de volume. • Uma vez que o acréscimo de pressão comprime as moléculas umas contra as outras, torna-se mais difícil a sua separação. Assim, a vaporização somente será possível numa temperatura mais elevada.

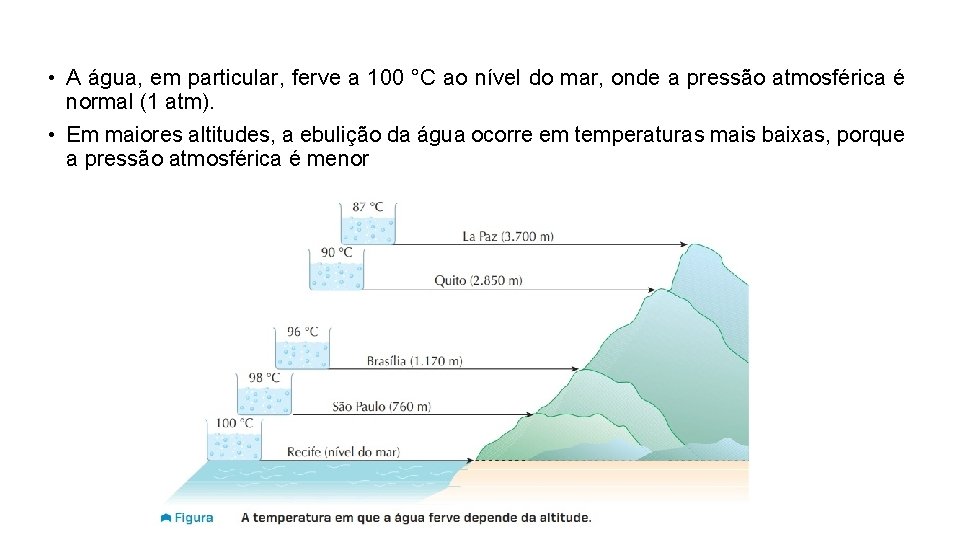
• A água, em particular, ferve a 100 °C ao nível do mar, onde a pressão atmosférica é normal (1 atm). • Em maiores altitudes, a ebulição da água ocorre em temperaturas mais baixas, porque a pressão atmosférica é menor

• No interior de uma panela de pressão, a água está sujeita a uma pressão maior que uma atmosfera (1 atm). • Com isso, ferve a uma temperatura superior a 100 °C. Em consequência, os alimentos cozinham em menos tempo.

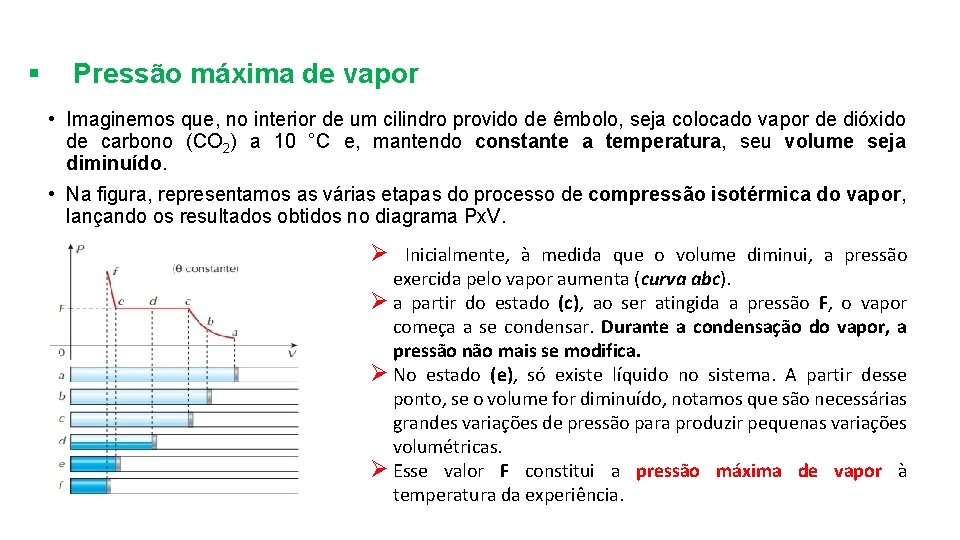
§ Pressão máxima de vapor • Imaginemos que, no interior de um cilindro provido de êmbolo, seja colocado vapor de dióxido de carbono (CO 2) a 10 °C e, mantendo constante a temperatura, seu volume seja diminuído. • Na figura, representamos as várias etapas do processo de compressão isotérmica do vapor, lançando os resultados obtidos no diagrama Px. V. Ø Inicialmente, à medida que o volume diminui, a pressão exercida pelo vapor aumenta (curva abc). Ø a partir do estado (c), ao ser atingida a pressão F, o vapor começa a se condensar. Durante a condensação do vapor, a pressão não mais se modifica. Ø No estado (e), só existe líquido no sistema. A partir desse ponto, se o volume for diminuído, notamos que são necessárias grandes variações de pressão para produzir pequenas variações volumétricas. Ø Esse valor F constitui a pressão máxima de vapor à temperatura da experiência.



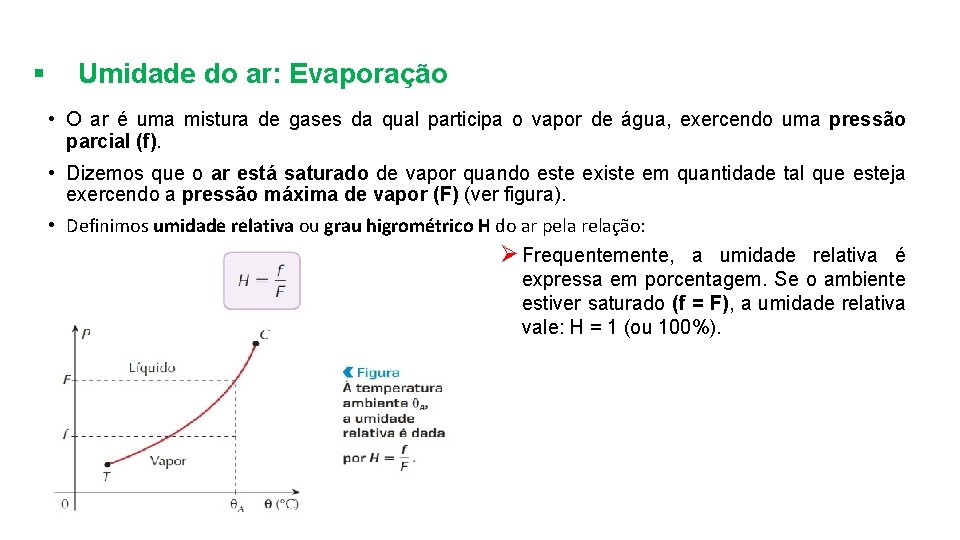
§ Umidade do ar: Evaporação • O ar é uma mistura de gases da qual participa o vapor de água, exercendo uma pressão parcial (f). • Dizemos que o ar está saturado de vapor quando este existe em quantidade tal que esteja exercendo a pressão máxima de vapor (F) (ver figura). • Definimos umidade relativa ou grau higrométrico H do ar pela relação: Ø Frequentemente, a umidade relativa é expressa em porcentagem. Se o ambiente estiver saturado (f = F), a umidade relativa vale: H = 1 (ou 100%).

EVAPORAÇÃO Ao contrário do que ocorre com a ebulição, não existe uma temperatura bem determinada para que a evaporação ocorra. A evaporação ocorre apenas na superfície do líquido e é um processo lento. Ø A rapidez de como ocorre a evaporação depende de alguns fatores: • • • Natureza do líquido: existem líquidos que evaporam mais facilmente que outros. Líquidos com tais facilidades de evaporação são chamados de voláteis. Ex. : o álcool evapora mais rápido que a água. Temperatura: o aumento da temperatura pode favorecer a evaporação. Ex. : a água evapora mais facilmente em 40 °C do que em 10 °C. Área de superfície: como a evaporação ocorre apenas na superfície do líquido, ela será facilitada se a área da superfície for maior. Ex. : o álcool evapora mais rapidamente espalhado em uma mesa do que dentro de um recipiente. Pressão de superfície: como a pressão externa dificulta o escape das partículas da superfície de um líquido, aumentando-se a pressão, dificulta-se a evaporação. Pressão de vapor do líquido: a quantidade de partículas no estado gasoso em torno da superfície do líquido também interfere na taxa de evaporação.

Ø Equilíbrio sólido-vapor: Sublimação •
 Quantas prendas faltam para a turma 401 empatar com a 402
Quantas prendas faltam para a turma 401 empatar com a 402 Agrupamento de escolas do cadaval turmas
Agrupamento de escolas do cadaval turmas Fsica
Fsica Fsica
Fsica Fsica
Fsica Lógica
Lógica Fsica
Fsica Vetores fisica
Vetores fisica Electrizacion
Electrizacion Produto escalar
Produto escalar Fsica
Fsica Se define como
Se define como Vector unitario formula
Vector unitario formula Formula aceleracion centripeta
Formula aceleracion centripeta Vertical
Vertical Sistema termodinamico
Sistema termodinamico Fsica
Fsica Fsica
Fsica Movimento retardado e acelerado
Movimento retardado e acelerado Fsica
Fsica Division de la fisica clasica
Division de la fisica clasica