APOPTOSIS Apoptosis N de citacionesao med line Mientras











































- Slides: 56

APOPTOSIS

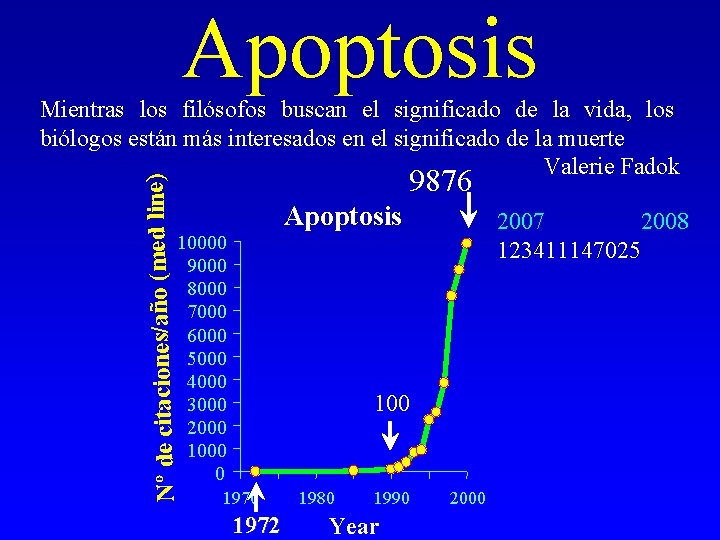
Apoptosis Nº de citaciones/año (med line) Mientras los filósofos buscan el significado de la vida, los biólogos están más interesados en el significado de la muerte Valerie Fadok 9876 Apoptosis 10000 9000 8000 7000 6000 5000 4000 3000 2000 1000 0 2007 2008 123411147025 100 1972 1980 1990 Year 2000

Apoptosis fisiológica Defecto Autoinmunidad Cáncer Exceso SIDA Alzheimer

ÍNDICE 1. Fases y características de la apoptosis 2. Apoptosis y filogenia 2. 1. Caenorhabditis elegans 2. 2. Drosophila melanogaster 2. 3. Apoptosis en vertebrados 3. La maquinaria de la muerte celular en humanos 3. 1. Caspasas 3. 2. Sustratos de caspasas 3. 3. Inhibidores de caspasas 3. 4. Vías de inducción de apoptosis 3. 4. 1. Vía extrínseca o de los receptores de muerte 3. 4. 2. Vía intrínseca o mitocondrial

1) FASES Y CARACTERÍSTICAS DE LA APOPTOSIS

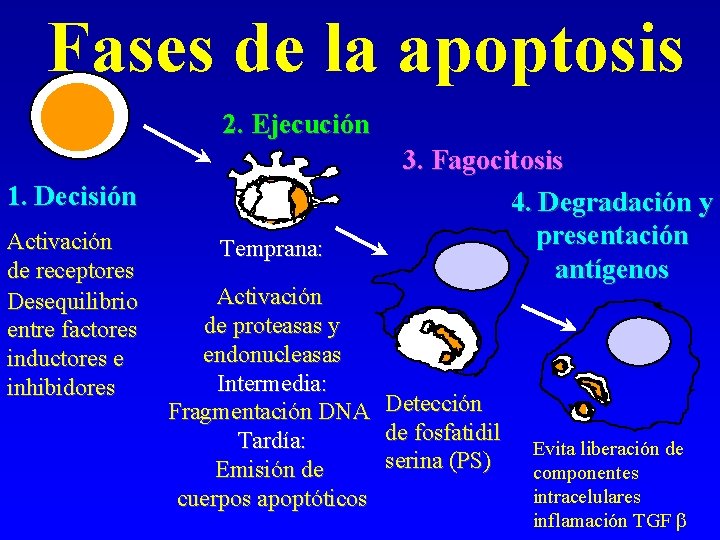
Fases de la apoptosis 2. Ejecución 1. Decisión Activación de receptores Desequilibrio entre factores inductores e inhibidores Temprana: Activación de proteasas y endonucleasas Intermedia: Fragmentación DNA Tardía: Emisión de cuerpos apoptóticos 3. Fagocitosis 4. Degradación y presentación antígenos Detección de fosfatidil serina (PS) Evita liberación de componentes intracelulares inflamación TGF b

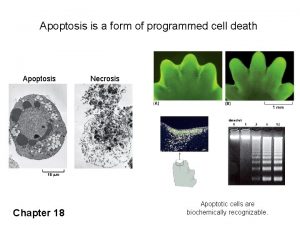
Diferencias entre apoptosis y necrosis. Mecanismo Necrosis (Oncosis) Apoptosis Programada genéticamente Accidental. Tamaño celular Disminuye aumenta Membrana. Se mantiene Se rompe Orgánulos. Se preservan Se desintegran Temprana tardía Fragmentación del DNA Fragmentación celular Restos celulares fragmentos oligonucleosomales fragmentos grandes En cuerpos apoptóticos Los contenidos. rodeados por membrana de los orgánulos se liberan Son reconocidos y fagocitados Inducen inflamación local.

CARACTERÍSTICAS DE LA APOPTOSIS

Consecuencias de la apoptosis La célula se fragmenta en cuerpos apoptóticos con PS en la cara exterior de su membrana Las células fagocíticas: • Reconocen PS y fagocitan los cuerpos apoptóticos • Al fagocitarlos producen mediadores antiinflamatorios

Consecuencias de la apoptosis 1. Se impide la liberación de los contenidos celulares al espacio extracelular 2. Permite muerte celular sin inflamación 3. La apoptosis permite la muerte celular sin provocar daño a las células adyacentes

2) APOPTOSIS Y FILOGENIA

2. Apoptosis y filogenia 2. 1. Caenorhabditis elegans 2. 2. Drosophila melanogaster 2. 3. Vertebrados

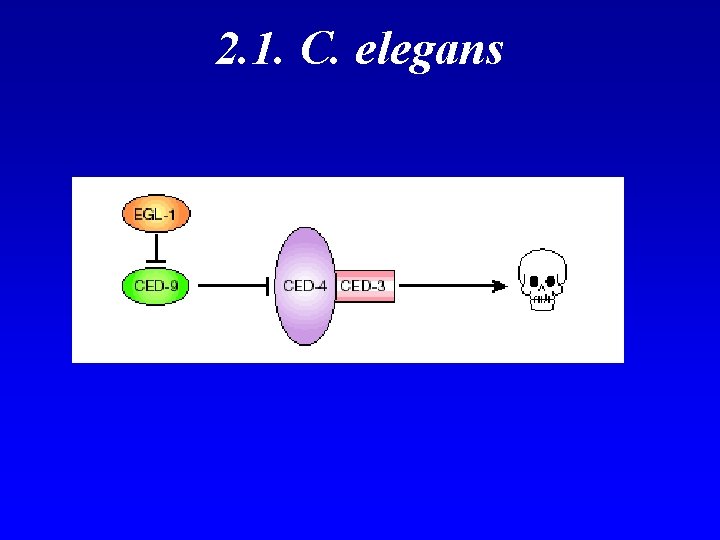
2. 1. C. elegans - Primera evidencia de una base genética de la apoptosis. - Desarrollo invariante y lineal. - Durante la ontogenia de un gusano adulto hermafrodita, 131 céls de la 1090 céls somáticas mueren por apoptosis (959 céls). - Análisis genético que determinó genes específicos para la regulación de la apoptosis: - egl-1 - ced-3 - ced-4 - ced-9

2. 1. C. elegans A) Mutaciones con pérdida de función en egl-1, ced-3 o ced-4 provocan la supervivencia de las 131 céls: genes inductores de apoptosis. B) Gen supresor de apoptosis, ced-9 - Mutantes carentes de ced-9: muerte durante el desarrollo por muerte masiva de céls - Ganancia de función: supervivencia de la 131 céls.

2. 1. C. elegans La maquinaria básica de muerte celular está altamente conservada en la evolución de los metazoos - ced-3 es una cistein proteasa con dominios de interacción q forman una estruc. parecida al apoptosoma: caspasa iniciadora - ced-4 es una proteína adaptadora q desencadenaría la activación de ced-3 si no estuviera unida a ced-9. - ced-9 es supresora de muerte celular y homóloga a Bcl-2. - egl-1 desplaza a ced-9 de ced-4.

2. 1. C. elegans

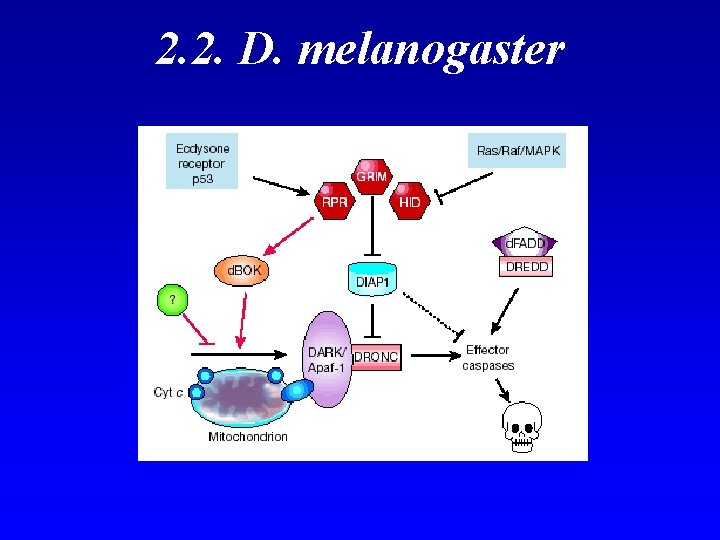
2. 2. D. melanogaster Similitudes con C. elegans: - Caspasas - Adaptadores - Supresores Aparecen: - p 53 - IAPs - Mitocondria

2. 2. D. melanogaster

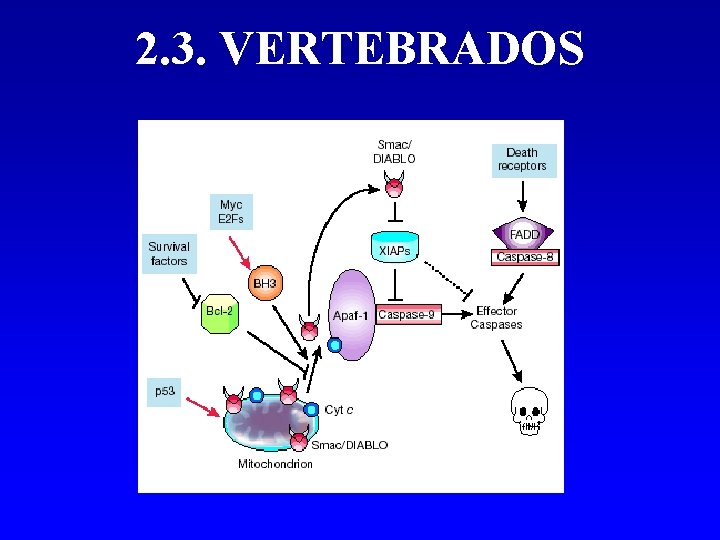
2. 3. VERTEBRADOS 1. Tanto en C. elegans como en D. melanogaster el desarrollo está restricto a la vida temprana o a la metamorfosis. 2. En vertebrados la morfogénesis, el remodelado y la regeneración se produce abundantemente en muchos tejidos a lo largo de toda la vida. 3. La maquinaria apoptótica es homóloga a invertebrados aunque más elaborada y degenerada.

2. 3. VERTEBRADOS En mamíferos aparece: 1. Familia de receptores de muerte cuyo reconocimiento desencadena activación de caspasas y muerte. 2. Daños pro-apoptóticos impactan directamente en la mitocondria y liberan péptidos pro-apoptóticos: - Holocitocromo c - Smac/DIABLO que antagoniza la actividad antiapoptótica de XIAP.

2. 3. VERTEBRADOS

3) MAQUINARIA DE LA MUERTE CELULAR EN HUMANOS

3. Maquinaria de la muerte celular en humanos 3. 1. Caspasas 3. 2. Sustratos de caspasas 3. 3. Inhibidores de caspasas 3. 4. Vías de inducción de apoptosis 3. 4. 1. Vía extrínseca 3. 4. 2. Vía intrínseca

3. 1. CASPASAS

CASPASAS - Son cistein proteasas específicas de aspartato (caspase) - Se expresan como proenzimas (zimógenos) - Presentan 3 dominios: 1. Prodominio terminal 2. Subunidad larga (p 20) que contiene el centro activo 3. C-terminal que es la subunidad pequeña (p 10) Asp Prodominio terminal Subunidad larga (p 20) Asp Subunidad pequeña (p 10)

ACTIVACIÓN DE CASPASAS Asp Caspasa activa Caspasa iniciadora

MECANISMOS DE ACTIVACIÓN DE CASPASAS 1. Activación por otra caspasa 2. Activación inducida por proximidad 3. Asociación con una subunidad reguladora

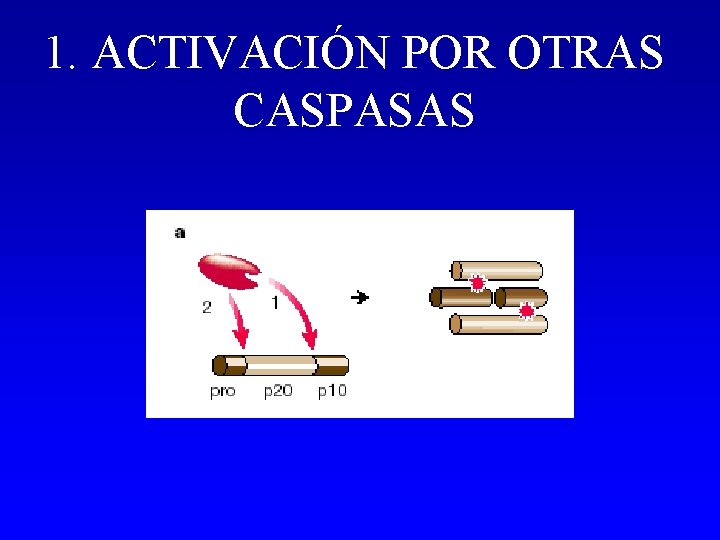
1. ACTIVACIÓN POR OTRAS CASPASAS - Activación de una caspasa por otra previamente activada: cascada de caspasas - Caspasas con prodominio corto: Caspasas efectoras - Caspasas – 3, -6, -7. - Amplificación e integración de señales

1. ACTIVACIÓN POR OTRAS CASPASAS

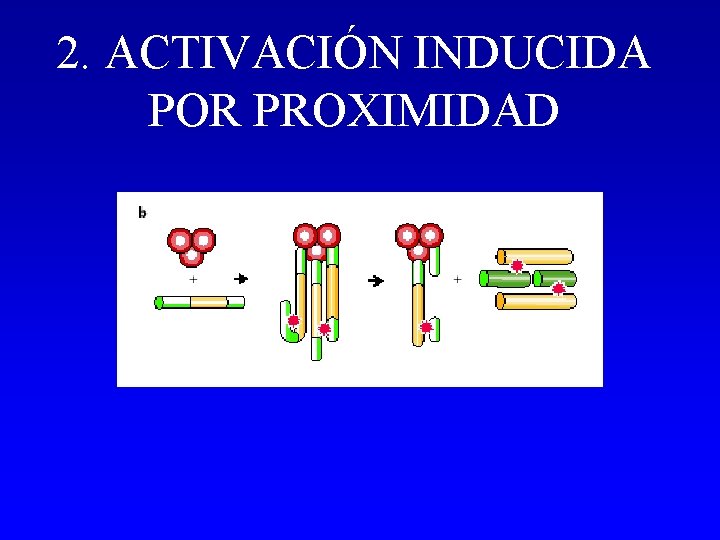
2. ACTIVACIÓN INDUCIDA POR PROXIMIDAD - Activación de una caspasa por proximidad: Trimerización de receptores que reclutan caspasas y se procesan mutuamente. - Caspasas con prodominio largo: Caspasas iniciadoras. - Caspasa -8. - Implicada en vía extrínseca (CD 95).

2. ACTIVACIÓN INDUCIDA POR PROXIMIDAD

3. ASOCIACIÓN CON UNA SUBUNIDAD REGULADORA - Activación de una caspasa a través de un cofactor. - No se activa por proteolisis sino por cambio conformacional. - Caspasas con prodominio largo: Caspasas iniciadoras. - Caspasa -9. Cofactor: Apaf-1. Citocromo c. - Implicada en vía intrínseca o mitocondrial.

3. ASOCIACIÓN CON UNA SUBUNIDAD REGULADORA Apoptosoma

CASPASAS - Las caspasas efectoras se activan proteolíticamente por otras caspasas - Las caspasas iniciadoras son activadas mediante interacciones reguladas proteína-proteína.

3. 2. SUSTRATOS DE CASPASAS

SUSTRATOS DE CASPASAS - La caspasa-3 es la última responsable de los efectos apoptóticos junto con las caspasas -6 y – 7. - Estas 3 caspasas ejecutoras causan el fenotipo apoptótico: 1) Fragmentación de DNA 2) Alteraciones de la membrana plasmática 3) Translocación PS

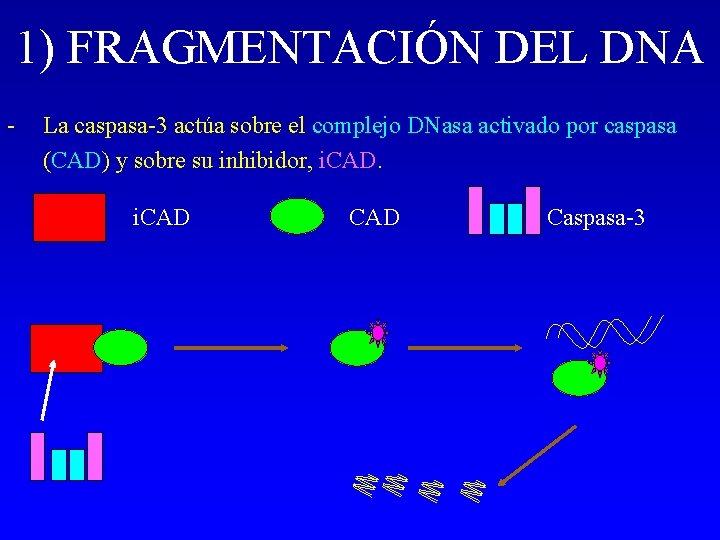
1) FRAGMENTACIÓN DEL DNA - La caspasa-3 actúa sobre el complejo DNasa activado por caspasa (CAD) y sobre su inhibidor, i. CAD Caspasa-3

2) ALTERACIONES DE LA MEMBRANA PLASMÁTICA - La caspasa-3 actúa sobre: - - La gelsolina La fodrina Se disocia de membrana plasmática del citoesqueleto - Formación de vesículas Plegamiento de la membrana plasmática

3. 3. INHIBIDORES DE CASPASAS

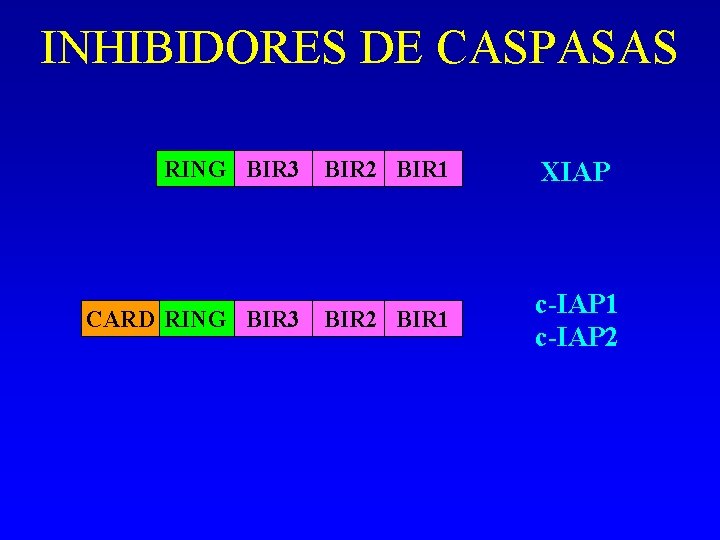
INHIBIDORES DE CASPASAS - Proteínas inhibidoras de apoptosis (IAP). - Se identificaron en baculovirus. Hay al menos 5 en mamíferos: - X-linked inhibitor of apoptosis (XIAP) c-IAP 1 c-IAP 2 IAP neuronal Survivina Todos inhiben caspasa – 3 y – 7 activa y procaspasa-9.

INHIBIDORES DE CASPASAS Frenan la apoptosis por inhibición, unión y degradación: 1. Dominio repetido IAP de baculovirus (BIR) por el q el IAP se une e inhibe a las caspasas. Entre 1 -4 dominios BIR. 2. Dominio RING q actúa como una ligasa de ubiquitina: degradación del IAP y de cualquier caspasa unida a él. 3. Dominio CARD: regulación directa o indirecta del procesamiento de las caspasas. c-IAP 1 y c-IAP 2

INHIBIDORES DE CASPASAS RING BIR 3 BIR 2 BIR 1 CARD RING BIR 3 BIR 2 BIR 1 XIAP c-IAP 1 c-IAP 2

3. 4) VÍAS DE INDUCCIÓN DE APOPTOSIS

3. 4) VÍAS DE INDUCCIÓN DE APOPTOSIS Existen dos vías de inducción de apoptosis: 3. 4. 1. Vía extrínseca o vía de los receptores de muerte 3. 4. 2. Vía intrínseca o vía de la mitocondria

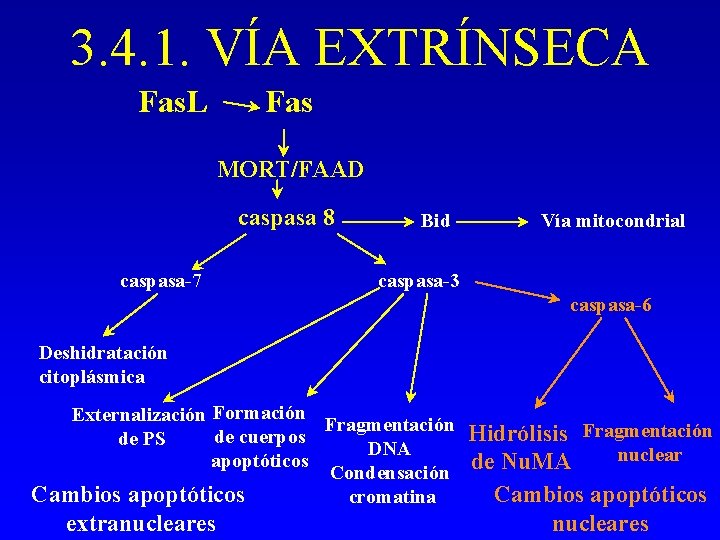
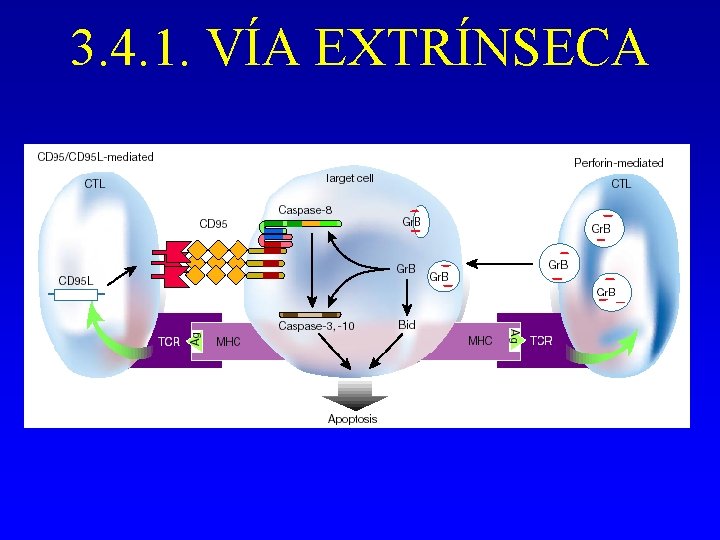
3. 4. 1. VÍA EXTRÍNSECA - A través de receptores superficiales: receptores de muerte. Receptores de la familia de TNFR: CD 95, TNFR 1, TNFR 2. Tb DR 3, TRAIL. . . - Requiere trimerización para la transducción de la señal. - Al receptor activado se le asocia un complejo de proteínas: dominio de señalización inductor de muerte (DISC, deathinduced signalling domain)

DISC 1. El adaptador FADD se une a través de su dominio de muerte (DD) al dominio de muerte del receptor activado 2. FADD contiene un dominio efector de muerte (DED) que por homología atrae procaspasa-8 o FLICE que se activa. 3. Inhibición debida a proteínas con dos dominios DED: proteína inhibidora de FLICE (FLIP, FLICE-inhibitory protein).

CD 95 L CD 95 DD Procaspasa-8 DED FADD c-FLIP Caspasa-8 Bid Caspasa-3 DISC

3. 4. 1. VÍA EXTRÍNSECA Fas. L Fas MORT/FAAD caspasa 8 caspasa-7 Bid Vía mitocondrial caspasa-3 caspasa-6 Deshidratación citoplásmica Externalización Formación Fragmentación de cuerpos de PS DNA apoptóticos Condensación Cambios apoptóticos cromatina extranucleares Hidrólisis Fragmentación nuclear de Nu. MA Cambios apoptóticos nucleares

3. 4. 1. VÍA EXTRÍNSECA

3. 4. 2. VÍA INTRÍNSECA - La regulación de la apoptosis en esta vía es debida a la familia de Bcl-2. - Bcl-2 fue descubierto como un proto-oncogén en el linfoma folicular de células B y es homólogo a ced-9. - Existen 19 miembros que se dividen en tres grupos. - Cada miembro posee al menos uno de los cuatro motivos conservados denominados dominios de homología con Bcl-2 (BH): BH 1 -BH 4.

FAMILIA DE Bcl-2 1. Grupo I: - Actividad anti-apoptótica - Bcl-2, Bcl-XL, Bcl-w. . . - 4 motivos BH: BH 1 -BH 4 - Cola hidrofóbica en el C-terminal 2. Grupo II: - Actividad pro-apoptótica - Bax, Bak, Bok. . . - Carecen de BH 4 3. Grupo III: - Actividad pro-apoptótica - Bid, Bik, Bad, Bim. . . - Sólo poseen el dominio BH 3 - Pueden o no tener región transmembrana

CONTROL DE LA APOPTOSIS POR LA FAMILIA DE Bcl-2 - Los miembros de la familia de Bcl-2 intentan bloquear el siguiente movimiento de otro. - Algunos homodimerizan - Se forman heterodímeros de miembros pro y anti-apoptóticos neutralizándose Gradiente pro-apoptóticos Gradiente Anti-apoptóticos

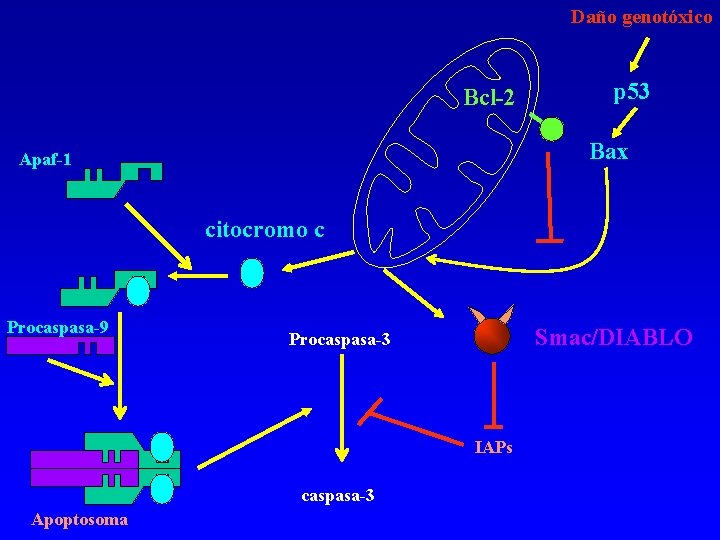
MITOCONDRIA: CENTRO DE LA MUERTE CELULAR La mitocondria no es sólo la central productora de energía de la célula, también es un arsenal pues secuestra un potente combinado de proteínas pro-apoptóticas: 1. Citocromo c: Componente junto con Apaf-1 y caspasa 9 del apoptosoma 2. Smac/DIABLO (second mitochondria-derived activator of caspases/direct IAP-binding protein with low p. I): es una proteína que inhibe IAPs secuestrándolas.

Daño genotóxico Bcl-2 p 53 Bax Apaf-1 citocromo c Procaspasa-9 Smac/DIABLO Procaspasa-3 IAPs caspasa-3 Apoptosoma

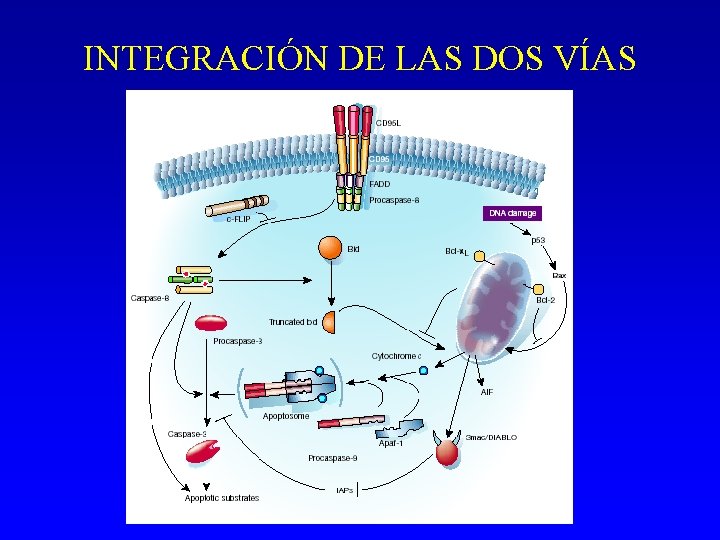
INTEGRACIÓN DE LAS DOS VÍAS

APOPTOSIS - Características definidas - Regulada genéticamente - Conservada en la evolución - Muy regulada: patologías - Inducida por señales externas e internas
 Ihfanın tanımı
Ihfanın tanımı Definition of apoptosis
Definition of apoptosis Harrisons sulci
Harrisons sulci Via intrinseca de la apoptosis
Via intrinseca de la apoptosis Apoptosis meaning
Apoptosis meaning Emphysema
Emphysema Apoptosis definition biology
Apoptosis definition biology Apoptosis greek meaning
Apoptosis greek meaning Apoptosis defination
Apoptosis defination Apoptosis
Apoptosis Apoptosis and necrosis
Apoptosis and necrosis Apoptosis assay
Apoptosis assay Apoptosis
Apoptosis Caracteristicas de la apoptosis
Caracteristicas de la apoptosis Apoptosis adalah
Apoptosis adalah Fadd apoptosis
Fadd apoptosis Apoptosis flow chart
Apoptosis flow chart Meiosis fases
Meiosis fases 2110004
2110004 5 ejemplos de cacofonía
5 ejemplos de cacofonía Que es poesia me preguntas mientras clavas tu pupila
Que es poesia me preguntas mientras clavas tu pupila Isaías 55 6
Isaías 55 6 Algoritmo repetitivo ejemplos
Algoritmo repetitivo ejemplos Mientras cenaban jesus tomo
Mientras cenaban jesus tomo Buscad al señor mientras
Buscad al señor mientras Que cosa es que mientras mas grande menos se ve
Que cosa es que mientras mas grande menos se ve Figuras literarias del poema anoche cuando dormia
Figuras literarias del poema anoche cuando dormia Que dia dios creo a la mujer
Que dia dios creo a la mujer Mientras mas ruido hace la carreta mas vacia esta
Mientras mas ruido hace la carreta mas vacia esta El hombre promete mientras lo mete
El hombre promete mientras lo mete A su retrato soneto
A su retrato soneto Preterite or imperfect
Preterite or imperfect Conversamos todo el tiempo mientras ellos se marchaban.
Conversamos todo el tiempo mientras ellos se marchaban. Sigues haciendo lo mismo
Sigues haciendo lo mismo Mientras imperfect or preterite
Mientras imperfect or preterite Un collar se rompió mientras jugaban dos enamorados
Un collar se rompió mientras jugaban dos enamorados Si no vas a cumplir no prometas
Si no vas a cumplir no prometas 1. mis hermanos ____ conducir, pero yo no ____.
1. mis hermanos ____ conducir, pero yo no ____. Ulysses tennyson theme
Ulysses tennyson theme The daffodils poem شرح
The daffodils poem شرح Thou blind man's mark poetic devices
Thou blind man's mark poetic devices Sonnet poem 14 lines
Sonnet poem 14 lines Shah jahan poem by rabindranath tagore
Shah jahan poem by rabindranath tagore Sonnet 60 by shakespeare
Sonnet 60 by shakespeare Unconventional sonnet
Unconventional sonnet Being your slave what should i do
Being your slave what should i do Rhyme scheme of sonnet 130
Rhyme scheme of sonnet 130 Word line bit line
Word line bit line Prolouge romeo and juliet
Prolouge romeo and juliet Farewell love and all thy laws forever summary
Farewell love and all thy laws forever summary Thunderstorm poem
Thunderstorm poem Burning of the books poem summary
Burning of the books poem summary Simile in nothing gold can stay
Simile in nothing gold can stay What is the theme of the poem money madness
What is the theme of the poem money madness Special roadway markings
Special roadway markings Apostrophe to the ocean stanza analysis
Apostrophe to the ocean stanza analysis Poetic devices in thou blind man's mark
Poetic devices in thou blind man's mark