Zwizki metaloorganiczne odczynniki Grignarda v Zwizki metaloorganiczne wiadomoci

















- Slides: 22

Związki metaloorganiczne, odczynniki Grignarda v Ø Ø Ø Ø Ø Związki metaloorganiczne – wiadomości wstępne struktura i nazewnictwo, właściwości i otrzymywanie, Związki magnezoorganiczne reakcje zw. R-Mg-X z cząsteczkami zwierającymi aktywny atom wodoru, reakcje addycji R-Mg-X do grup karbonylowych, reakcje addycji zw. R-Mg-X do wiązań podwójnych między atomami węgla, reakcje addycji zw. R-Mg-X do grupy nitrylowej, reakcje addycji zw. R-Mg-X do tlenku siarki(IV)

Związki metaloorganiczne – wiadomości wstępne v Związki metaloorganiczne – substancje, których cząsteczki zawierają wiązanie węgiel – metal. v Trwałe związki metaloorganiczne tworzą pierwiastki metaliczne: Li, Na, K, Mg, Ca, Al, Sn, Pb, Cd, Fe, Ni, Cr, Hg. v Charakter chemiczny wiązania węgiel – metal zmienia się w dużym zakresie: od kowalencyjnego do jonowego: Ø kowalencyjne (C 2 H 5)4 Pb ɵ � Ø jonowe (CH ≡ C Na ) Ø polaryzacja wiązania wzrasta wraz ze wzrostem elektrododatności (spadkiem elektroujemności) metalu.

Struktura i nazewnictwo v Nazwy prostych związków metaloorganicznych – alkilometali lub arylometali tworzy się przez połącznie łącznikiem „o” nazwy reszty węglowodorowej z nazwą metalu: Ø CH 3 Na – metylosód, Ø CH 2 = CHLi – winylolit, Ø (CH 3)2 Ca – dimetylowapań, Ø (CH 3 – CH 2)2 Mg – dietylomagnez, Ø CH 3 – CH 2 Mg. Cl – chlorek etylomagnezu, Ø C 6 H 5 – Hg. Cl – chlorek fenylortęci v W przypadku połączenia metali z alkenami lub arenami wiązania węgiel – metal powstają przez zajęcie orbitalu d metalu przez elektrony wiązania π lub elektrony sekstetu elektronowego pierścienia aromatycznego.

Właściwości i otrzymywanie v Reaktywność związków metaloorganicznych wzrasta wraz ze wzrostem polaryzacji wiązania węgiel – metal: Ø związki typu alkilosód czy alkilopotas zapalają się w kontakcie z powietrzem, gwałtownie reagują z wodą, tlenkiem węgla(IV), Ø związki metaloorganiczne o słabo spolaryzowanych wiązaniach węgiel – metal ( tetraalkiloołów, dialkilortęć) są stosunkowo trwałe na powietrzu. v Otrzymywanie związków metaloorganicznych: Ø reakcja metali z halogenowęglowodorami (dla metali mało aktywnych stosuje się ich stopy z sodem) ü CH 3 – CH 2 – Br + 2 Li CH 3 – CH 2 Li + Li. Br ü 2 CH 3 -CH 2 – I + 2 Hg. Na (CH 3 -CH 2)2 Hg + Na. I + Hg

Właściwości i otrzymywanie v Otrzymywanie związków metaloorganicznych – cd. : ü 4 CH 3 -CH 2 -Cl + 4 Pb. Na (CH 3 -CH 2)4 Pb + 4 Na. Cl + 3 Pb Ø reakcja wymiany metalu mniej elektrododatniego w związku metaloorganicznym przez metal bardziej elektrododatni: ü (CH 3 -CH 2)2 Hg + 2 Na 2 CH 3 – CH 2 Na + Hg Ø tetraetyloołów był stosowany do produkcji etyliny w celu podwyższania liczby oktanowej benzyny, Ø chlorek etylortęci – składnik Ceresanu był stosowany w ochronie roślin do odkażania gleby i podłoży, zaprawiania nasion przeciw chorobom grzybowym, silnie toksyczny dla zwierząt, Ø ze względu na obecność ciężkich metali Pb i Hg stosowane są sporadycznie w krajach UE.

Właściwości i otrzymywanie II v Właściwości chemiczne: Ø reakcja z tlenkiem węgla(IV) powstają kwasy sole kwasów karboksylowych, które można z soli wyprzeć mocniejszym kwasem nieorganicznym O ü CH 3 – CH 2 Na + O = C = O CH 3 – CH 2 – C Iɵ � O Na ü CH 3 -CH 2 -COONa + HCl CH 3 -CH 2 -COOH + Na. Cl Ø reakcja z grupą karbonylową powstają alkoholany, które ulegają hydrolizie anionowej i powstają alkohole ɵ � O Na | ü CH 3 -CHO + CH 3 -CH 2 Na CH 3 -CH-CH 2 -CH 3 ɵ � O Na OH | | üCH 3 -CH-CH 2 -CH 3 + H 2 O CH 3 -CH-CH 2 -CH 3 + Na. OH

Związki magnezoorganiczne v W syntezach organicznych stosuje się najczęściej halogenki magnezoorganiczne – odczynnik / związek Grignarda, który otrzymuje się w reakcji roztworów halogenowęglowodorów w bezwodnym eterze z wiórkami magnezu: eter Ø R – X + Mg R – Mg. X ; Ar – X + Mg Ar – Mg. X (X: Cl, Br, I) Ø w rzeczywistości powstają kompleksy dialkilomagnezu i halogenku magnezu w stosunku 1 : 1 Uwaga: wzór R 2 Mg ٠ Mg. X 2 X R jest równoważny … … z zapisem 2 RMg. X, Mg Mg stąd odczynnik Grignarda … R X… zapisuje się w postaci RMg. X … …

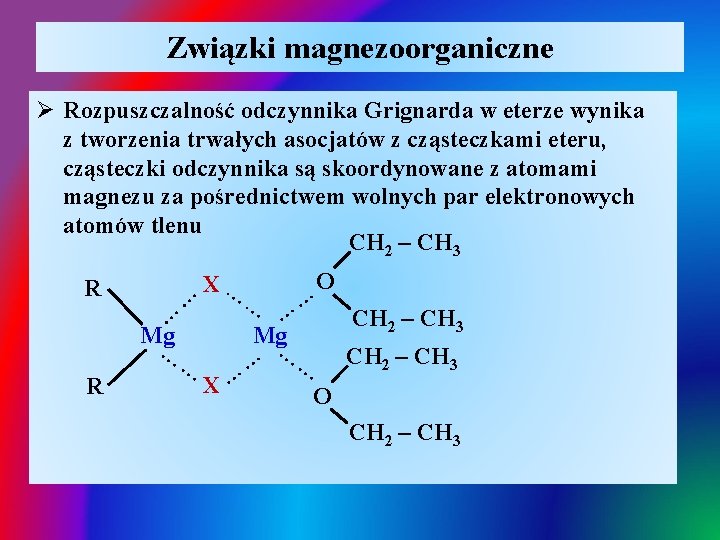
Związki magnezoorganiczne Ø Rozpuszczalność odczynnika Grignarda w eterze wynika z tworzenia trwałych asocjatów z cząsteczkami eteru, cząsteczki odczynnika są skoordynowane z atomami magnezu za pośrednictwem wolnych par elektronowych atomów tlenu CH 2 – CH 3 … Mg … … X… … … R … … Mg O … X … R CH 2 – CH 3 O CH 2 – CH 3

Reakcje zw. R-Mg-X z cząsteczkami zwierającymi aktywny atom wodoru v Związki Grignarda reagują z związkami zawierającymi aktywny wodór: alkohole, woda, aminy 1 o i 2 o, kwasy karboksylowe, acetylen i jego pochodne. Produktami reakcji są odpowiednie węglowodory i sole magnezowe: Ø CH 3 -CH 2 -Mg. Cl + H 2 O CH 3 -CH 2 -CH 3 + Mg(OH)Cl ü chlorek propylomagnezu+woda propan +chlorek hydroksymagnezu Ø CH 3 -CH 2 -Mg. Br + CH 3 -OH CH 3 -CH 3 + Mg(OCH 3)Br ü bromek etylomagnezu + metanol etan + bromek metoksymagnezu Ø CH 3 -CH 2 -Mg. I + CH 3 -NH 2 CH 3 -CH 3 + Mg(NH-CH 3)I ü jodek etylomagnezu+metyloamina etan+jodek metyloaminomagnezu Ø CH 3 Mg. I + HC≡C-CH 3 CH 4 + Mg(C≡C-CH 3)I ü jodek metylomagnezu + propyn metan + jodek propynylomagnezu

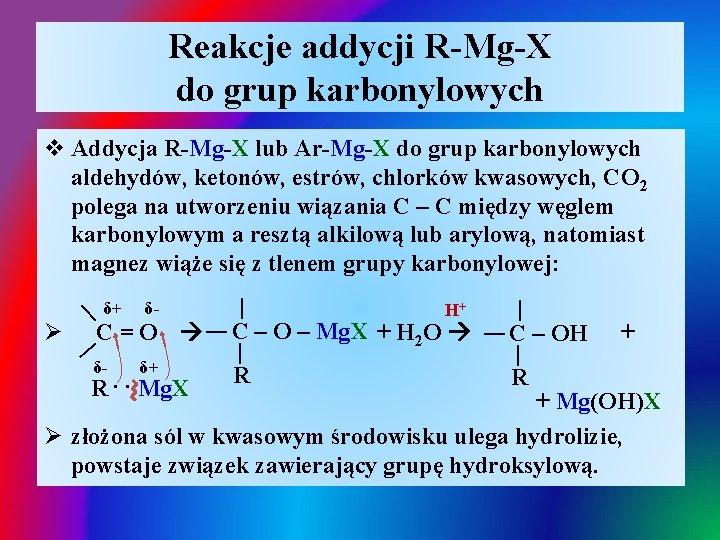
Reakcje addycji R-Mg-X do grup karbonylowych δ- | | C=O δ- δ+ R. . Mg. X | H+ C – O – Mg. X + H 2 O | δ+ R | C – OH | Ø | | v Addycja R-Mg-X lub Ar-Mg-X do grup karbonylowych aldehydów, ketonów, estrów, chlorków kwasowych, CO 2 polega na utworzeniu wiązania C – C między węglem karbonylowym a resztą alkilową lub arylową, natomiast magnez wiąże się z tlenem grupy karbonylowej: R + + Mg(OH)X Ø złożona sól w kwasowym środowisku ulega hydrolizie, powstaje związek zawierający grupę hydroksylową.

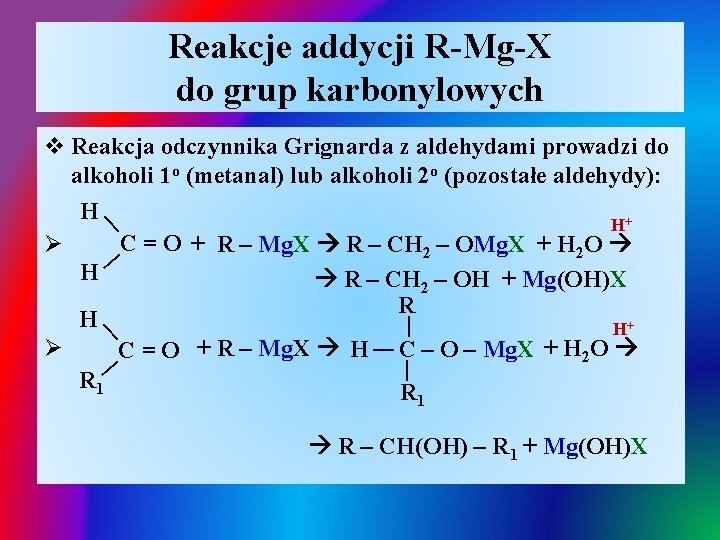
Reakcje addycji R-Mg-X do grup karbonylowych | | v Reakcja odczynnika Grignarda z aldehydami prowadzi do alkoholi 1 o (metanal) lub alkoholi 2 o (pozostałe aldehydy): H | H+ C = O + R – Mg. X R – CH 2 – OMg. X + H 2 O Ø H R – CH 2 – OH + Mg(OH)X R H | | H+ Ø C = O + R – Mg. X H C – O – Mg. X + H 2 O R 1 R – CH(OH) – R 1 + Mg(OH)X

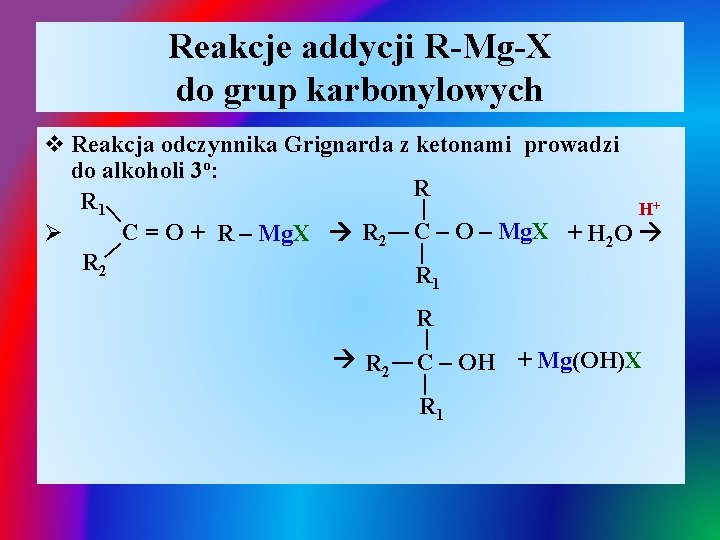
Reakcje addycji R-Mg-X do grup karbonylowych | v Reakcja odczynnika Grignarda z ketonami prowadzi do alkoholi 3 o: R R 1 | | H+ C = O + R – Mg. X R 2 C – O – Mg. X + H 2 O Ø R 2 R 1 | | R 2 R | C – OH + Mg(OH)X R 1

Reakcje addycji R-Mg-X do grup karbonylowych | C = O + R – Mg. X R O – R 2 | C – O – Mg. X | R 2 – O R 1 | C = O + R 2 OMg. X | Ø R 1 | | v Reakcja odczynnika Grignarda z estrami prowadzi do alkoholi 3 o zawierające przynajmniej dwie identyczne grupy węglowodorowe: Ø w I etapie reakcji estru z odczynnikiem Grignarda powstaje produkt, który ulega przemianie w keton R

Reakcje addycji R-Mg-X do grup karbonylowych | | | v Reakcja odczynnika Grignarda z estrami prowadzi do alkoholi 3 o zawierające przynajmniej dwie identyczne grupy węglowodorowe cd. : Ø w II etapie reakcji powstający keton reaguje z drugą cząsteczką odczynnika Grignarda R R 1 | | H+ C = O + R – Mg. X R C – O – Mg. X + H 2 O Ø R R 1 R | R C – OH + Mg(OH)X R 1

Reakcje addycji R-Mg-X do grup karbonylowych | v Reakcja odczynnika Grignarda z tlenkiem węgla(IV) prowadzi do soli tupu R – COOMg. X, która w roztworze wodnym ulega hydrolizie i powstaje kwas karboksylowy (do reakcji stosuje się zestalony i rozdrobniony suchy lód) || O Ø O = C = O + R – Mg. X R C OMg. X || O H+ Ø R C + H 2 O R C + Mg(OH)X OMg. X OH | | |

Reakcje addycji R-Mg-X do grup karbonylowych | | | R 1 | | R | | v Reakcja odczynnika Grignarda z chlorkami kwasowymi prowadzi do alkoholi 3 o, reakcja przebiega w 2–ch etapach, produktem pośrednim jest keton, który reaguje z drugą cząsteczką odczynnika, produkt ulega hydrolizie: R R 1 | | Ø C = O + R-Mg. X Cl C – O – Mg. X C = O + Cl R + Mg. Cl. X R 1 R R + R 1 | | H | Ø C = O + R-Mg. X R-C-O-Mg. X + H 2 O R-C-OH + R 1 + Mg(OH)X

Reakcje addycji zw. R-Mg-X do wiązań podwójnych między atomami węgla v Addycja odczynnika Grignarda do wiązań podwójnych między atomami węgla może zajść w przypadku gdy są one zaktywowane sąsiedztwem elektroujemnych grup funkcyjnych O-R 1 R I I δδ+ I Ø CH 2 = CH – C = O + R-Mg. X CH 2 – CH = C – OMg. X Ø produkt ulega hydrolizie, natomiast produkt hydrolizy ulega izomeryzacji i powstaje ester nasycony O-R 1 R R I I H+ I I Ø CH 2–CH=C–OMg. X + H 2 O CH 2–CH=C–OH + + Mg(OH)X

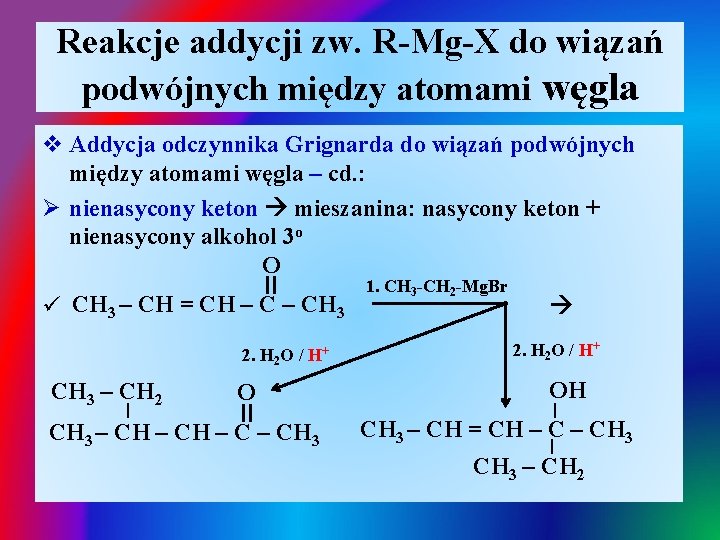
Reakcje addycji zw. R-Mg-X do wiązań podwójnych między atomami węgla v Addycja odczynnika Grignarda do wiązań podwójnych między atomami węgla – cd. : O-R 1 R R izomeryzacja I I Ø CH 2 – CH = C – OH CH 2 – C = O v Produkty addycji odczynnika Grignarda do wiązań podwójnych miedzy atomami węgla zleży od typu nienasyconego związku: Ø nienasycony keton mieszanina: nasycony keton + nienasycony alkohol 3 o Ø nienasycony aldehyd nienasycony alkohol 2 o

Reakcje addycji zw. R-Mg-X do wiązań podwójnych między atomami węgla v Addycja odczynnika Grignarda do wiązań podwójnych między atomami węgla – cd. : Ø nienasycony keton mieszanina: nasycony keton + nienasycony alkohol 3 o O II ü CH 3 – CH = CH – CH 3 2. H 2 O / H+ CH 3 – CH 2 O I CH 3 – CH 3 1. CH 3 -CH 2 -Mg. Br 2. H 2 O / H+ OH I CH 3 – CH = CH – CH 3 I CH 3 – CH 2 II

Reakcje addycji zw. R-Mg-X do wiązań podwójnych między atomami węgla v Addycja odczynnika Grignarda do wiązań podwójnych między atomami węgla – cd. : Ø nienasycony aldehyd nienasycony alkohol 2 o O II CH 3 – CH = CH – C – H 1. CH 3 -CH 2 -Mg. Br 2. H 2 O / H+ OH I CH 3 – CH = CH – C – H I CH 3 – CH 2

Reakcje addycji zw. R-Mg-X do grupy nitrylowej | | | v Azot jest pierwiastkiem bardziej elektroujemny niż węgiel, grupa nitrylowa jest spolaryzowana, to z kolei determinuje kierunek addycji nukleofilowej R-Mg-X: R I δ+ δ+ δδØ R 1 – C ≡ N + R – Mg. X R 1 – C = N – Mg. X Ø produkt ulega hydrolizie i powstaje ketimina, która ulega dalszej hydrolizie do ketonu: R 1 | + H 2 O / H H 2 O C = NH C = N – Mg. X C = O + NH 3 Ø R R R

Reakcje addycji zw. R-Mg-X do tlenku siarki(IV) v Addycja odczynnika Grignarda do SO 2 prowadzi do powstania kwasów sulfinowych (reakcja analogiczna do addycji R-Mg. X do CO 2): O II Ø O = S = O + R – Mg. X R – S – OMg. X O | R | II Ø R – S – OMg. X + H 2 O || O S OH + Mg(OH)X