Zwizki fosforoorganiczne podzia zwizkw fosforoorganicznych ze wzgldu na














- Slides: 20

Związki fosforoorganiczne Ø podział związków fosforoorganicznych ze względu na liczbę wiązań atomu fosforu w cząsteczkach, Ø struktura i nazewnictwo zw. fosforoorganicznych, Ø właściwości fizyczne zw. fosforoorganicznych, Ø metody otrzymywania wybranych grup związków fosforoorganicznych, Ø właściwości chemiczne związków fosforoorganicznych

Podział związków fosforoorganicznych ze względu na liczbę wiązań w cząsteczkach v Związki fosforoorganiczne – związki organiczne zawierające w cząsteczkach wiązania między atomami węgla i fosforu. v Fosfor w odróżnieniu od atomu azotu może utworzyć pięć wiązań kowalencyjnych. v Związki fosforoorganiczne można podzielić pod kątem liczby utworzonych wiązań kowalencyjnych: Ø związki o trzech wiązaniach: ü fosfiny (analogi amin) 1 o, 2 o i 3 o – pochodne PH 3: (R-PH 2 / Ar-PH 2; R 2 PH / Ar 2 PH; R 3 P /Ar 3 P) § CH 3 -PH 2 – metylofosfina, (CH 3)2 PH – dimetylofosina, (CH 3)3 P – trimetylofosfina

Związki o trzech wiązaniach w cząsteczce Ø związki o trzech wiązaniach: ü kwasy fosfonawe: R – P(OH)2 / Ar – P(OH)2 § kwasy fosfonawe są nietrwałe i przechodzą w kwasy O fosfinowe: II § R – P(OH)2 ↔ R – P – OH | kwas fosfonawy H (dwuprotonowy) kwas fosfinawy (jednoprotonowy) ü pochodne kwasów fosfonawych: R – P(OR)2; R – PX 2 (R: alkil, aryl, wodór; X – fluorowiec) § C 6 H 5 -P(OCH 2 -CH 3)2 – fenylofosfonian dietylu § C 6 H 5 -PCl 2 – dichlorek kwasu fenylofosfonawego

Związki o trzech wiązaniach w cząsteczce Ø związki o trzech wiązaniach: ü kwasy fosfinawe: R 2 P-OH (R: alkil, aryl, wodór) ü kwasy fosfinawe są nietrwałe i przechodzą w tlenek fosfiny O OH § I II R–P–R ↔ kwas fosfinawy H tlenek fosfiny ü pochodne kwasów fosfinawych: R 2 P-OR, R 2 PX (R: alkil, aryl, wodór, X – fluorowiec): § (C 6 H 5)2 P-OCH 3 – difenylofosfinin metylu § (CH 3)2 P-Cl – chlorek kwasu dimetylofosfinawego

Związki o czterech lub pięciu wiązaniach w cząsteczce § związki o czterech i pięciu wiązaniach: § sole fosfoniowe (analogi soli amoniowych) R 4 P�Xɵ (R: alkil, aryl, wodór, X – fluorowiec): § (CH 3 -CH 2)HP�(CH 3)2 Brɵ – bromek etylodimetylofosfoniowy § (CH 3)4 P�Clɵ– chlorek tetrametylofosfoniowy ü tlenki fosfin: R 3 P = O (R: alkil, aryl, wodór): § (CH 3)3 P = O – tlenek trimetylofosfiny § (CH 3)2 HP = O – tlenek dimetylofosfiny ü kwasy fosfonowe: R-PO(OH)2 ( R – alkil, aryl, wodór) O II CH 3 – P – OH kwas metylofosfonowy I OH

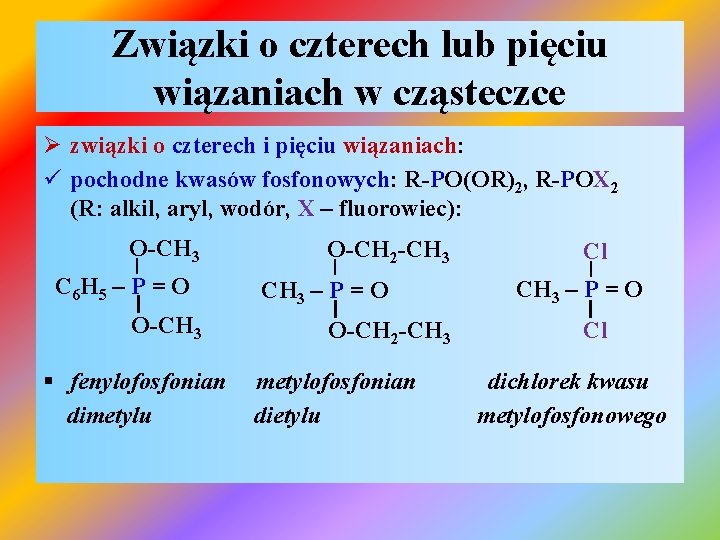
Związki o czterech lub pięciu wiązaniach w cząsteczce Ø związki o czterech i pięciu wiązaniach: ü pochodne kwasów fosfonowych: R-PO(OR)2, R-POX 2 (R: alkil, aryl, wodór, X – fluorowiec): O-CH 3 | C 6 H 5 – P = O I O-CH 3 § fenylofosfonian dimetylu O-CH 2 -CH 3 | CH 3 – P = O I O-CH 2 -CH 3 metylofosfonian dietylu Cl | CH 3 – P = O I Cl dichlorek kwasu metylofosfonowego

Związki o czterech lub pięciu wiązaniach w cząsteczce Ø ü ü ü związki o czterech i pięciu wiązaniach: kwasy fosfinowe: R 2 PO(OH) pochodne kwasów fosfinowych: R 2 PO(OR) lub R 2 POX (R: alkil, aryl, wodór, X – fluorowiec) OH | CH 3 – P = O I CH 3 Cl O-CH 3 | C 6 H 5 – P = O I | CH 3 -CH 2 – P = O C 6 H 5 § kwas difenylofosfinian dimetylofosfinowy metylu I CH 2 -CH 3 chlorek kwasu dietylofosfinowego

Związki o czterech lub pięciu wiązaniach w cząsteczce Ø związki o czterech i pięciu wiązaniach: ü fosforany: R 5 P (R: alkil, aryl, wodór): § (CH 3)4 HP – tetrametylofosforan, § (C 6 H 5)5 P – pentafenylofosforan ü alkilidenofosforany: R 3 P = CR 2 (R: alkil, aryl, wodór) § (C 6 H 5)3 P = CH 2 – metylenotrifenylofosforan. v Uwaga: Ø estry kwasu fosforowego(V) o ogólnym wzorze (RO)3 P = O nie należą do związków organicznych, ponieważ w cząsteczkach estrów tego kwasu nie występują wiązania węgiel – fosfor.

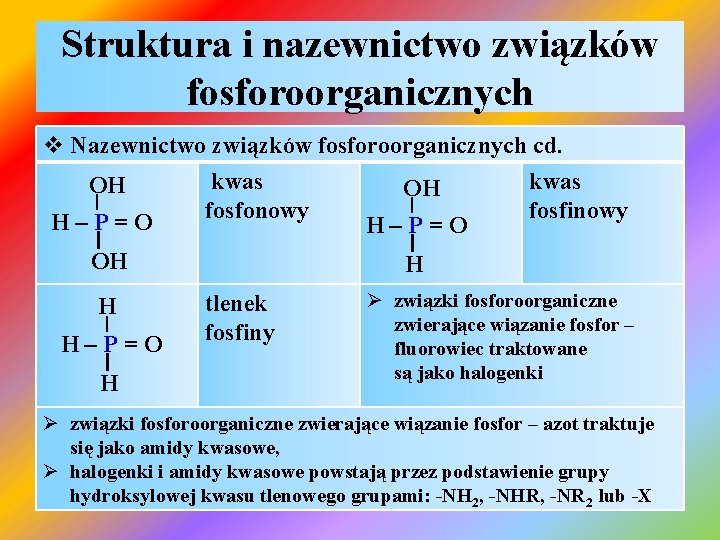
Struktura i nazewnictwo związków fosforoorganicznych v Nazewnictwo związków fosforoorganicznych opiera się na systemie w którym: Ø traktuje się je jako pochodne wodorków fosforu, tlenowych kwasów fosforowych lub tlenków, Ø w w/w cząsteczkach atom(y) wodoru został zastąpiony(e) grupą(ami) alkilową(ymi) arylową(ymi) PH 3 OH | H – P: I OH fosfina kwas fosfonawy PH 5 fosforan OH | H – P: fwas fosfinowy I H

Struktura i nazewnictwo związków fosforoorganicznych v Nazewnictwo związków fosforoorganicznych cd. kwas OH OH | | fosfonowy fosfinowy H–P=O I I OH H H | H–P=O I H tlenek fosfiny Ø związki fosforoorganiczne zwierające wiązanie fosfor – fluorowiec traktowane są jako halogenki Ø związki fosforoorganiczne zwierające wiązanie fosfor – azot traktuje się jako amidy kwasowe, Ø halogenki i amidy kwasowe powstają przez podstawienie grupy hydroksylowej kwasu tlenowego grupami: -NH 2, -NHR, -NR 2 lub -X

Struktura i nazewnictwo związków fosforoorganicznych v Związki fosforoorganicznych z atomem fosforu tworzącego trzy wiązania: Ø trzy orbitale wiążące σ tworzą elektrony niesparowane atomu fosforu orbitali atomowych 3 px, 3 py, 3 pz, Ø cząsteczki mają budowę piramidy trygonalnej, kąty między orbitalami wiążącym wynoszą 100 o, Ø fosfiny 3 o zawierające trzy różne podstawniki alkilowe lub arylowe są czynne optycznie (czynne enancjomery): R 1 | | : P…. . P: . R 3 R 2 …. . .

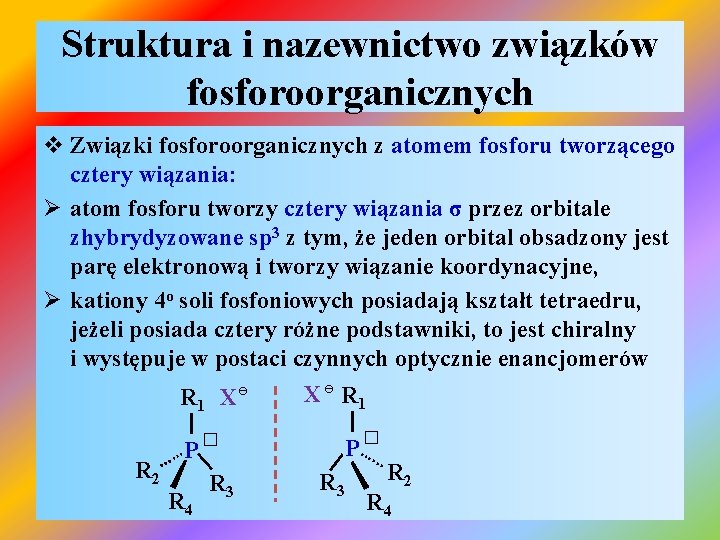
Struktura i nazewnictwo związków fosforoorganicznych v Związki fosforoorganicznych z atomem fosforu tworzącego cztery wiązania: Ø atom fosforu tworzy cztery wiązania σ przez orbitale zhybrydyzowane sp 3 z tym, że jeden orbital obsadzony jest parę elektronową i tworzy wiązanie koordynacyjne, Ø kationy 4 o soli fosfoniowych posiadają kształt tetraedru, jeżeli posiada cztery różne podstawniki, to jest chiralny i występuje w postaci czynnych optycznie enancjomerów X ɵ R 1 X ɵ | | � …. . P P� |. | R 2 R 3 R 4. …. .

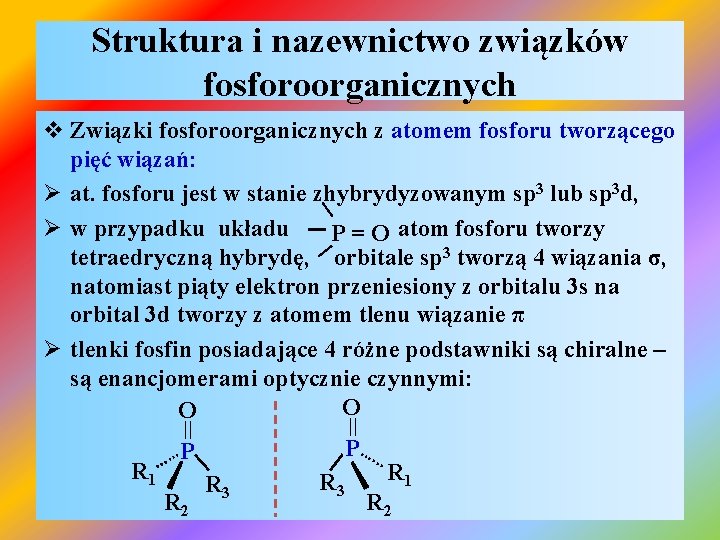
Struktura i nazewnictwo związków fosforoorganicznych I I v Związki fosforoorganicznych z atomem fosforu tworzącego pięć wiązań: Ø at. fosforu jest w stanie zhybrydyzowanym sp 3 lub sp 3 d, I Ø w przypadku układu P = O atom fosforu tworzy tetraedryczną hybrydę, orbitale sp 3 tworzą 4 wiązania σ, natomiast piąty elektron przeniesiony z orbitalu 3 s na orbital 3 d tworzy z atomem tlenu wiązanie π Ø tlenki fosfin posiadające 4 różne podstawniki są chiralne – są enancjomerami optycznie czynnymi: O O = = P| R 1 R 3 R 2 | P…. . . R 1 R 3 R 2 . …. .

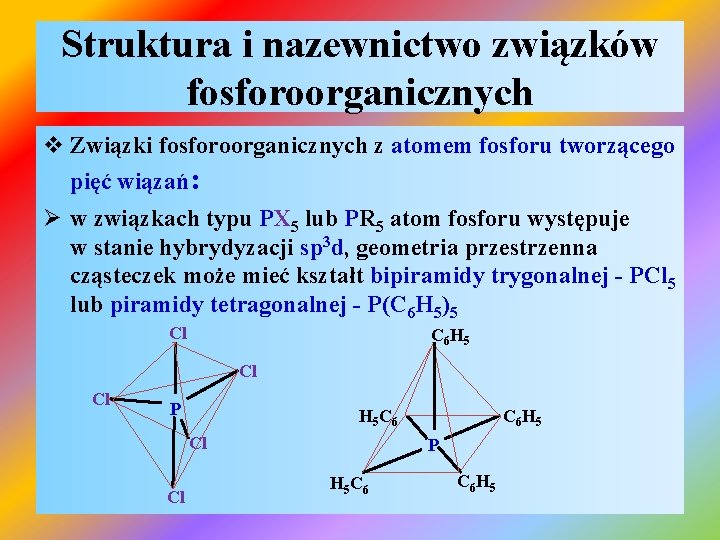
Struktura i nazewnictwo związków fosforoorganicznych v Związki fosforoorganicznych z atomem fosforu tworzącego pięć wiązań: Ø w związkach typu PX 5 lub PR 5 atom fosforu występuje w stanie hybrydyzacji sp 3 d, geometria przestrzenna cząsteczek może mieć kształt bipiramidy trygonalnej - PCl 5 lub piramidy tetragonalnej - P(C 6 H 5)5 Cl C 6 H 5 Cl Cl P H 5 C 6 Cl Cl C 6 H 5 P H 5 C 6 H 5

Właściwości fizyczne związków fosforoorganicznych v Fosfiny: Ø toksyczne, nierozpuszczalne w wodzie ciecze o charakterystycznym zapachu, v Tlenki fosfin: Ø substancje krystaliczne, bezbarwne v Kwasy fosfonowe i fosfinowe: Ø substancje krystaliczne, dobrze rozpuszczalne w wodzie, q Zastosowanie związków fosforoorganicznych: Ø herbicydy, insektycydy (chlorofos, dipretex na bazie estru dimetylowego kwasu trichlorohydroksyetylofosfonowego), Ø środki bojowe (sarin – ester izopropylowy kwasu fluorometylofosfinowego).

Metody otrzymywanie wybranych związków fosforoorganicznych v Otrzymywanie 1 o i 2 o alkilofosfin: Ø ogrzewanie helogenków kwasowych z jodkiem fosfoniowym w obecności Zn. O, który wiąże wydzielający się jodowodór: � ɵ Zn. O/T ü PH 4 I PH 3 � ɵ ü PH 3 + CH 3 -CH 2 I CH 3 -CH 2 -PH 3 I �ɵ Zn. O/T ü CH 3 -CH 2 -PH 3 I CH 3 -CH 2 -PH 2 (jodek etylofosfoniowy) (etylofosfina) �ɵ ü CH 3 -CH 2 -PH 2 + CH 3 -CH 2 I (CH 3 -CH 2)2 PH 2 I Zn. O/T ü (CH 3 -CH 2)2 PH 2�I ɵ (CH 3 -CH 2)2 PH (jodek dimetylofosfoniowy) (dietylofosfina)

Metody otrzymywanie wybranych związków fosforoorganicznych v Otrzymywanie 1 o i 2 o fosfin cd. : Ø redukcja odpowiednich chlorków kwasów fosfonawych (R-PCl 2) lub chlorków kwasów fosfinawych (R 2 -PCl) Li. Al. H ü C 6 H 5 -PCl 2 C 6 H 5 -PH 2 4 (dichlorek kwasu fosfonawego) ü (C 6 H 5)2 -P-Cl Li. Al. H 4 (fenylofosfina) (C 6 H 3)2 PH (chlorek kwasu difenylofosfinowego) (difenylofosfina) v Otrzymywanie 3 o fosfin: Ø reakcja związków magnezoorganicznych z trichlorkiem fosforu: ü 3 CH 3 -CH 2 Mg. I + PCl 3 (CH 3 -CH 2)3 P + 3 Mg. Cl. I (trietylofosfina)

Metody otrzymywanie wybranych związków fosforoorganicznych v Otrzymywanie chlorków kwasów arylofosfonawych: Ø reakcja substytucji elektrofilowej PCl 3 z związkami aromatycznym w obecności Al. Cl 3: ü C 6 H 6 + PCl 3 + Al. Cl 3 C 6 H 5 -PCl 2 Al. Cl 3 + HCl ü C 6 H 5 -PCl 2 Al. Cl 3 + POCl 3 C 6 H 5 -PCl 2 + POCl 3 Al. Cl 3 (dichlorek kwasu fenylofosfonawego) v Otrzymywanie kwasów alkilofosfonowych – metoda Arbuzowa: Ø alkilowanie fosforynów trialkilowych halogenkami alkilowymi: � ɵ ü (CH 3 -CH 2 O)3 P + R – X [(CH 3 -CH 2 O)3]P – RX (CH 3 -CH 2 O)2 P = O + CH 3 -CH 2 -X (alkilofosfonian dietylu) | R

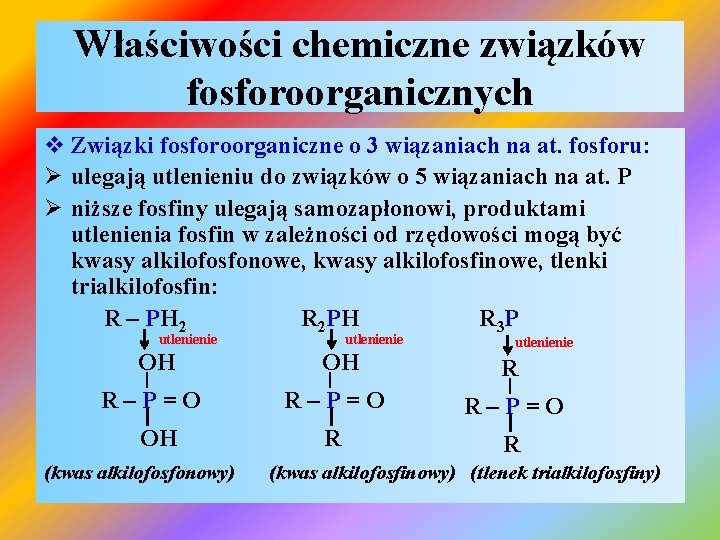
Właściwości chemiczne związków fosforoorganicznych v Związki fosforoorganiczne o 3 wiązaniach na at. fosforu: Ø ulegają utlenieniu do związków o 5 wiązaniach na at. P Ø niższe fosfiny ulegają samozapłonowi, produktami utlenienia fosfin w zależności od rzędowości mogą być kwasy alkilofosfonowe, kwasy alkilofosfinowe, tlenki trialkilofosfin: R – PH 2 R 2 PH R 3 P utlenienie OH OH R R–P=O R R | I OH (kwas alkilofosfonowy) | I (kwas alkilofosfinowy) (tlenek trialkilofosfiny)

Właściwości chemiczne zw. fosforoorganicznych v Związki fosforoorganiczne o 5 wiązaniach na at. fosforu: Ø związki są znacznie trwalsze, ulegają reakcjom, w których wiązania P – Cl, P – OR, P – NR 2 ulegają rozerwaniu pod wpływem czynnika nukleofilowego: OH Cl | ü R – P = O + 2 H 2 O I Cl Cl | (dichlorek kwasu alkilofosfonowego) | R – P = O + 2 HCl I (kwas alkilofosfonowy) OH NR`2 | ü R – P = O + R`2 NH R – P = O I (chlorek kwasu (amid kwasu I R dialkilofosfinowego) R`` OR` | | ü R – P = O + R``Mg. Cl R – P = O + R`OMg. Cl I (tlenek trialkilofosfiny) I (ester kwasu R R dialkilofosfinowego)



















