VSEPR Valenceshell electronpair repulsion geometrie molekuly minimum celkov



- Slides: 11

VSEPR = Valence-shell electron-pair repulsion geometrie molekuly – minimum celkové energie v prostoru souřadnic všech atomů energie molekuly repulze mezi elektrony repulze mezi jádry přitažlivá energie mezi el. a jádry kinetická energie elektronů VSEPR – uvažuje pouze repulzi valenčních elektronových párů – jejich prostorové uspořádání odpovídá minimu odpudivé energie

VSEPR • Elektronový pár se snaží co nejvíce přibližit k jádru a zároveň být co nejdále od ostatních elektronových párů • Repulze mezi elektronovými páry klesá v pořadí: * 2 nevazebné (volné) elektronové páry ne * vazebný pár – nevazebný pár ne * 2 vazebné elektronové páry • Mezi strukturami s 90° interakcemi je upřednostněna konfigurace s minimem těchto interakcí

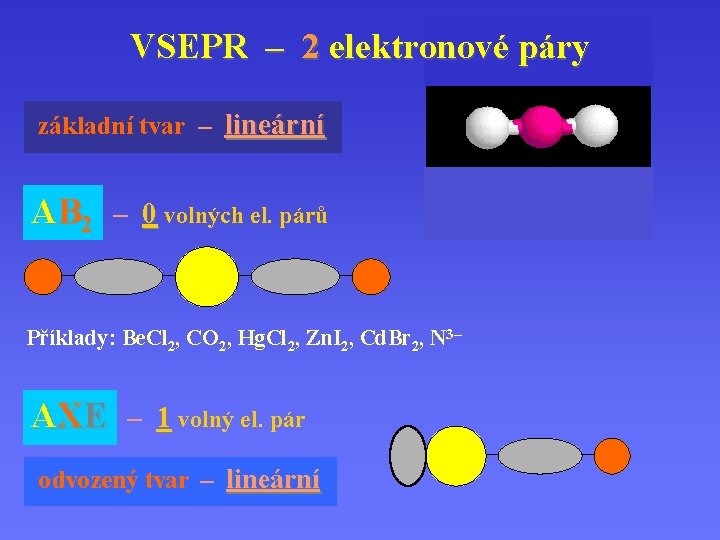
VSEPR – 2 elektronové páry základní tvar – lineární AB 2 – 0 volných el. párů Příklady: Be. Cl 2, CO 2, Hg. Cl 2, Zn. I 2, Cd. Br 2, N 3– AXE – 1 volný el. pár odvozený tvar – lineární

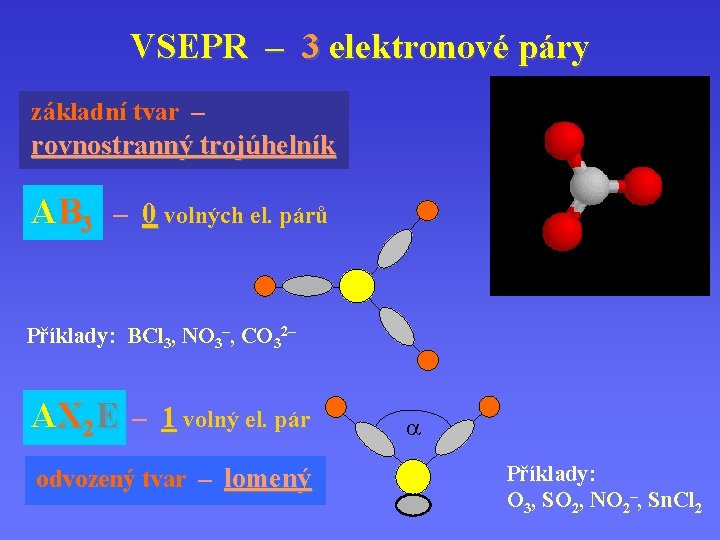
VSEPR – 3 elektronové páry základní tvar – rovnostranný trojúhelník AB 3 – 0 volných el. párů Příklady: BCl 3, NO 3–, CO 32– AX 2 E – 1 volný el. pár odvozený tvar – lomený a Příklady: O 3, SO 2, NO 2–, Sn. Cl 2

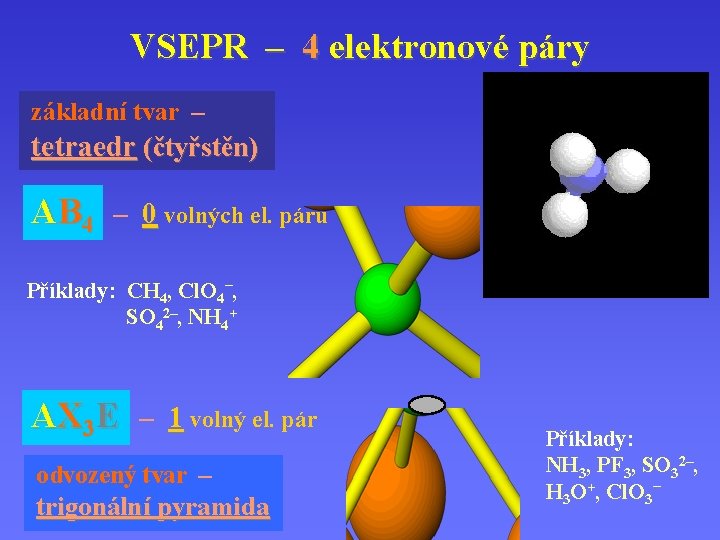
VSEPR – 4 elektronové páry základní tvar – tetraedr (čtyřstěn) AB 4 – 0 volných el. párů Příklady: CH 4, Cl. O 4–, SO 42–, NH 4+ AX 3 E – 1 volný el. pár odvozený tvar – trigonální pyramida Příklady: NH 3, PF 3, SO 32–, H 3 O+, Cl. O 3–

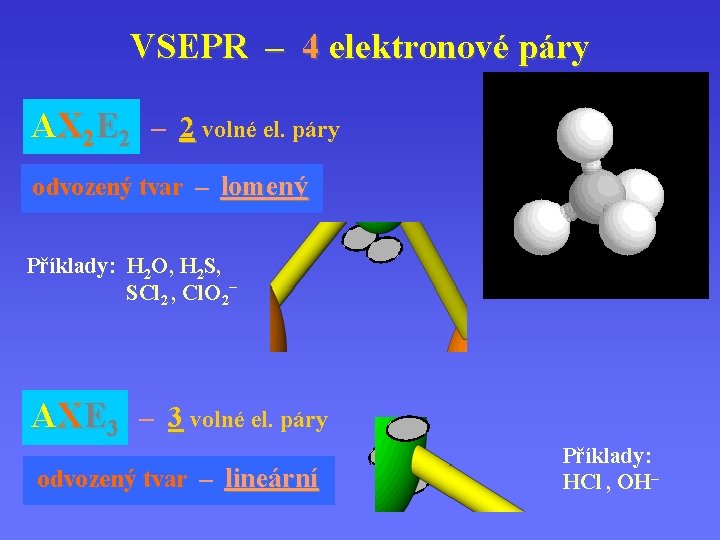
VSEPR – 4 elektronové páry AX 2 E 2 – 2 volné el. páry odvozený tvar – lomený Příklady: H 2 O, H 2 S, SCl 2 , Cl. O 2– AXE 3 – 3 volné el. páry odvozený tvar – lineární Příklady: HCl , OH–

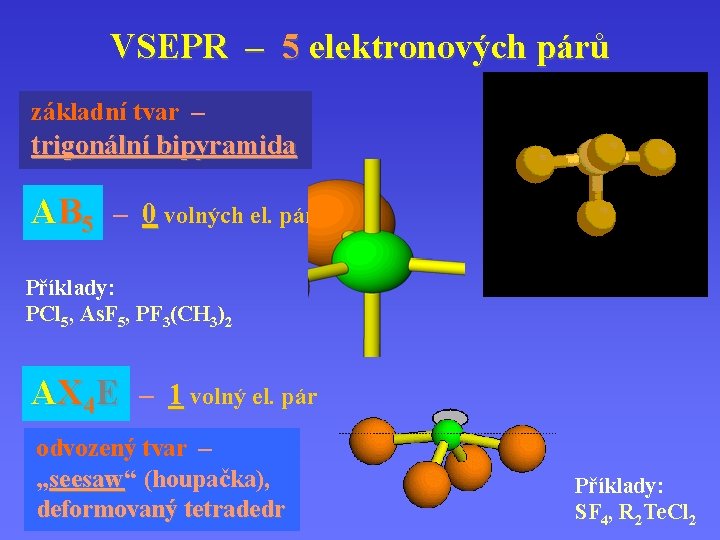
VSEPR – 5 elektronových párů základní tvar – trigonální bipyramida AB 5 – 0 volných el. párů Příklady: PCl 5, As. F 5, PF 3(CH 3)2 AX 4 E – 1 volný el. pár odvozený tvar – „seesaw“ seesaw (houpačka), deformovaný tetradedr Příklady: SF 4, R 2 Te. Cl 2

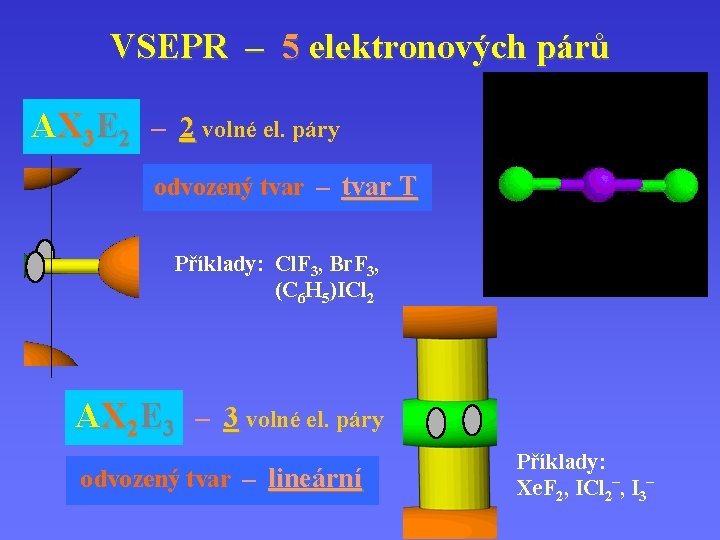
VSEPR – 5 elektronových párů AX 3 E 2 – 2 volné el. páry odvozený tvar – tvar T Příklady: Cl. F 3, Br. F 3, (C 6 H 5)ICl 2 AX 2 E 3 – 3 volné el. páry odvozený tvar – lineární Příklady: Xe. F 2, ICl 2–, I 3–

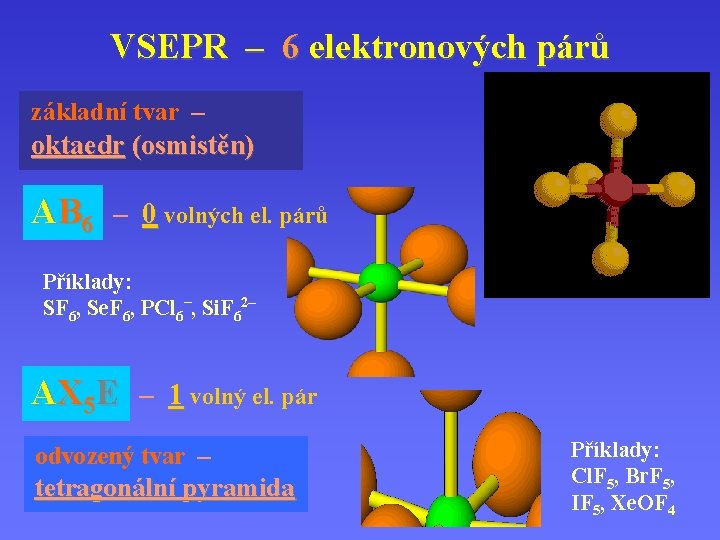
VSEPR – 6 elektronových párů základní tvar – oktaedr (osmistěn) AB 6 – 0 volných el. párů Příklady: SF 6, Se. F 6, PCl 6–, Si. F 62– AX 5 E – 1 volný el. pár odvozený tvar – tetragonální pyramida Příklady: Cl. F 5, Br. F 5, IF 5, Xe. OF 4

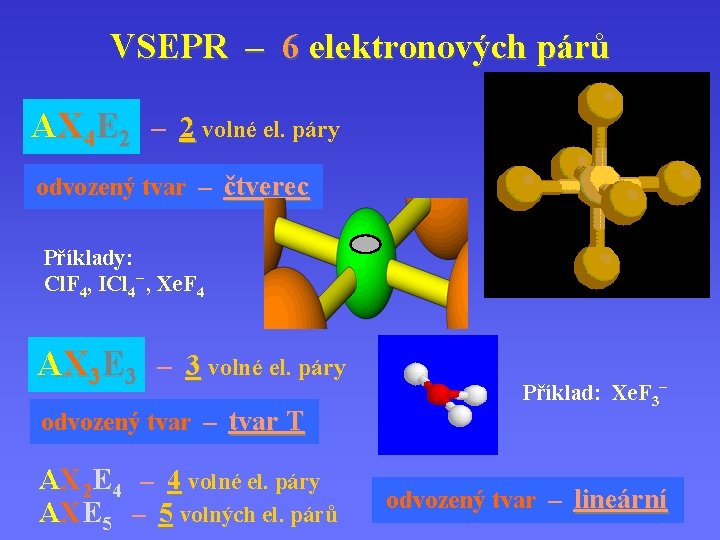
VSEPR – 6 elektronových párů AX 4 E 2 – 2 volné el. páry odvozený tvar – čtverec Příklady: Cl. F 4, ICl 4– , Xe. F 4 AX 3 E 3 – 3 volné el. páry odvozený tvar – tvar T AX 2 E 4 – 4 volné el. páry AXE 5 – 5 volných el. párů Příklad: Xe. F 3– odvozený tvar – lineární

Vyšší koordinace (7 – 9) k. č. 7 • pentagonální bipyramida (Př. : IF 7) • „capped“ oktaedr • „capped“ trigonální prizma k. č. 8 • tetragonální prizma (Př. : Ta. F 83–) • trigonální dodekaedr (12 -tistěn) k. č. 9 • „capped“ (3 ) trigonální prizma (Př. : Re. H 92–)