UNIVERSITATEA POLITEHNICA TIMIOARA MASTER SIIS Sisteme Informatice n






![Structura atomului • Nucleu [p, n] (nr de ordine Z, nr de masă A), Structura atomului • Nucleu [p, n] (nr de ordine Z, nr de masă A),](https://slidetodoc.com/presentation_image/3b64a546f2330af0016b9d9c03029eb2/image-7.jpg)









- Slides: 23

UNIVERSITATEA POLITEHNICA TIMIŞOARA MASTER SIIS Sisteme Informatice în Îngrijirea Sănătății Curs 2 Bioinformatica 1

www. medinfo. umft. ro/dim/ bioinformatica. htm Curs 2 Bioinformatica 2

BIOINFORMATICA Prof Dr George I Mihalaş UMF Victor Babeş Curs 2 Bioinformatica 3

CURSUL 2 NOȚIUNI DE BIOFIZICĂ Curs 2 Bioinformatica 4

Obiectul și capitolele biofizicii • Obiectul biofizicii – Studiul proceselor fizice la nivelul materiei vii • Capitole – Biofizica moleculară – Biofizica celulară – Biofizica sistemelor complexe – Interacțiunea factorilor fizici cu materia vie Curs 2 Bioinformatica 5

Planul cursului • Biofizica moleculară – Structura atomului • Structura norului electronic – Structura moleculei • Legături chimice, forţe intermoleculare – Molecula de apă • Structură, soluții, p. H • Biofizica celulară – Termodinamica biologică – Fenomene de transport • Transportul transmembranar – Bioelectrogeneza • Potențialul celular Curs 2 Bioinformatica 6
![Structura atomului Nucleu p n nr de ordine Z nr de masă A Structura atomului • Nucleu [p, n] (nr de ordine Z, nr de masă A),](https://slidetodoc.com/presentation_image/3b64a546f2330af0016b9d9c03029eb2/image-7.jpg)
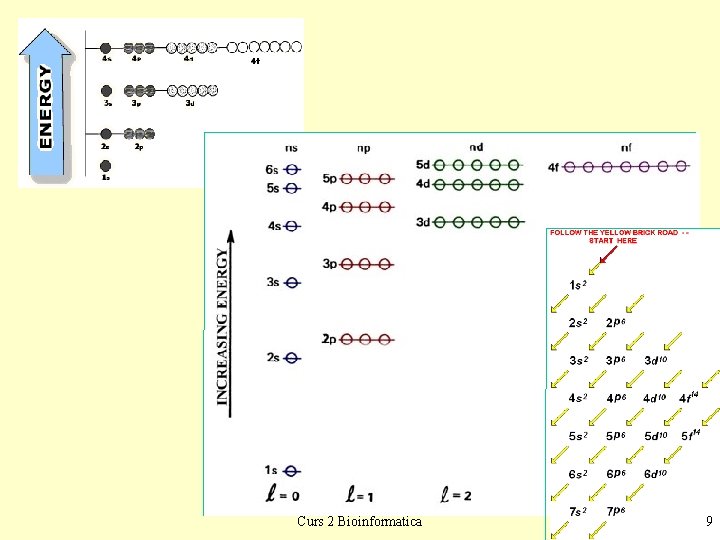
Structura atomului • Nucleu [p, n] (nr de ordine Z, nr de masă A), sarcina +Ze [ ZX ] • Electroni - 4 nr. cuantice – principal - n = 1, 2, 3, … - nivelul energetic (straturi: K, L, M …) • E ~ - 1 / n 2 , r ~ n 2 – orbital - l = 0, 1, …, n-1 - subnivelul [forma norului] (s, p, d, f) • s - nor sferic, p - bilobar, de-alungul axelor (px, py, pz) – magnetic - ml = -l, …, 0, … +l - orientarea norului în spaţiu • noţiunea de orbital (3 nr cuantice) – de spin - s = +1/2, -1/2 - defineşte electronul pe orbital • Principiul lui Pauli – într-un atom nu pot exista 2 electroni cu aceleaşi 4 numere cuantice” – (pe un orbital încap maximum 2 electroni, cu spin opus) Curs 2 Bioinformatica 7

Structura norului electronic • Completarea electronilor - începând cu nivelul de cea mai joasă energie E (n = 1) • Ex: 1 H - 1 s 1, 2 He - 1 s 2, 3 Li - 1 s 2 2 s 1, 4 Be - 1 s 2 2 s 2 - subnivelele nu au aceeaşi E, E creşte cu l, se începe cu l = 0 (s) • Ex: 5 B - 1 s 2 2 px 1 – regula lui Hund: • orbitalii aceluiaşi subnivel au aceeaşi energie • se completează întâi fiecare orbital cu 1 electron cu acelaşi spin • Ex: 6 C - 1 s 2 2 px 1 2 py 1, 7 N - 1 s 2 2 px 1 2 py 1 2 pz 1 , - 1 s 2 2 px 2 2 py 2 2 pz 1 , 8 O - 1 s 2 2 px 2 2 py 1 2 pz 1 , 9 F 10 Ne - 1 s 2 2 px 2 2 py 2 2 pz 2, 11 Na - 1 s 2 2 px 2 2 py 2 2 pz 2 3 s 1, - 1 s 2 2 px 2 2 py 2 2 pz 2 3 s 2, 13 Al - 1 s 2 2 px 2 2 py 2 2 pz 2 3 s 2 3 px 1, etc. 12 Mg – reprezentare schematică Curs 2 Bioinformatica 8

Curs 2 Bioinformatica 9

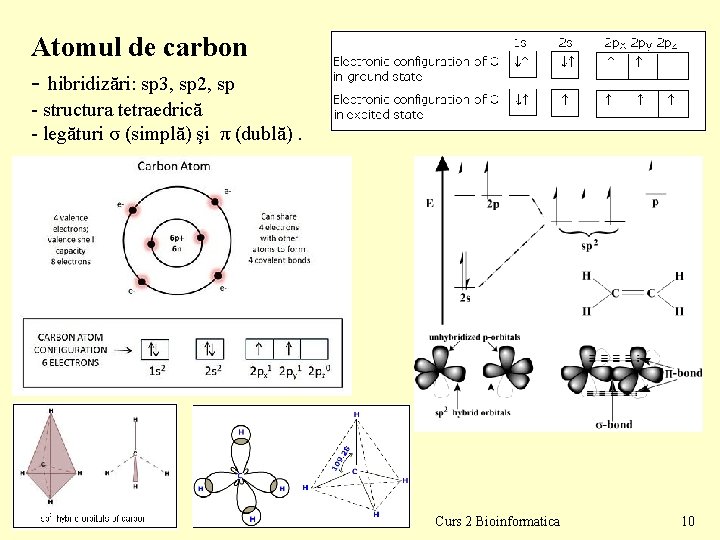
Atomul de carbon - hibridizări: sp 3, sp 2, sp - structura tetraedrică - legături σ (simplă) şi π (dublă). Curs 2 Bioinformatica 10

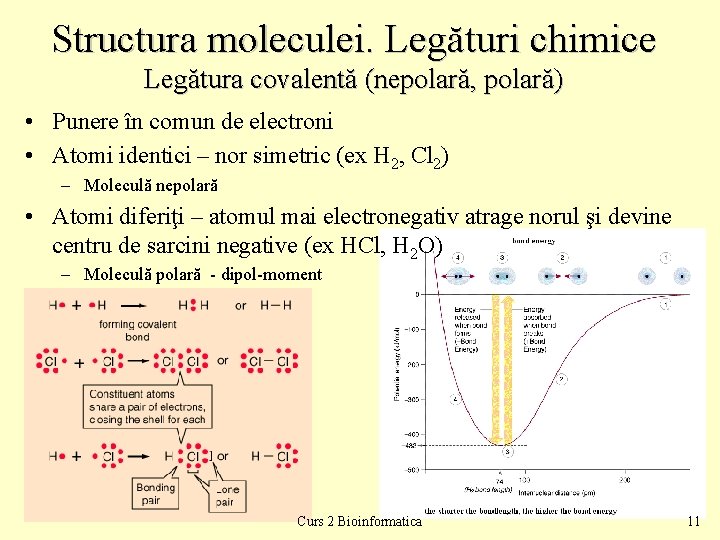
Structura moleculei. Legături chimice Legătura covalentă (nepolară, polară) • Punere în comun de electroni • Atomi identici – nor simetric (ex H 2, Cl 2) – Moleculă nepolară • Atomi diferiţi – atomul mai electronegativ atrage norul şi devine centru de sarcini negative (ex HCl, H 2 O) – Moleculă polară - dipol-moment Curs 2 Bioinformatica 11

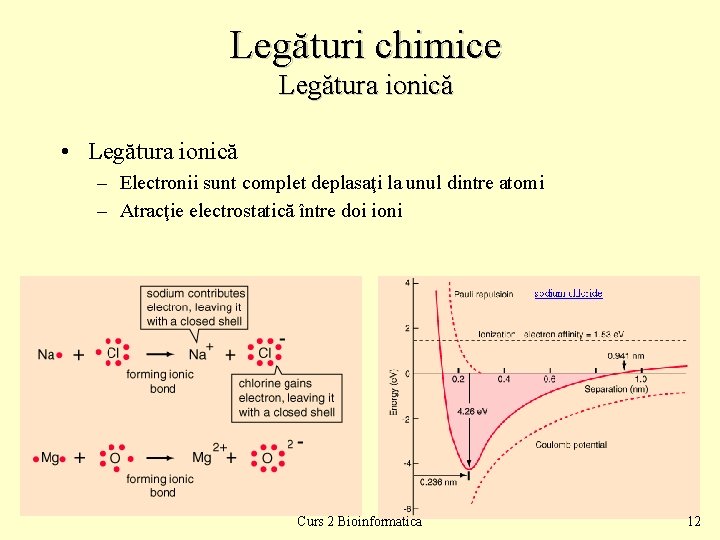
Legături chimice Legătura ionică • Legătura ionică – Electronii sunt complet deplasaţi la unul dintre atomi – Atracţie electrostatică între doi ioni Curs 2 Bioinformatica 12

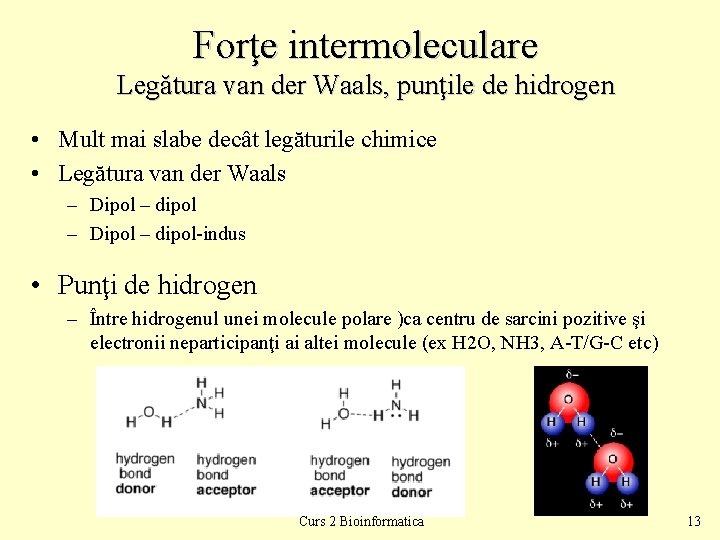
Forţe intermoleculare Legătura van der Waals, punţile de hidrogen • Mult mai slabe decât legăturile chimice • Legătura van der Waals – Dipol – dipol-indus • Punţi de hidrogen – Între hidrogenul unei molecule polare )ca centru de sarcini pozitive şi electronii neparticipanţi ai altei molecule (ex H 2 O, NH 3, A-T/G-C etc) Curs 2 Bioinformatica 13

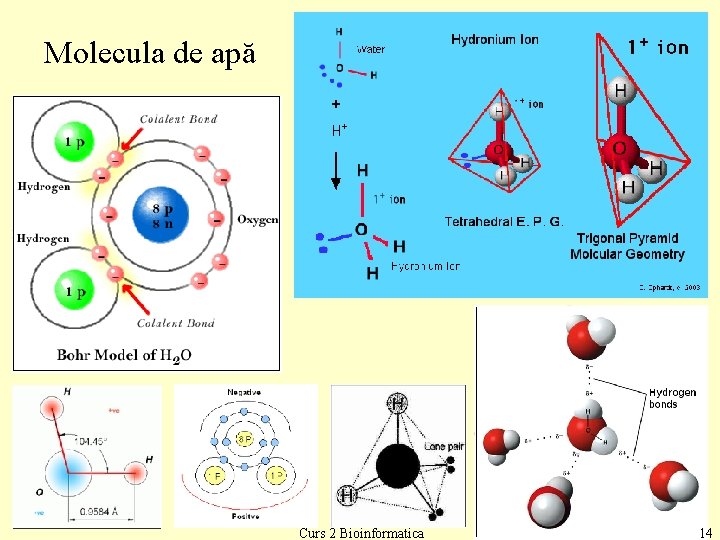
Molecula de apă Curs 2 Bioinformatica 14

Soluții • Sisteme disperse • Disociere – Solvent + solut (subst. diz. ) – Clasificare după diam. (ø) • Soluții moleculare (ø < 10 Å) • Soluții coloidale • Dispersii (ø > 1000 Å) – Clasificare după disociere • Electroliți (tari – tot. , slabi – par. ) • Ne-electroliți (totală → , parțială ↔) – Acizi: elib. H+ AH → A- + H+ – Baze: captează H+ (elib. OH- în sol. apoase) BOH + H+ → B+ + H 2 O ↔ H+ + OH_______________________________ • Concentrații – Procentuală (g/100 ml soluție) – Molară (nr. moli/1 litru soluție) – Normală (nr. echiv. /1 litru sol. ) Curs 2 Bioinformatica BOH → B+ + OH- 15

p. H Acizi - substante care in solutie apoasa pun in libertate protoni (H+). Baze - substante care in solutie apoasa eliberează ioni hidroxil (OH-). Apa - caracter neutru. Caracter amfoter - şi acid şi bază. Curs 2 Bioinformatica 16

p. H Scara p. H : 0 - 14: 0 -7 = acid, 7 = neutru 7 -14 = caracter bazic (alcalin) Disocierea apei - produsul ionic al apei Solutii tampon – mentin p. H constant: - acid tare + sarea sa p. H = p. Ka + log([f. deprot]/[f. protonata]) Curs 2 Bioinformatica 17

Termodinamică biologică • Parametri de stare: stare intensivi și extensivi – Funcții de stare (U, G, S), potențial chimic (μ) • Stare de echilibru, echilibru procese termodinamice – Parametri de proces (variații) – Deosebirea gradient / variație • Principiul al II-lea: II-lea ∆S ≥ 0 (variația entropiei) – Procese reversibile / ireversibile, exemplu – Relația cu “ordinea”, demonul lui Maxwell – Particularitățile proceselor biologice: • crește ordinea, entropia scade! (? ? ) Curs 2 Bioinformatica 18

Forțe termodinamice • Forțe termodinamice generalizate, fluxuri td: • • • ∆p (presiune) – flux de volum (curgere) ∆T (temperatură) – flux de căldură ∆E (potențial electric) – curent electric ∆C (concentrație) – difuziune ∆π (presiune osmotică) – osmoză ∆μ (potențial chimic) – reacție chimică • Legea Nernst-Planck pentru fluxuri t. d. Curs 2 Bioinformatica 19

Procese cuplate • Cicluri naturale • Laturile metabolismului: metabolismului – Catabolism (degradare, exoenergetic, ∆S > 0) – Anabolism (sinteză, endoenergetic, ∆S < 0 ) • Termodinamica proceselor biologice • Prigogine (Premiul Nobel 1971) – Randamentul termic al proceselor biologice (55%) – Substanțe macroergice (ATP, GTP) – Fosforilarea oxidativă – mitocondrii • Pompa de protoni (Mitchell, premiul Nobel 1974) Curs 2 Bioinformatica 20

Fenomene de transport • Curgerea, convecția – Presiune hidrostatică și dinamică – Flux de soluție (∆p); legea lui Bernoulli • Difuziunea – Substanța dizolvată (∆C) – Legile lui Fick • Osmoza – Moleculele de solvent, printr-o membrană semipermeabilă (∆π) Curs 2 Bioinformatica 21

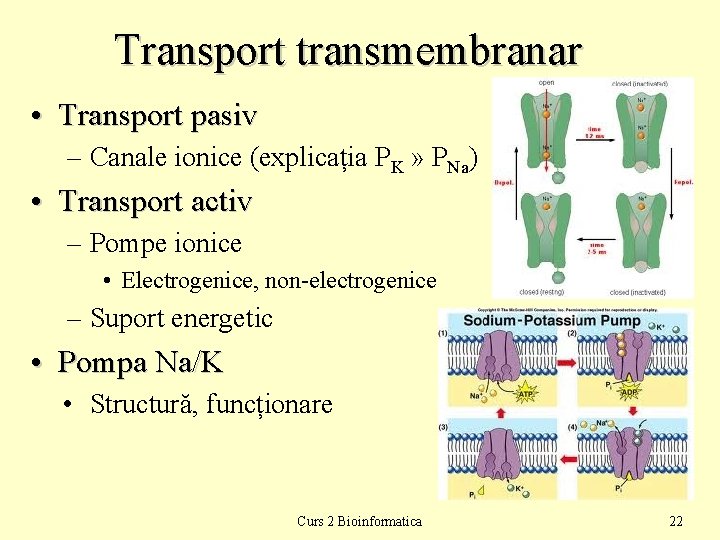
Transport transmembranar • Transport pasiv – Canale ionice (explicația PK » PNa) • Transport activ – Pompe ionice • Electrogenice, non-electrogenice – Suport energetic • Pompa Na/K • Structură, funcționare Curs 2 Bioinformatica 22

PAUZA Curs 2 Bioinformatica 23
 Evidena
Evidena Sisteme informatice integrate erp
Sisteme informatice integrate erp Sisteme informatice in asistenta primara
Sisteme informatice in asistenta primara Mariri umft
Mariri umft Master politehnica
Master politehnica Master politehnica
Master politehnica Master politehnica
Master politehnica Timioara
Timioara Timioara
Timioara Timioara
Timioara Kui negatiivse arvu aste on negatiivne, siis
Kui negatiivse arvu aste on negatiivne, siis Siis
Siis Lauseelement
Lauseelement Geomeetriliselt on arvu absoluutväärtus
Geomeetriliselt on arvu absoluutväärtus Vuce siis
Vuce siis Auditul sistemelor informatice
Auditul sistemelor informatice Proiectarea sistemelor informatice
Proiectarea sistemelor informatice Integrarea sistemelor informatice
Integrarea sistemelor informatice Facultatea de inginerie electrica bucuresti
Facultatea de inginerie electrica bucuresti Universitatea lucian blaga sibiu contact
Universitatea lucian blaga sibiu contact Facultatea electronica bucuresti
Facultatea electronica bucuresti Facultate electronica
Facultate electronica Politehnica university of timișoara phone
Politehnica university of timișoara phone Automatica si calculatoare politehnica bucuresti
Automatica si calculatoare politehnica bucuresti