Universita degli Studi Corsi di Laurea in Scienze
















- Slides: 22

Universita’ degli Studi Corsi di Laurea in Scienze Chimiche e dell’Insubria Chimica Industriale Termodinamica Chimica Boltzmann e Microstati dario. bressanini@uninsubria. it http: //scienze-como. uninsubria. it/bressanini

Entropia n n n L’ Entropia puo’ essere vista come una funzione che descrive il numero di arrangiamenti possibili (dell’energia e della materia) che sono disponibili La Natura procede spontaneamente verso gli stati che hanno maggior probabilita’ di esistenza. Queste osservazioni sono le basi della Termodinamica Statistica (che vedrete il prossimo anno) © Dario Bressanini

Microstati e Macrostati n n La Termodinamica Classica classifica gli stati in base alle caratteristiche macroscopiche La Termodinamica Statistica utilizza i microstati (stati microscopici) ´ ´ n Microstato: posizione e momento di ogni molecola Macrostato: (p, V, T) Molteplicita’: il numero di microstati corrispondenti ad un unico macrostato © Dario Bressanini

Ipotesi fondamentale Ogni microstato ha la stessa probabilita’ di esistere Come nel lancio dei dadi © Dario Bressanini

Ordine, Disordine e caso © Dario Bressanini

Analogia: lanciando I Dadi n n Lanciando un dado: 1/2/3/4/5/6 sono egualmente probabili Lanciando due dadi: ´ ´ n Per ognuno 1/2/3/4/5/6 egualmente probabili La somma 7 e’ piu’ probabile rispetto a 6 o 8 Perche’? 6 combinazioni (microstati) danno 7 (il macrostato): 1+6, 2+5, 3+4, 4+3, 5+2, 6+1. Ci sono 5 combinazioni che danno 6 o 8, etc. © Dario Bressanini

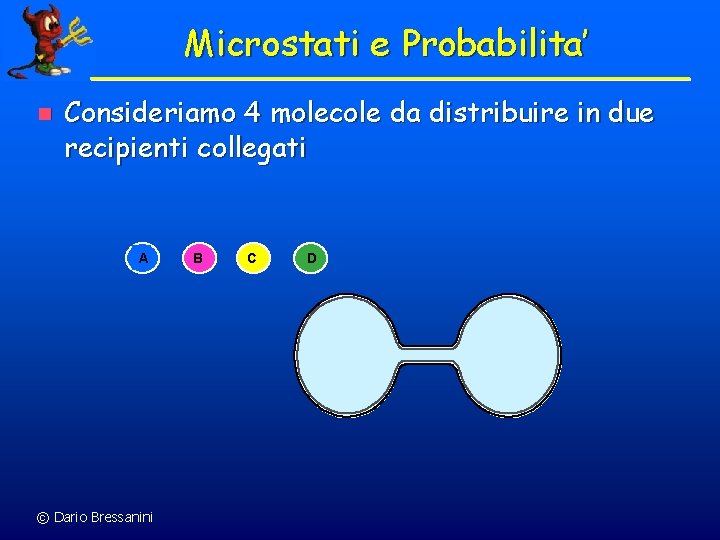
Microstati e Probabilita’ n Consideriamo 4 molecole da distribuire in due recipienti collegati A © Dario Bressanini B C D

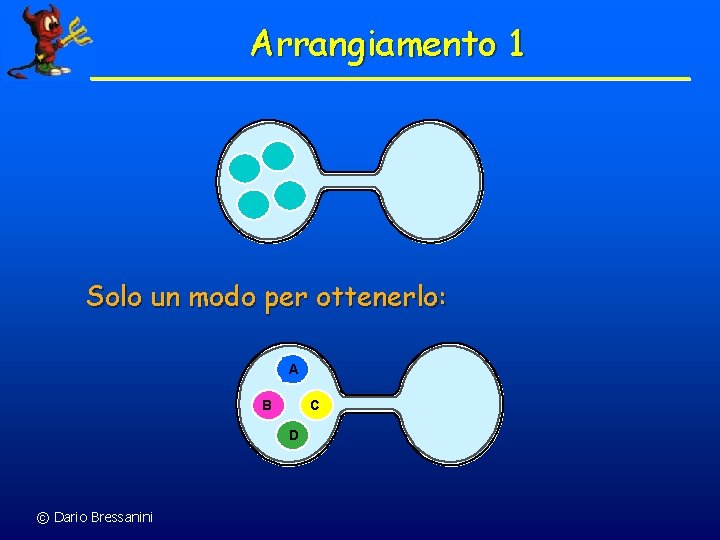
Arrangiamento 1 Solo un modo per ottenerlo: A B C D © Dario Bressanini

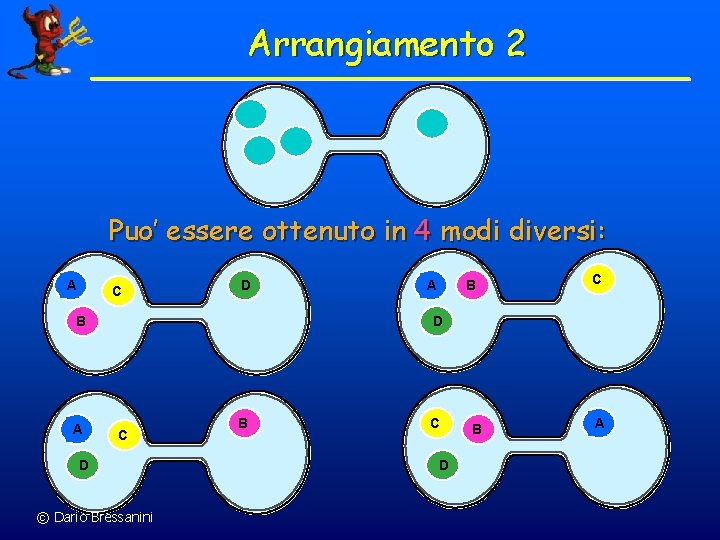
Arrangiamento 2 Puo’ essere ottenuto in 4 modi diversi: A C D B A A B C D © Dario Bressanini B C D B A

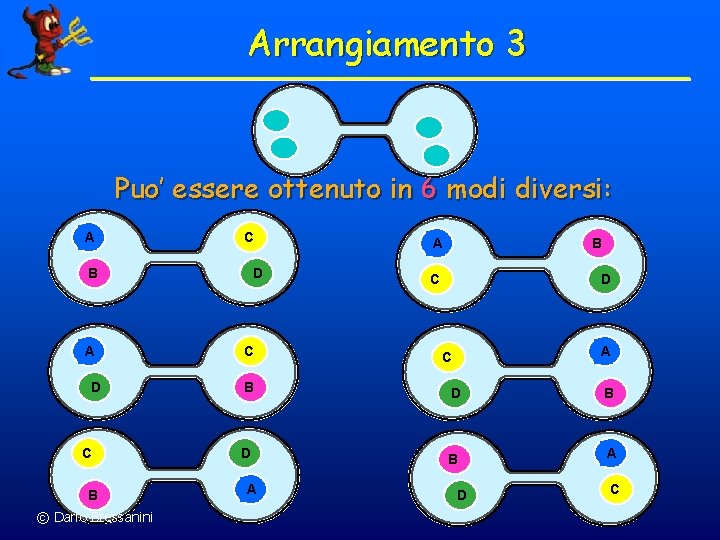
Arrangiamento 3 Puo’ essere ottenuto in 6 modi diversi: A C B A D C B © Dario Bressanini D C A B D C A C B D B A A D C

Entropia n n Boltzmann defini’ una grandezza che misura la probabilita’ di un macrostato: l’Entropia. Le sostanze tendono a raggiungere lo stato piu’ probabile. Lo stato piu’ probabile spesso (ma non sempre) e’ il ‘piu’ casuale’ E’ necessario calcolare il numero di arrangiamenti possibili (si utilizza la statistica)

S = k log. W n n n Boltzmann ha collegato calore, temperatura, molteplicita’ e probabilita’ Entropia definita da S = k ln W W: molteplicita’; k: costante di Boltzmann Epitaffio di Boltzmann: S = k ln W © Dario Bressanini

Probabilita’ dei Macrostati Le probabilita’ relative degli arrangiamenti 1, 2 e 3 sono: 1: 4 : 6 Quindi S 3 > S 2 > S 1 © Dario Bressanini

© Dario Bressanini

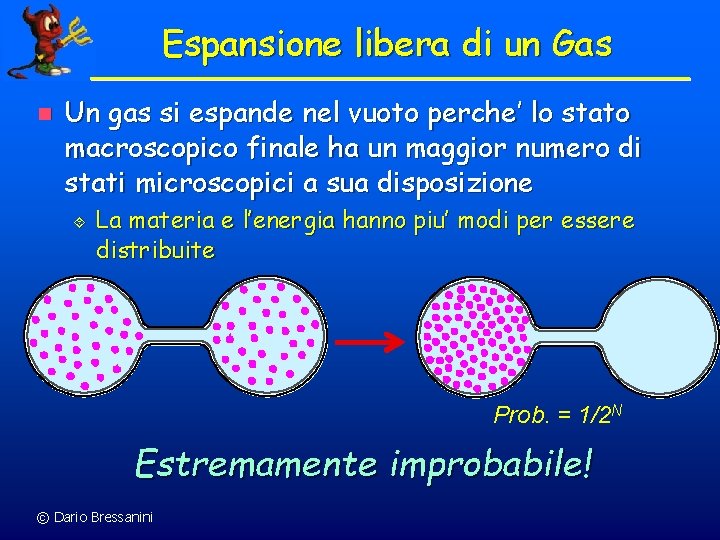
Espansione libera di un Gas n Un gas si espande nel vuoto perche’ lo stato macroscopico finale ha un maggior numero di stati microscopici a sua disposizione ´ La materia e l’energia hanno piu’ modi per essere distribuite Prob. = 1/2 N Estremamente improbabile! © Dario Bressanini

Probabilita’ ed Equilibrio n n n Le molecole si muovono casualmente nei due recipienti Dopo un certo tempo, ogni molecola ha probabilita’ ½ di trovarsi in uno dei due La distribuzione piu’ probabile e’ quella con circa il 50% delle molecole in ogni recipiente Estremamente probabile! © Dario Bressanini

Seconda Legge della Termodinamica n Versione microscopica: Un sistema isolato con molte molecole, evolvera’ verso il macrostato con la piu’ grande molteplicita’, e rimarra’ in quel macrostato © Dario Bressanini

Seconda Legge della Termodinamica n Versione macroscopica: Esiste una funzione di stato chiamata Entropia (simbolo S) che descrive i processi spontanei Un sistema isolato evolve per raggiungere uno stato di massima entropia © Dario Bressanini

Seconda Legge della Termodinamica n n La seconda legge puo’ essere espressa in molti modi. Uno e’ L’entropia dell’Universo aumenta sempre. ´ ´ n Questa legge, ingannevolmente semplice, e’ sufficiente a spiegare tutti i processi spontanei. La variazione di entropia dell’Universo include il DS del sistema e il DS dell’Ambiente. Per una singola sostanza, l’entropia aumenta se ´ ´ La sostanza viene riscaldata, perche’ questo aumenta il numero di stati energetici accessibili e il disordine molecolare La sostanza si espande, poiche’ questo aumenta lo spazio disponibile entro cui le molecole possono distribuirsi. © Dario Bressanini

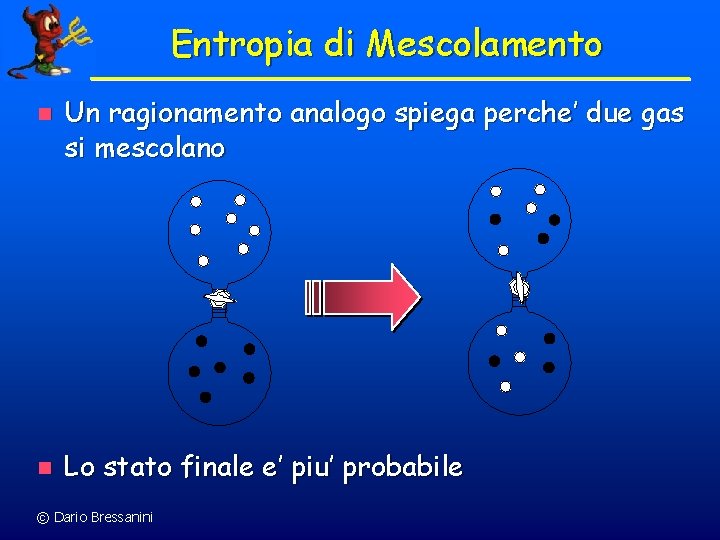
Entropia di Mescolamento n n Un ragionamento analogo spiega perche’ due gas si mescolano Lo stato finale e’ piu’ probabile © Dario Bressanini

Entropia Macroscopica Come esprimiamo l’Entropia in termini puramente macroscopici? © Dario Bressanini

Fine
 Università degli studi roma tre mascotte
Università degli studi roma tre mascotte Università degli studi di genova erasmus
Università degli studi di genova erasmus Napoli
Napoli Kiro scienze del farmaco
Kiro scienze del farmaco Università degli studi di firenze psicologia
Università degli studi di firenze psicologia Scienze motorie pisa
Scienze motorie pisa Corso di laurea in scienze della formazione primaria
Corso di laurea in scienze della formazione primaria Unibs scienze motorie piano di studi
Unibs scienze motorie piano di studi Coni corsi campania
Coni corsi campania Irigem bassano del grappa
Irigem bassano del grappa Cescot rimini corsi
Cescot rimini corsi Studiare unife my desk
Studiare unife my desk My tantra
My tantra Red team exercises
Red team exercises Dario bressanini università
Dario bressanini università Dario bressanini università
Dario bressanini università Università ecampus fi
Università ecampus fi Università di savigliano
Università di savigliano Dario bressanini università
Dario bressanini università Università liuc costi
Università liuc costi Scienze infermieristiche foligno
Scienze infermieristiche foligno Università san cirillo e metodio skopje
Università san cirillo e metodio skopje Università firenze
Università firenze