UNIDADES DE CONCENTRACIN PARTE II 11 MO GRADO












- Slides: 16

UNIDADES DE CONCENTRACIÓN PARTE II 11 MO GRADO QUIMICA

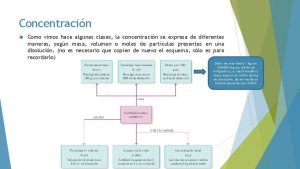
CONCENTRACIÓN Y PROPIEDADES COLIGATIVAS §Son las propiedades que dependen de la cantidad de soluto pero no del tipo de soluto presente en una solución. §Estas son: § Disminución en la presión de vapor § Elevación en el punto de ebullición § Disminución en el punto de congelación § Presión osmótica

DISMINUCIÓN EN LA PRESIÓN DE VAPOR §La adición de un soluto no volátil a un solvente lleva a una disminución en la presión de vapor de la solución resultante en comparación con el solvente puro. §Ley de Raoult PA = P°A XA §Donde: § PA = presión parcial de la solución § P°A = presión parcial del solvente puro § XA = fracción molar del solvente

EJERCICIO A 25ºC la presión de vapor del agua es 23. 76 mm. Hg. Determine la presión de vapor a 25ºC de la solución que se prepara añadiendo 5. 67 g de C 6 H 12 O 6 (Mmolar=180 g/mol) en 25. 2 g H 2 O (Mmolar=18. 02 g/mol).

ELEVACIÓN EN EL PUNTO DE EBULLICIÓN Y DISMINUCIÓN EN EL PUNTO DE CONGELACIÓN

EJERCICIO Determine el punto de ebullición y el punto de congelación de una solución que contiene 4. 76 g de etilenglicol (Mmolar=62. 07 g/mol) en 202 g H 2 O. Kb. H 2 O = 0. 52ºC/m y Kf. H 2 O = 1. 86ºC/m

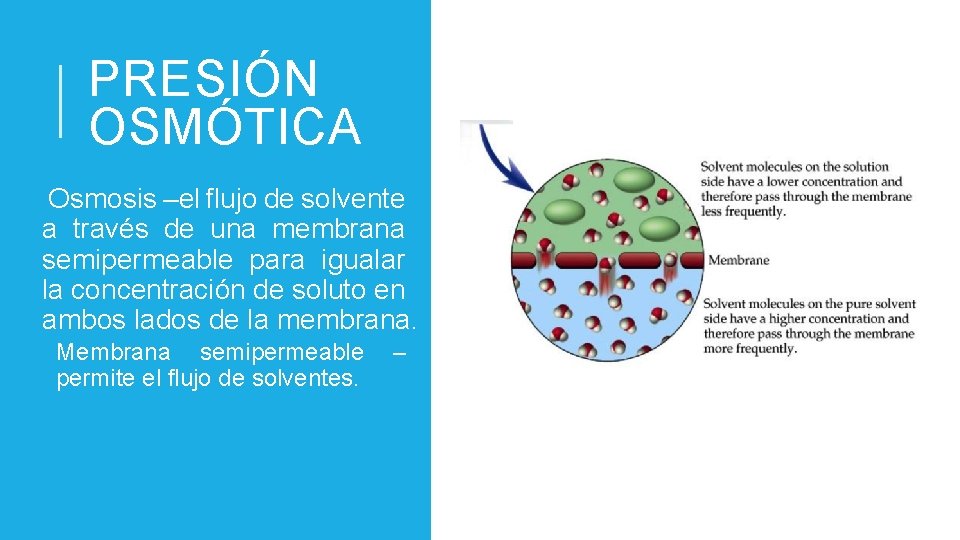
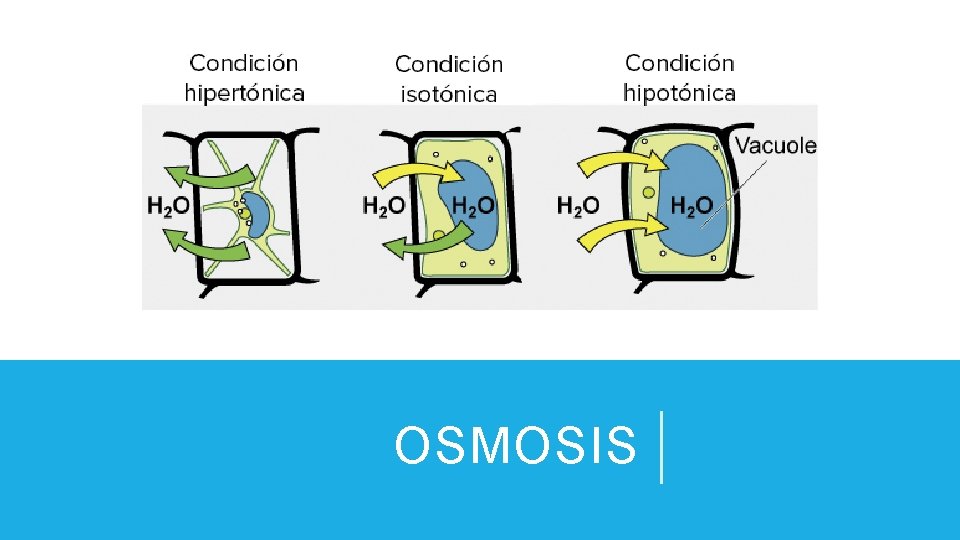
PRESIÓN OSMÓTICA §Osmosis –el flujo de solvente a través de una membrana semipermeable para igualar la concentración de soluto en ambos lados de la membrana. §Membrana semipermeable permite el flujo de solventes. –


OSMOSIS

COLOIDES §Dispersión de partículas de una sustancia en otra sustancia o solución. §Dos fases: § Fase dispersa § Fase continua §Efecto Tyndall – reflejo de la luz por las partículas coloides. § Coloide hidrofílico - son coloides que se dispersan fácilmente en agua. § Coloide hidrofóbico – no son coloides que se dispersan fácilmente en agua.

TIPOS DE COLOIDES 1. Aerosol - gotas de líquido o sólido disperso en un gas. Ej. niebla, humo. 2. Emulsión - Emulsión-gotas de líquido dispersas en otro líquido o sólido. Ej. leche, mayonesa, mantequilla. 3. Sólidos - partículas sólidas dispersas en líquido o sólido. Ej. pintura, vidrio, rubí.

CALCULAR DILUCIONES §Utilizando conjuntos proporcionales; utilizadas para calcular un desconocido donde dos soluciones son mezclas proporcionales. §C 1 v 1 = concentración inicial y volumen inicial §C 2 V 2 = concentración final y volumen final


Step 2: Transpose for x and solve Example 2 3. Substitute Quantities If a 15 m. L dose of a product contains 300 mg of ingredient B, how much will be contained in 500 m. L ? Calculate the quantity of a concentration needed to produce a different final desired concentration and volume (a serial dilution). Method Example 1 Step 1: Use c 1/v 1= c 2/v 2 How much 10% solution is needed to make up 500 m. L of a 2% solution? Method NB: In this case we use C 1 x V 1 = C 2 x V 2 Step 2: Transpose for x and solve Step 1: Use c 1 x v 1= c 2 x v 2 2. Equivalent Strengths Converting from one measure of strength to another. Step 2: Transpose for x and solve Example 1 What is 1 part in 20 expressed as a percentage? Method Example 2 Step 1: Use c 1/v 1= c 2/v 2 How much 5% solution is needed to make up 80 ml of a 0. 4% solution? Method Step 1: Use c 1 x v 1= c 2 x v 2 Step 2: Transpose for x and solve Example 2 What is 0. 25% expressed as a ratio strength? Method Step 1: Use c 1/v 1= c 2/v 2 Step 2: Transpose for x and solve

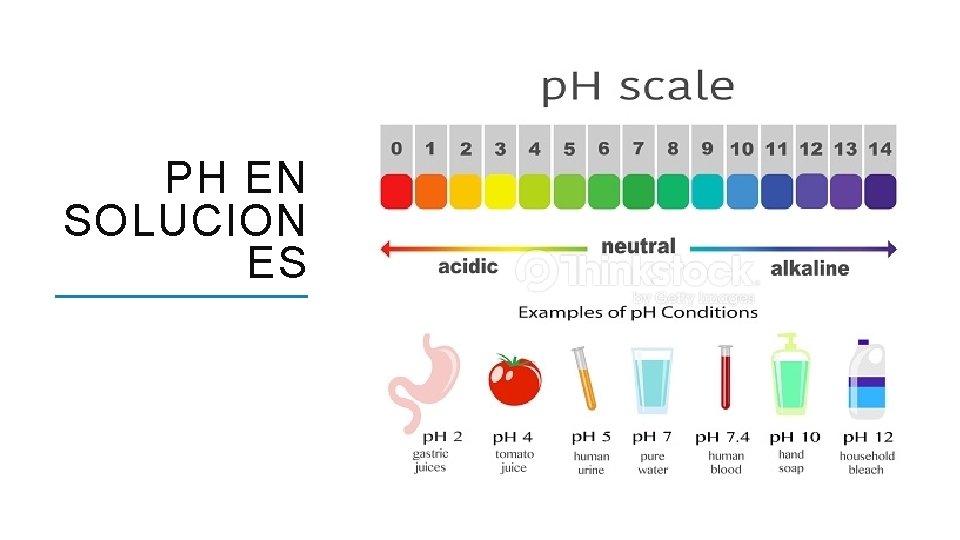
PH EN SOLUCION ES

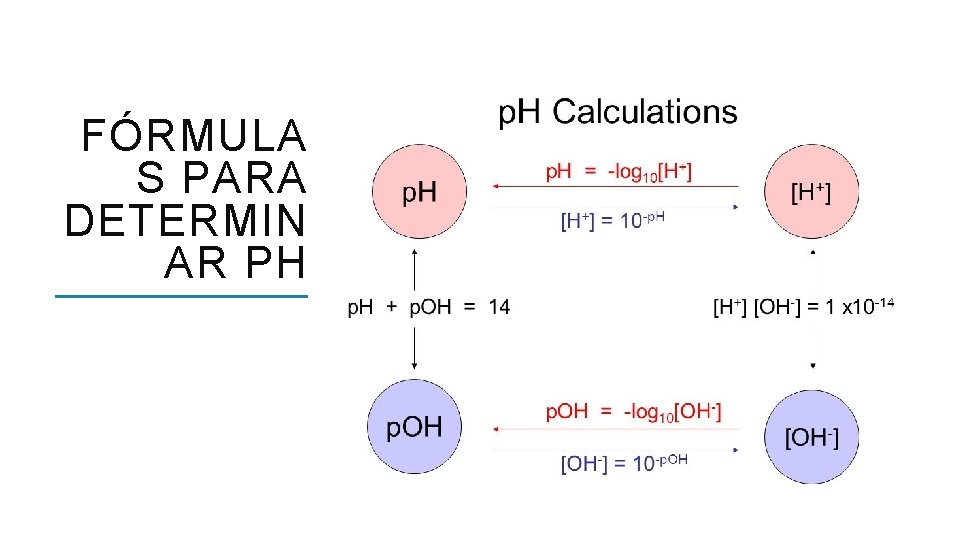
FÓRMULA S PARA DETERMIN AR PH
 Decena centena unidad
Decena centena unidad Expresiones algebraicas grado absoluto y relativo
Expresiones algebraicas grado absoluto y relativo Como multiplicar decimales
Como multiplicar decimales Partes da missa
Partes da missa Te invitamos a ser parte
Te invitamos a ser parte Este parte aquele parte
Este parte aquele parte Glicocálix
Glicocálix Unidades wood resistencia pulmonar
Unidades wood resistencia pulmonar Equivalencia pulgadas mm tuberías polietileno
Equivalencia pulgadas mm tuberías polietileno Fórmula molalidad
Fórmula molalidad Byte medidas
Byte medidas Grandezas
Grandezas Conversao de unidades
Conversao de unidades Deci centi milli micro nano pico femto atto zepto yocto
Deci centi milli micro nano pico femto atto zepto yocto Ejemplos de m
Ejemplos de m Unidades de medid
Unidades de medid Calidad lectora
Calidad lectora