Unidades de Concentracin Profesor Julio Molina A Qumica











- Slides: 12

Unidades de Concentración Profesor Julio Molina A. Química 4° Medios A, B, C, D y. F

Unidades de concentración � %m/m � %m/v � %v/v � ppm � Molaridad M � Molalidad m

� Se puede medir concentraciones dependiendo de la masa y del volumen de la disolución (solución) usando concentraciones %. � También se puede usar el número de avogadro 6, 02 X 10 para establecer concentración basadas en la cantidad de moles. � Mol; cantidad de sustancia � Concepto que fue introducido por los científicos, para poder masar entidades elementales (átomos, iones, moléculas ). recordemos que estamos trabajando con sustancias que no son visibles al ojo humano.

� 1 mol = 6, 02 x 10 EE � Como 1 docena son 12 unidades � 1 resma de papel son 500 hojas

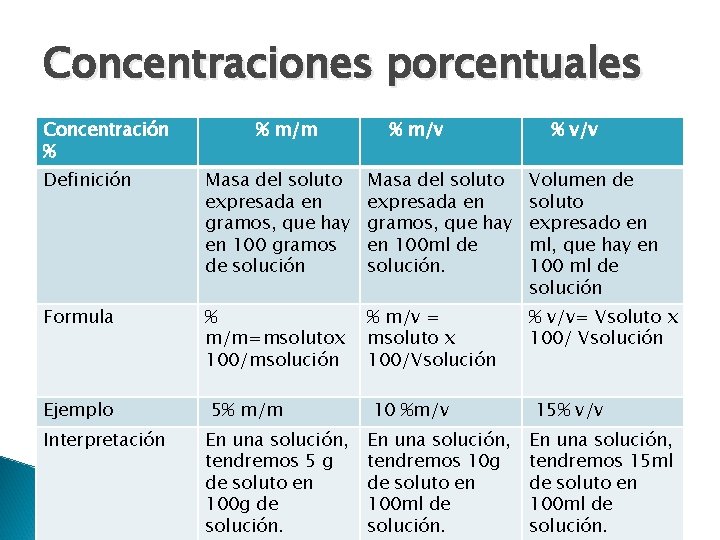
Concentraciones porcentuales Concentración % % m/m % m/v % v/v Definición Masa del soluto expresada en gramos, que hay en 100 gramos de solución Masa del soluto expresada en gramos, que hay en 100 ml de solución. Volumen de soluto expresado en ml, que hay en 100 ml de solución Formula % m/m=msolutox 100/msolución % m/v = msoluto x 100/Vsolución % v/v= Vsoluto x 100/ Vsolución Ejemplo Interpretación 5% m/m En una solución, tendremos 5 g de soluto en 100 g de solución. 10 %m/v En una solución, tendremos 10 g de soluto en 100 ml de solución. 15% v/v En una solución, tendremos 15 ml de soluto en 100 ml de solución.

Ejemplos de concentraciones % �% m/m � ¿cuál será la concentración en % m/m? si se disuelven 10 g de Na. Cl en 200 g de agua. Primero, reconocer datos: masa del soluto 10 g de Na. Cl masa del disolvente(solvente) 200 g H₂O masa Solución= msoluto + msolvente 10 g+200 g= 210 g % m/m= 10 gx 100/210 g= 4. 8% Interpretación: En 100 g de solución hay 4. 8 g de Na. Cl

Calculos con otra incognita � Una muestra de agua de mar tiene un 5. 3% m/m en sales ¿cuál es la cantidad de solvente que tiene? � Datos: 5. 3%, significa 5. 3 g de soluto en 100 g de solución. � Resultado msolución= msoluto+msolvente 100 g = 5. 3 g + X X = 100 g - 5. 3 g = 94. 7 g

Ejemplos de % m/v � Se disuelven 20 g de KCl en 200 ml de agua¿cuál será su concentración m/v? � Datos masa del soluto= 20 g volumen del solvente= 200 ml -20 g/200 mlx 100% 0. 6 x 100 = 10% m/v Interpretación: en 100 ml de solución, hay 10 g de soluto

Ejemplo de % v/v � Si preparo una solución desinfectante, utilizando 20 ml de cloro en 500 ml de agua ¿cuál es la concentración v/v de la solución? � Datos Vsoluto = 20 ml Vsolución= 500 ml 20 ml/500 ml x 100% 0, 04 x 100% = 4% v/v Interpretación: en 100 ml de solución hay 4 ml de soluto (Cloro).

� ¿Cómo se calcula la MM de un compuesto? � Se toman las masas atómicas de los elementos Respectivos, desde la tabla periódica. � RECORDAR: Cuando hay decimales se aproxima la décima a un número entero. � Ejemplo, calcular la MM del Na. Cl � Masas atómicas Na 23 g/mol y Cl 36 g/mol � Se suman 23 g/mol + 36 g/mol = 59 g/mol � Se lee; 1 mol de Na. Cl, tiene una masa de 59 gramos.

Concentraciones basadas en la cantidad de moles � Mol= cantidad de sustancia � Algunas calculos. formulas que usaremos, para realizar MM= m/n° donde m es la masa y n° el número de moles y MM la masa molar n°= m/MM

Masa Molar MM= m/n° m= masa n°= número de moles Si la masa atómica del Ca es 40 g/mol y del Cl es 35, 5 g/mol Significa que 1 mol de calcio tiene una masa de 40 gramos Cl se aproxima a 36 g/mol (se debe trabajar con números enteros). Significa que 1 mol de Cloro, tiene una masa de 36 g. Calcular la MM del Ca. Cl₂ 1 at de Ca 40 g/mol 1 at de Cl 36 g/mol X 2 (tiene 2 átomos) 72 g/mol MM = 112 g/mol Interpretación del resultado: 1 mol de Ca. Cl₂ tiene una masa de 112 g.