UNACH FACULTAD DE CIENCIAS QUMICAS EXTENSIN OCOZOCOAUTLA INTEGRANTES
























- Slides: 36

UNACH FACULTAD DE CIENCIAS QUÍMICAS EXTENSIÓN OCOZOCOAUTLA INTEGRANTES: MORENO ENTZÍN DIANA CRISTINA HERRERA SÁNCHEZ FÁTIMA DEL CARMEN FACILITADORA: DRA. ANA CAÑAS TAREA: 3

Chymotrypsin/Quimiotripsina E. C. 3. 4. 21. 1 BRENDA. (Enero de 2015). BRENDA. Obtenido de http: //www. brendaenzymes. org/enzyme. php? ecno=3. 4. 21. 1& Suchword=&organism%5 B%5 D=&show_tm

• En su forma de zimógeno se llamará: quimiotripsinógeno • Por acción de otra enzima llamada tripsina hará que tenga su forma activa y será llamada: quimiotripsina Wikipedia. (18 de Diciembre de 2014). Wikipedia. Obtenido de http: //es. wikipedia. org/wiki/Quimotripsina

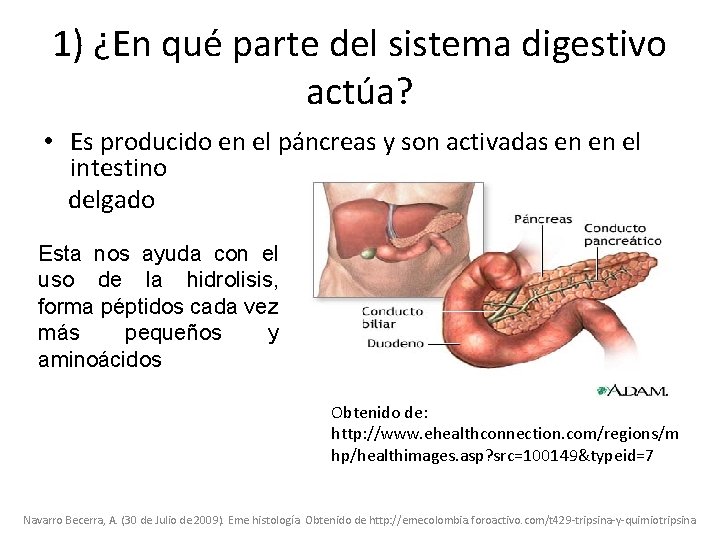
1) ¿En qué parte del sistema digestivo actúa? • Es producido en el páncreas y son activadas en en el intestino delgado Esta nos ayuda con el uso de la hidrolisis, forma péptidos cada vez más pequeños y aminoácidos Obtenido de: http: //www. ehealthconnection. com/regions/m hp/healthimages. asp? src=100149&typeid=7 Navarro Becerra, A. (30 de Julio de 2009). Eme histología. Obtenido de http: //emecolombia. foroactivo. com/t 429 -tripsina-y-quimiotripsina

2) Clase http: //www. genome. jp/dbget-bin/www_bget? ec: 3. 4. 21. 1 http: //www. brenda-enzymes. org/enzyme. php? ecno=3. 4. 21. 1&Suchword=&organism%5 B%5 D=&show_tm=0#RECOMMENDED NAME

https: //www. youtube. com/watch? v=3 gj. Z 6 hzk 5 s Y

3) Tipos http: //enzyme. expasy. org/EC/3. 4. 21. 1

http: //www. genome. jp/dbget-bin/www_bget? ec: 3. 4. 21. 1

http: //www. brenda-enzymes. org/enzyme. php? ecno=3. 4. 21. 1

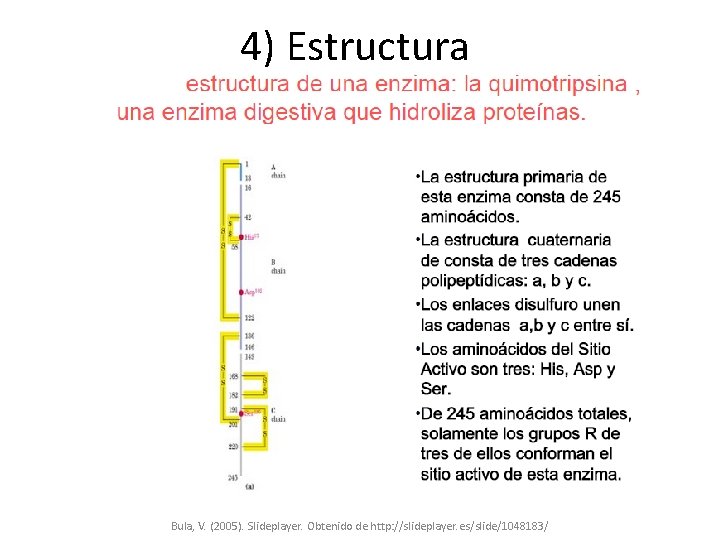
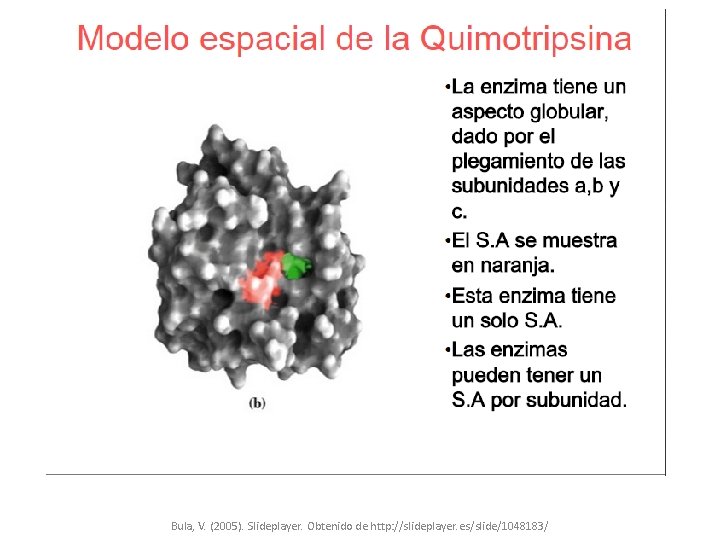
4) Estructura Bula, V. (2005). Slideplayer. Obtenido de http: //slideplayer. es/slide/1048183/

Bula, V. (2005). Slideplayer. Obtenido de http: //slideplayer. es/slide/1048183/

Bula, V. (2005). Slideplayer. Obtenido de http: //slideplayer. es/slide/1048183/

5) Secuencia proteica http: //www. genome. jp/dbget-bin/www_bget? hsa: 1504

Secuencia genética http: //www. genome. jp/dbget-bin/www_bget? hsa: 1504

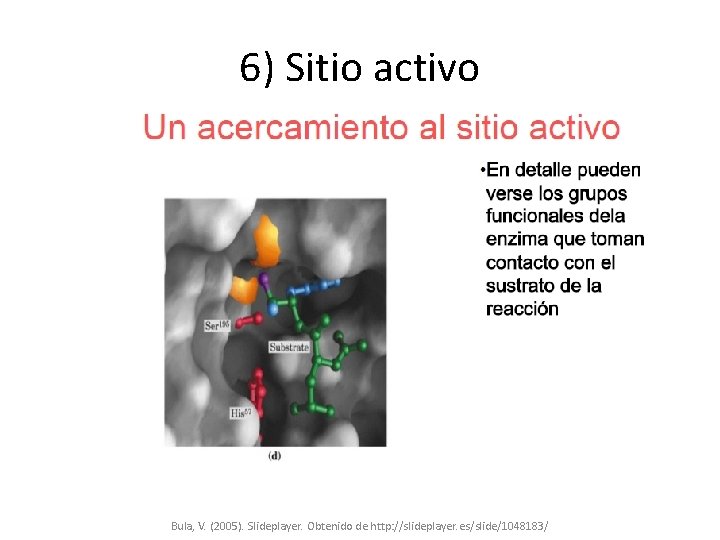
6) Sitio activo Bula, V. (2005). Slideplayer. Obtenido de http: //slideplayer. es/slide/1048183/

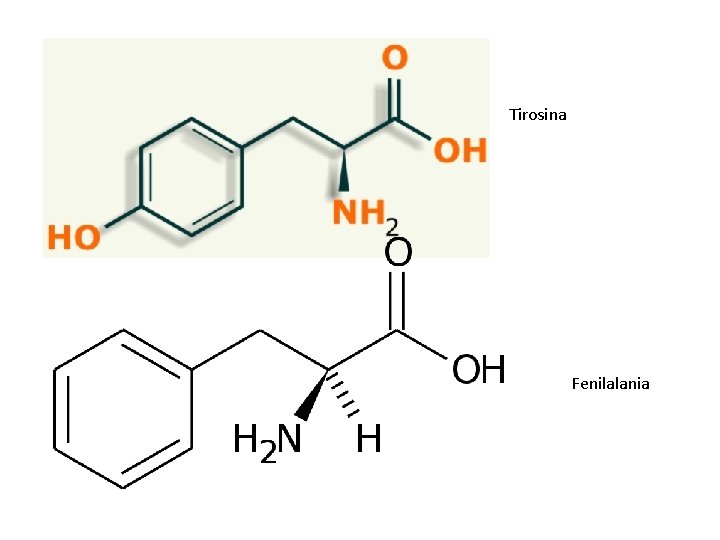
ESPECIFICIDAD Centro activo: el tamaño y características del bolsillo determinan tipo de enlace peptídico que hidrolizan • En las tres proteasas (quimotripsina, tripsina y elastasa) se diferenciaran en su especificidad; la quimotripsina tiene un bolsillo grande que puede acomodar las cadenas hidrofóbicas de la fenilalanina, tirosina y triptofano, y así cataliza la hidrólisis de péptidos y ésteres de estos aminoácidos. A. Quimiotripsina. (2015).

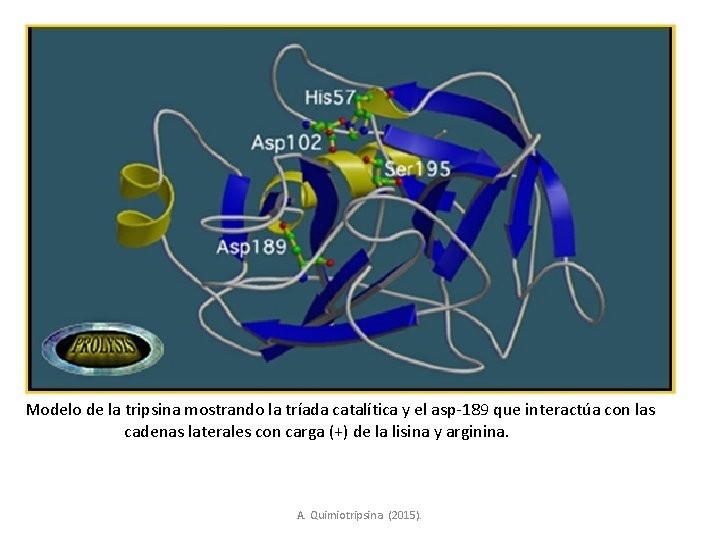
Modelo de la tripsina mostrando la tríada catalítica y el asp-189 que interactúa con las cadenas laterales con carga (+) de la lisina y arginina. A. Quimiotripsina. (2015).

Diferencia estructural • La tripsina tiene un aspartato (189), en vez de la ser-189 de la quimotripsina, que forma un puente salino con las cadenas de lisina y arginina, aminoácidos sobre los cuales actúa la tripsina. La elastasa acomoda cadenas hidrofóbicas pequeñas, la zona externa del bolsillo está parcialmente bloqueada por las además laterales de val-216 y treo-226, en la quimotripsina en ambas posiciones hay una glicina A. Quimiotripsina. (2015) https: //www. google. com. mx/url? sa=t&rct=j&q=&esrc=s&source=web&cd=3&cad=rja&uact=8&ved=0 CCg. QFj. AC&url=http%3 A%2 F%2 Fwww. curs os. ucv. cl%2 Fbqa 34201%2 FC-Catalizadores%2 FAQuimotripsina. doc&ei=d_j 4 VIKg. DJDho. AT 6 h. IDABw&usg=AFQj. CNHVJDWo 4 e. H 7 Zbtm 4 wx 9 Z 5 l. Zoof 1_Q&sig 2=VJWOqj. Csrt. Unb. KW 2 Jx. QPj. A&bvm=bv.

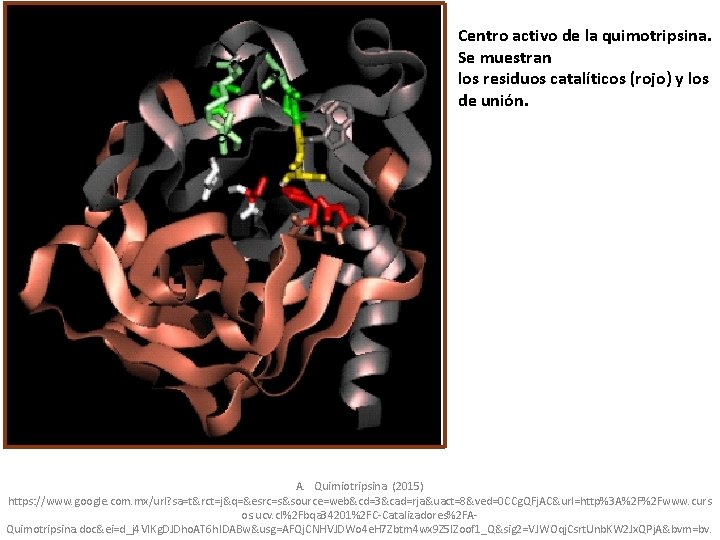
Residuos catalíticos • • Se encuentran: His 57 Ser 195 Asp 109 http: //gmein. uib. es/otros/enzimas/Jmoldesarrollo/quimotripsinajmol. html

Centro activo de la quimotripsina. Se muestran los residuos catalíticos (rojo) y los de unión. A. Quimiotripsina. (2015) https: //www. google. com. mx/url? sa=t&rct=j&q=&esrc=s&source=web&cd=3&cad=rja&uact=8&ved=0 CCg. QFj. AC&url=http%3 A%2 F%2 Fwww. curs os. ucv. cl%2 Fbqa 34201%2 FC-Catalizadores%2 FAQuimotripsina. doc&ei=d_j 4 VIKg. DJDho. AT 6 h. IDABw&usg=AFQj. CNHVJDWo 4 e. H 7 Zbtm 4 wx 9 Z 5 l. Zoof 1_Q&sig 2=VJWOqj. Csrt. Unb. KW 2 Jx. QPj. A&bvm=bv.

7) ¿Grupo prostético? La enzima quimotripsina si es perteneciente al grupo prostético ya que tiene enlaces covalentes y además hemos de recordar que para ser coenzima se modifican en una reacción química. Los grupos prostéticos partician en reacciónes redox, transaminación, descarboxilación y desaminación

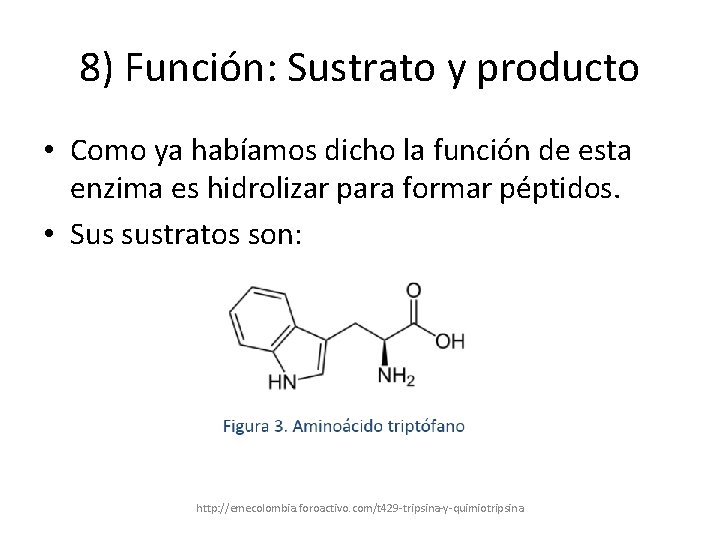
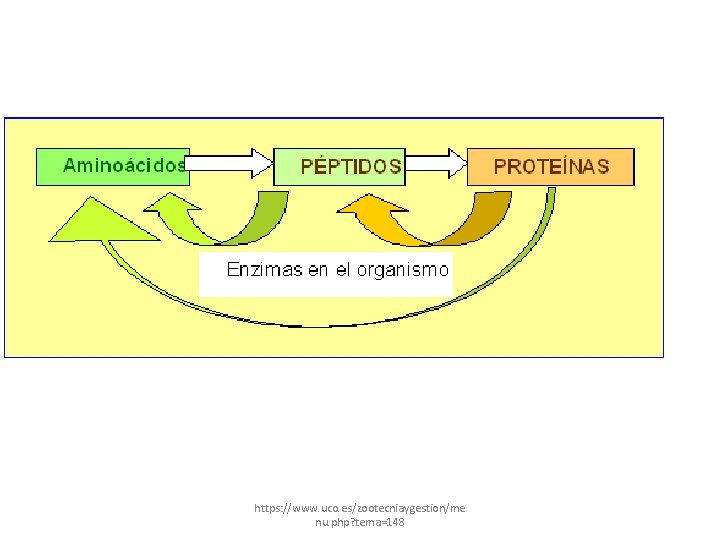
8) Función: Sustrato y producto • Como ya habíamos dicho la función de esta enzima es hidrolizar para formar péptidos. • Sus sustratos son: http: //emecolombia. foroactivo. com/t 429 -tripsina-y-quimiotripsina

Tirosina Fenilalania


• Son hidrolizados en el carboxilo terminal • Muchas enzimas proteasas como esta hidrolizan también enlaces éster “in vitro”, usan sustratos que son análogos como: éster N-acetil-L-fenilalanina-p-nitrofeni http: //emecolombia. foroactivo. com/t 429 -tripsina-y-quimiotripsina

https: //www. uco. es/zootecniaygestion/me nu. php? tema=148

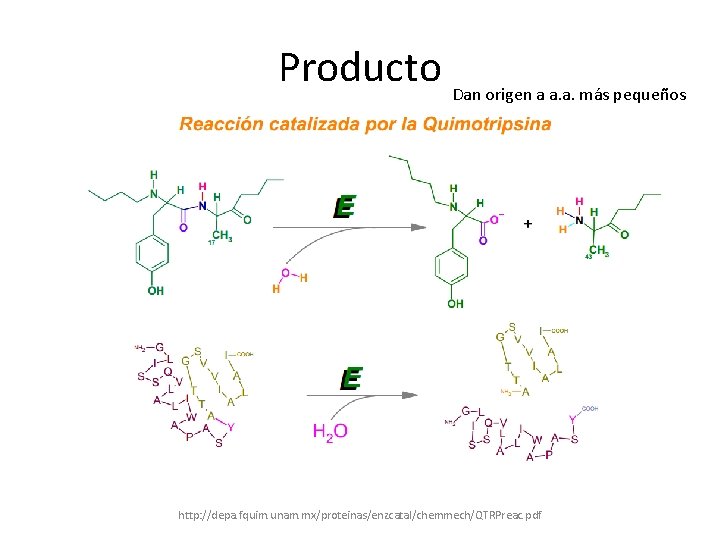
• Para que ésta enzima actúe consta de dos pasos: • Se acila el sustrato para formar un intermediario enzima acilada que liego perderá su grupo acil y así la enzima regresará a su estado original https: //www. uco. es/zootecniaygestion/me nu. php? tema=148

Producto Dan origen a a. a. más pequeños http: //depa. fquim. unam. mx/proteinas/enzcatal/chemmech/QTRPreac. pdf

9) Inhibidores, activadores, p. H, temperatura óptima • Inhibidores: Existen diferentes tipos de inhibidores pero para inhibir a la quimiotripsina especialmente utilizamos el: éster etilico de la D- tirosina *inhibidor competitivo Otro inhibidor de la quimiotripsina es la: fenilalanilclorometilcetona Para llevar a cabo su actividad inhibidora necesitaran tener condiciones como p. H de 3 -10 y una temperatura de 0 -50 °C Myron I. , B. , & Lewis J, B. (1977). Catálisis y acción enzimatica. España: Reverté.

Activación Se parte gracias a la tripsina como resultando dará dos partes que seguirán unidad por enlaces S-S, estas moléculas activan a otras. La molécula resultante es la quimiotripsina en forma activa con enlaces disulfuro http: //emecolombia. foroactivo. com/t 429 -tripsina-y-quimiotripsina

p. H • La quimiotripsina actúa mejor en un medio alcalino, entre los niveles de p. H de 7, 0 y 9, 0. Temperatura óptima Necesitan un medio favorable de 37 grados centígrados http: //www. livestrong. com/es/enzimaspepsina-quimotripsina-info_1633/

10) Manipulaciones comerciales • RIBOTRIPSIN • Actúa como analgésico retardado. • Estimulan los receptores del dolor • Reducción edema que conduce a la disminución de la presión sobre el nervio, al alivio del dolor. http: //mx. prvademecum. com/producto. ph p? producto=2736

¿Enfermedades? • Fibrosis quística: Evita que el páncreas produzca sus enzimas digestivas normales para que no se consuma a si mismo. En la mayoría de los casos, este problema aparece durante los primeros años de vida. • La quimiotripsina causa aumento de la vasodilatación y permeabilidad capilar la cual contribuye al shock http: //carefirst. staywellsolutionsonline. co m/Spanish/Tests. Procedures/167, trypsin_ch ymotrypsin_cystic_fibrosis_ES

En el laboratorio • Tripsina/Quimotripsina (en heces): Es una prueba de laboratorio que indica la presencia de estas dos enzimas en heces • Los niveles anormales de tripsina o quimotripsina significan que su páncreas no está funcionando correctamente. http: //carefirst. staywellsolutionsonline. co m/Spanish/Tests. Procedures/167, trypsin_ch ymotrypsin_cystic_fibrosis_ES

Referencias • • • (s. f. ). Obtenido de http: //emecolombia. foroactivo. com/t 429 -tripsina-yquimiotripsina A. Quimiotripsina. (2015). Berruecos Zahuantitla, O. (08 de Septiembre de 2014). Youtube. Obtenido de https: //www. youtube. com/watch? v=3 gj. Z 6 hzk 5 s. Y BRENDA. (Enero de 2015). BRENDA. Obtenido de http: //www. brendaenzymes. org/enzyme. php? ecno=3. 4. 21. 1&Suchword=&organism%5 B%5 D=&show _tm=0 Bula, V. (2005). Slideplayer. Obtenido de http: //slideplayer. es/slide/1048183/ Dubois, S. (2013). Livestrong. Obtenido de http: //www. livestrong. com/es/enzimaspepsina-quimotripsina-info_1633/ Enzyme. (s. f. ). Obtenido de http: //enzyme. expasy. org/EC/3. 4. 21. 1 Gmeil. (s. f. ). Quimiotripsina. Obtenido de http: //gmein. uib. es/otros/enzimas/Jmoldesarrollo/quimotripsinajmol/quimotripsi najmol. html KEGG. (s. f. ). Obtenido de http: //www. genome. jp/dbgetbin/www_bget? ec: 3. 4. 21. 1

Referencias • Krames Stay. Well. (05 de Junio de 2012). Carefirst. Obtenido de http: //carefirst. staywellsolutionsonline. com/Spanish/Tests. Procedures/16 7, trypsin_chymotrypsin_cystic_fibrosis_ES • Myron I. , B. , & Lewis J, B. (1977). Catálisis y acción enzimatica. España: Reverté. • Navarro Becerra, A. (30 de Julio de 2009). Eme histología. Obtenido de http: //emecolombia. foroactivo. com/t 429 -tripsina-y-quimiotripsina • P. R. Vademecum. (2014). Obtenido de http: //mx. prvademecum. com/producto. php? producto=2736 • Rodríguez Sotres , R. (2015). Obtenido de http: //depa. fquim. unam. mx/proteinas/enzcatal/chemmech/QTRPreac. pdf • Universidad de Córdova. (s. f. ). UCO. Obtenido de https: //www. uco. es/zootecniaygestion/menu. php? tema=148 • Wikipedia. (18 de Diciembre de 2014). Wikipedia. Obtenido de http: //es. wikipedia. org/wiki/Quimotripsina
 Ciencias quimicas unach
Ciencias quimicas unach Qumicas
Qumicas Universidad de los andes facultad de ciencias
Universidad de los andes facultad de ciencias Facultad de ciencias economicas tucuman
Facultad de ciencias economicas tucuman Facultad de ciencias administrativas unmsm
Facultad de ciencias administrativas unmsm Universidad de el salvador facultad de ciencias economicas
Universidad de el salvador facultad de ciencias economicas University of pecs faculty of health sciences
University of pecs faculty of health sciences Universidad de el salvador facultad de ciencias economicas
Universidad de el salvador facultad de ciencias economicas Facultad de ciencias economicas tucuman
Facultad de ciencias economicas tucuman Unionpyme easy software contable gratuito
Unionpyme easy software contable gratuito Facultad de ciencias agricolas uce
Facultad de ciencias agricolas uce Facultad de ciencias universidad mayor
Facultad de ciencias universidad mayor Facultad de ciencias medicas y biologicas dr ignacio chavez
Facultad de ciencias medicas y biologicas dr ignacio chavez Facultad de ciencias físicas ucm
Facultad de ciencias físicas ucm Red nacional de laboratorios
Red nacional de laboratorios Estupian
Estupian Termos essenciais e integrantes da oração
Termos essenciais e integrantes da oração Luis jos
Luis jos Sintaxe
Sintaxe Miranda integrantes
Miranda integrantes Alejandra escudero
Alejandra escudero Puntos no coliniales
Puntos no coliniales Integrantes de luca
Integrantes de luca The internet integrantes
The internet integrantes Miss a integrantes
Miss a integrantes Lagos integrantes
Lagos integrantes Evanescence integrantes
Evanescence integrantes Integrantes de mcr
Integrantes de mcr Integrantes
Integrantes Integrantes
Integrantes Visita de rescate
Visita de rescate Grupo 10 4 integrantes
Grupo 10 4 integrantes Grupo gino
Grupo gino Tlc integrantes
Tlc integrantes Sandoval integrantes
Sandoval integrantes Que numero es
Que numero es La esquina integrantes
La esquina integrantes



























































