TUGAS KIMIA TIK Prof Edi Cahyono M Si


















- Slides: 30

TUGAS KIMIA TIK Prof. Edi Cahyono, M. Si L/O/G/O

NAMA MAHASISWA RATNA KUMALA DEWI 0404517007

BENTUK MOLEKUL DAN GAYA ANTARMOLEKUL

BENTUK MOLEKUL DAN GAYA ANTARMOLEKUL Standar kompetensi Memahami struktur atom untuk meramalkan sifat-sifat periodik unsur, struktur molekul, dan sifat-sifat senyawa. Kompetensi dasar § Menjelaskan teori jumlah pasangan elektron di sekitar inti atom untuk meramalkan bentuk molekul. § Menjelaskan interaksi antar molekul dengan sifatnya. Indikator § menentukan bentuk molekul berdasarkan teori VSEPR. § Menjelaskan perbedaan sifat fisik berdasarkan perbedaan gaya antar molekul. § Menerapkan hubungan antara gaya van der Walls dengan ukuran molekul untuk menjelaskan sifat fisiknya.

A. BENTUK MOLEKUL Merupakan gambaran secara teoritis susunan atom-atom dalam molekul berdasarkan susunan ruang pasangan elektron ikatan (PEI) dan pasangan elektron bebas (PEB) atom pusat. v Bentuk molekul dapat ditentukan dengan teori tolakan pasangan elektron valensi (teori domain elektron). v

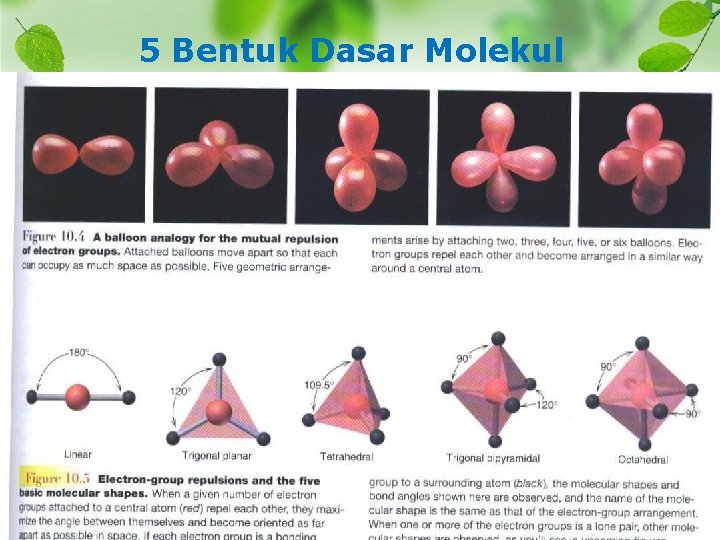
Bentuk molekul berdasarkan teori VSEPR v R. G. Gillesepie (1970), mengajukan teori VSEPR (Valance Shell Electron Pair Repulsion) atau teori tolakan pasangan elektron valensi : “Pasangan-pasangan elektron akan berusaha saling menjauhi sehingga tolak-menolak antara pasangan elektron menjadi seminimal mungkin”. v Jarak yang diambil oleh pasangan elektron bergantung pada keelektronegatifan atom yang bersangkutan. v Urutan gaya tolak : pasangan elektron bebas (PEB) > pasangan elektron terikat (PEI), ikatan rangkap 3 > ikatan rangkap 2 > ikatan tunggal. v Notasi yang dipakai: A = atom pusat, X = atom yang berikatan (PEI) dan E = elektron valensi yang tidak berikatan (PEB). v Keterbatasan teori VSEPR : tidak dapat menerangkan molekul-molekul yang lebih rumit dan mempunyai bilangan koordinasi lebih dari enam.

5 Bentuk Dasar Molekul

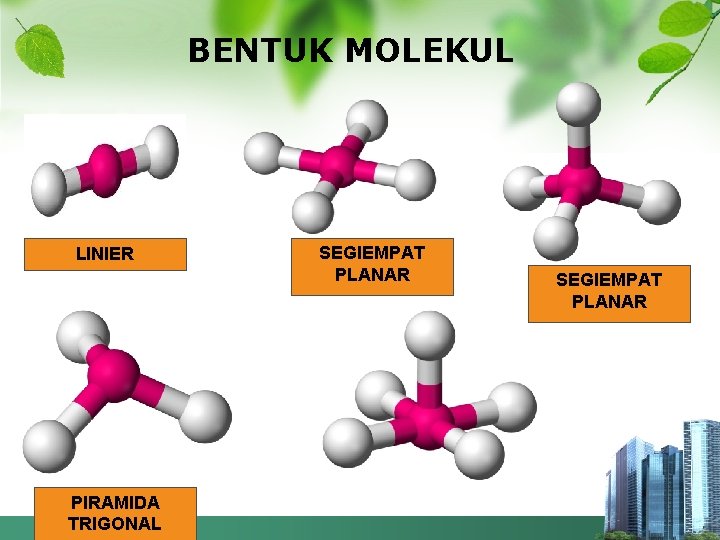
BENTUK MOLEKUL LINIER PIRAMIDA TRIGONAL SEGIEMPAT PLANAR

Cara meramalkan bentuk molekul v Gambarkan struktur Lewis senyawa. v Hitung jumlah pasangan elektron (PE), jumlah PEI dan PEB yang ada di sekitar atom pusat. v Memprediksi sudut-sudut ikatan yang mungkin berdasarkan jumlah kelompok elektron dan arah-arah yang mungkin akibat tolakan pasangan elektron bebas. v Tentukan rumus bentuk molekulnya/klasifikasi VSEPR. v Memberi nama bentuk molekul berdasarkan jumlah PEI dan PEB.

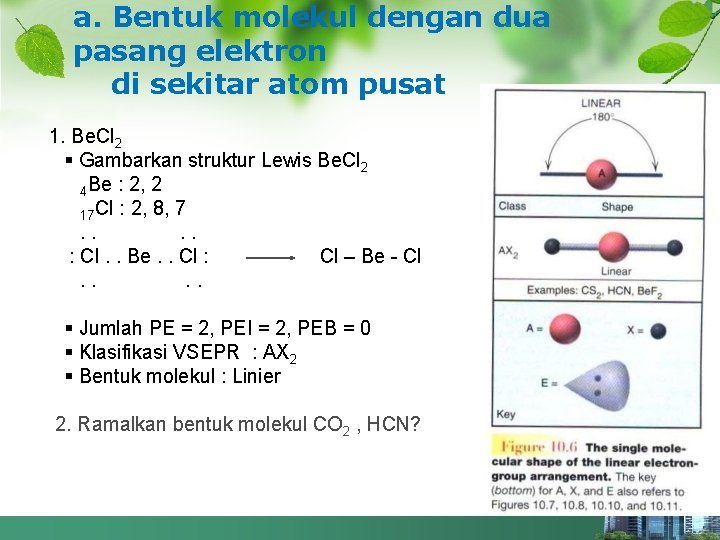
a. Bentuk molekul dengan dua pasang elektron di sekitar atom pusat 1. Be. Cl 2 § Gambarkan struktur Lewis Be. Cl 2 4 Be : 2, 2 17 Cl : 2, 8, 7. . : Cl. . Be. . Cl : Cl – Be - Cl. . § Jumlah PE = 2, PEI = 2, PEB = 0 § Klasifikasi VSEPR : AX 2 § Bentuk molekul : Linier 2. Ramalkan bentuk molekul CO 2 , HCN?

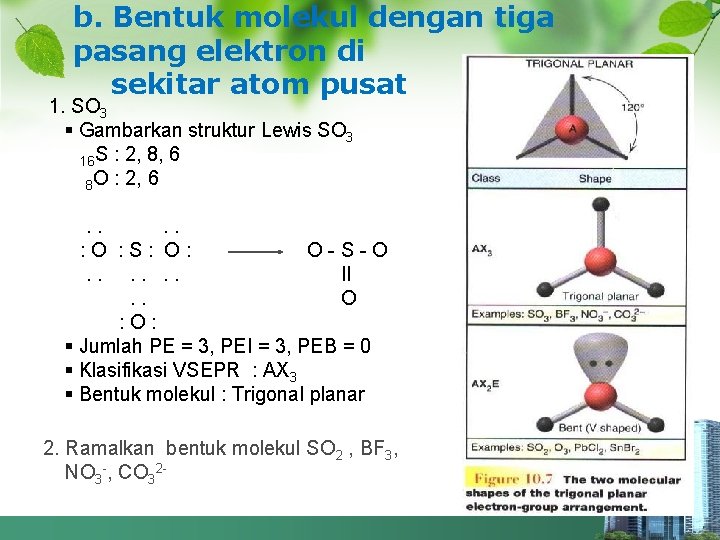
b. Bentuk molekul dengan tiga pasang elektron di sekitar atom pusat 1. SO 3 § Gambarkan struktur Lewis SO 3 16 S : 2, 8, 6 8 O : 2, 6 . . : O : S: O: O-S-O. . . II. . O : O: § Jumlah PE = 3, PEI = 3, PEB = 0 § Klasifikasi VSEPR : AX 3 § Bentuk molekul : Trigonal planar 2. Ramalkan bentuk molekul SO 2 , BF 3, NO 3 -, CO 32 -

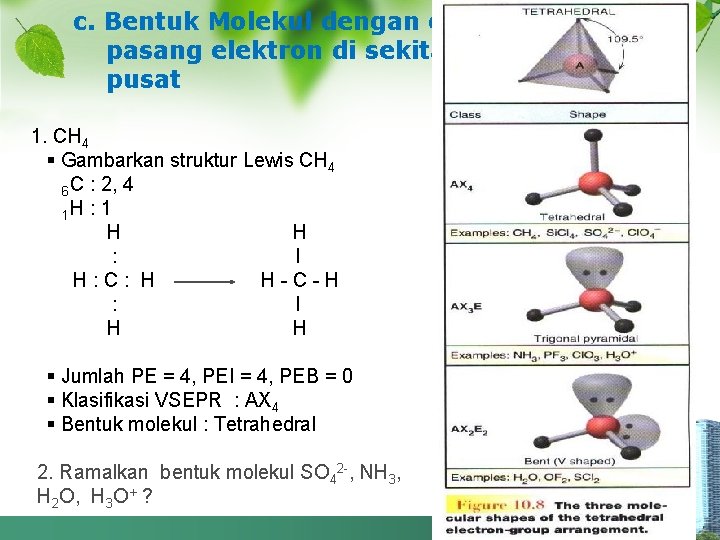
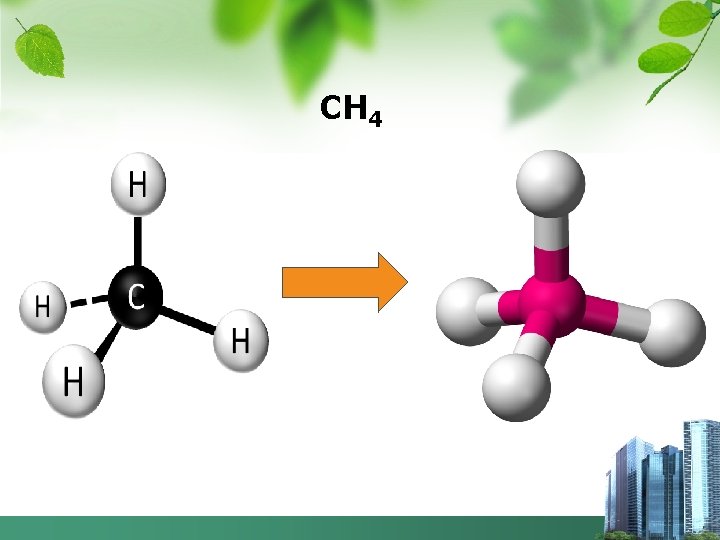
c. Bentuk Molekul dengan empat pasang elektron di sekitar atom pusat 1. CH 4 § Gambarkan struktur Lewis CH 4 6 C : 2, 4 1 H : 1 H H : I H: C: H H-C-H : I H H § Jumlah PE = 4, PEI = 4, PEB = 0 § Klasifikasi VSEPR : AX 4 § Bentuk molekul : Tetrahedral 2. Ramalkan bentuk molekul SO 42 -, NH 3, H 2 O, H 3 O+ ?

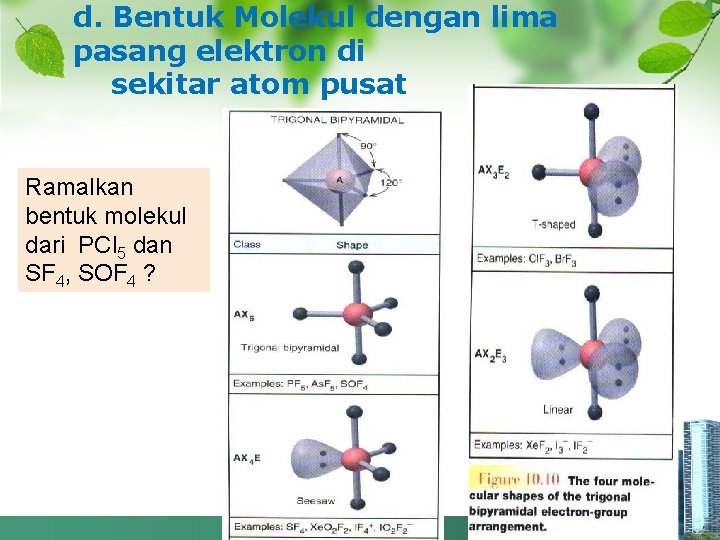
d. Bentuk Molekul dengan lima pasang elektron di sekitar atom pusat Ramalkan bentuk molekul dari PCl 5 dan SF 4, SOF 4 ?

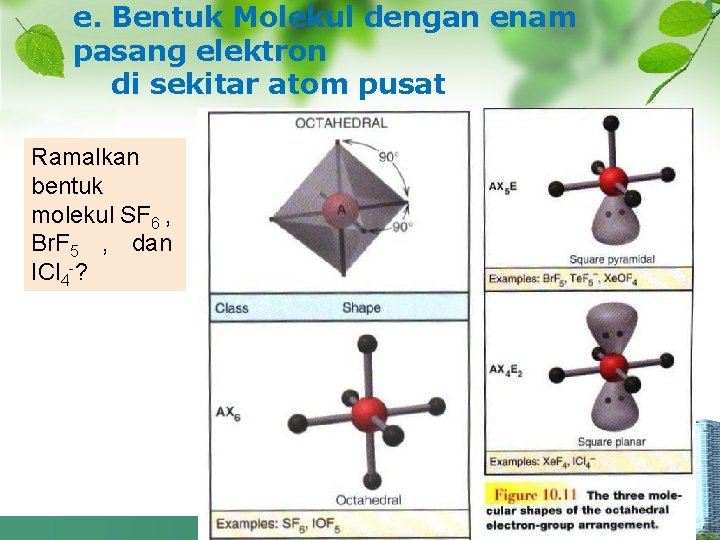
e. Bentuk Molekul dengan enam pasang elektron di sekitar atom pusat Ramalkan bentuk molekul SF 6 , Br. F 5 , dan ICl 4 -?

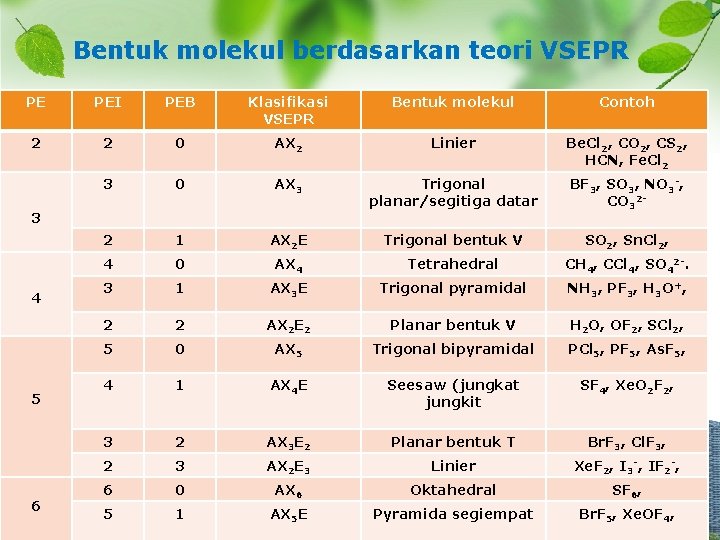
Bentuk molekul berdasarkan teori VSEPR PE PEI PEB Klasifikasi VSEPR Bentuk molekul Contoh 2 2 0 AX 2 Linier Be. Cl 2, CO 2, CS 2, HCN, Fe. Cl 2 3 0 AX 3 Trigonal planar/segitiga datar BF 3, SO 3, NO 3 -, CO 32 - 2 1 AX 2 E Trigonal bentuk V SO 2, Sn. Cl 2, 4 0 AX 4 Tetrahedral CH 4, CCl 4, SO 42 -. 3 1 AX 3 E Trigonal pyramidal NH 3, PF 3, H 3 O+, 2 2 AX 2 E 2 Planar bentuk V H 2 O, OF 2, SCl 2, 5 0 AX 5 Trigonal bipyramidal PCl 5, PF 5, As. F 5, 4 1 AX 4 E Seesaw (jungkat jungkit SF 4, Xe. O 2 F 2, 3 2 AX 3 E 2 Planar bentuk T Br. F 3, Cl. F 3, 2 3 AX 2 E 3 Linier Xe. F 2, I 3 -, IF 2 -, 6 0 AX 6 Oktahedral SF 6, 5 1 AX 5 E Pyramida segiempat Br. F 5, Xe. OF 4, 3 4 5 6

Latihan v Prediksikan bentuk molekul dan sudut ikatan senyawa: 1. PF 3 2. COCl 2 3. CS 2 4. CBr 4. 5. H 2 C 2 O 4

B. GAYA ANTARMOLEKUL Di antara molekul-molekul pun dapat mengalami gaya tarik-menarik walaupun sangat lemah. Gaya antarmolekul dapat mempengaruhi sifat fisik molekul-molekul.

1. Gaya Van Der Waals Menurut Johannes Van der Waals : interaksi antarmolekul menghasilkan suatu gaya yang lemah. Gaya tersebut dapat terjadi pada molekul-molekul polar dan molekul-molekul nonpolar. Pada molekul polar disebut gaya dipol-dipol, sedangkan pada molekul nonpolar disebut gaya dispersi (London). a. Gaya antar dipol, yaitu tarik-menarik antarmolekul dalam senyawa kovalen polar. Contoh : HCl, H 2 S, HI, HBr. Pada molekul HCl , atom klor lebih elektronegatif daripada hidrogen maka pasangan elektron cenderung tertarik oleh Cl. Molekul HCl jadi memiliki dipol.

b. Fritz London, tahun 1930 menguraikan terjadinya tarikan yang lemah disebabkan oleh dipol imbasan sekejap atau sesaat yang kemudian dikenal Gaya London, yaitu tarik-menarik antarmolekul dalam senyawa nonpolar. Contoh : H 2, Cl 2, CH 4, PCl 5.

CH 4

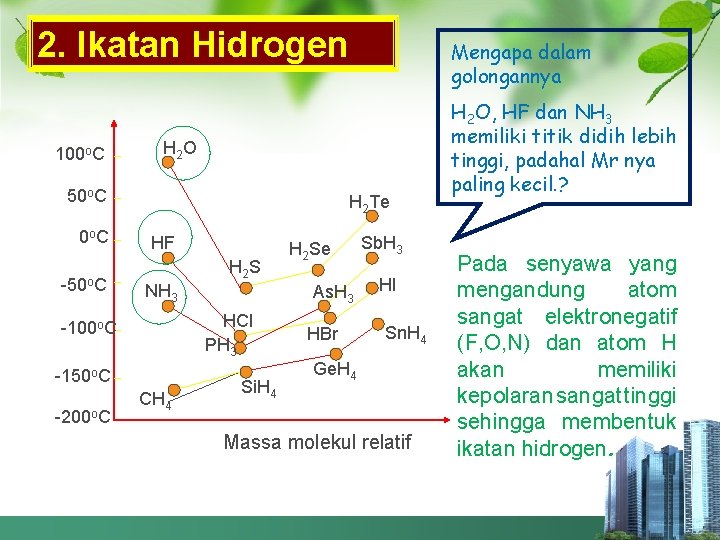
2. Ikatan Hidrogen 100 o. C H 2 O 50 o. C 0 o C -50 o. C H 2 Te HF H 2 S NH 3 -150 o. C CH 4 H 2 Se As. H 3 HCl PH 3 -100 o. C -200 o. C Mengapa dalam golongannya Si. H 4 HBr Sb. H 3 HI Sn. H 4 Ge. H 4 Massa molekul relatif H 2 O, HF dan NH 3 memiliki titik didih lebih tinggi, padahal Mr nya paling kecil. ? Pada senyawa yang mengandung atom sangat elektronegatif (F, O, N) dan atom H akan memiliki kepolaran sangat tinggi sehingga membentuk ikatan hidrogen.


PENGARUH GAYA ANTARMOLEKUL TERHADAP TITIK DIDIH v Semakin kuat ikatan antarmolekul, titik didih semakin tinggi karena energi yang dibutuhkan untuk memutuskan ikatan semakin besar. v Jika Mr Senyawa makin besar, titik didih makin tinggi. v Pada senyawa H 2 O, HF, NH 3 titik didih tinggi dalam golongan, karena mempunyai ikatan hidrogen antar molekulnya.

HYPERCHAM L/O/G/O

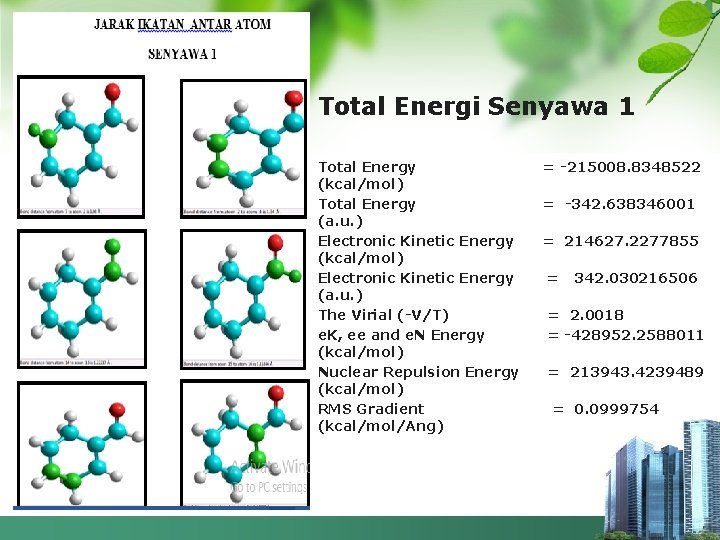
Total Energi Senyawa 1 Total Energy (kcal/mol) Total Energy (a. u. ) Electronic Kinetic Energy (kcal/mol) Electronic Kinetic Energy (a. u. ) The Virial (-V/T) e. K, ee and e. N Energy (kcal/mol) Nuclear Repulsion Energy (kcal/mol) RMS Gradient (kcal/mol/Ang) = -215008. 8348522 = -342. 638346001 = 214627. 2277855 = 342. 030216506 = 2. 0018 = -428952. 2588011 = 213943. 4239489 = 0. 0999754

Total Energi Senyawa 2 Total Energy (kcal/mol) = -215000. 0240714 Total Energy = -342. 624305130 (a. u. ) Electronic Kinetic Energy = 214500. 2879904 (kcal/mol) Electronic Kinetic Energy = (a. u. ) 341. 827925091 The Virial (-V/T) = 2. 0023 e. K, ee and e. N Energy (kcal/mol) = -429353. 2219997 Nuclear Repulsion Energy = 214353. 1979283 (kcal/mol) RMS Gradient (kcal/mol/Ang) = 12. 1199901

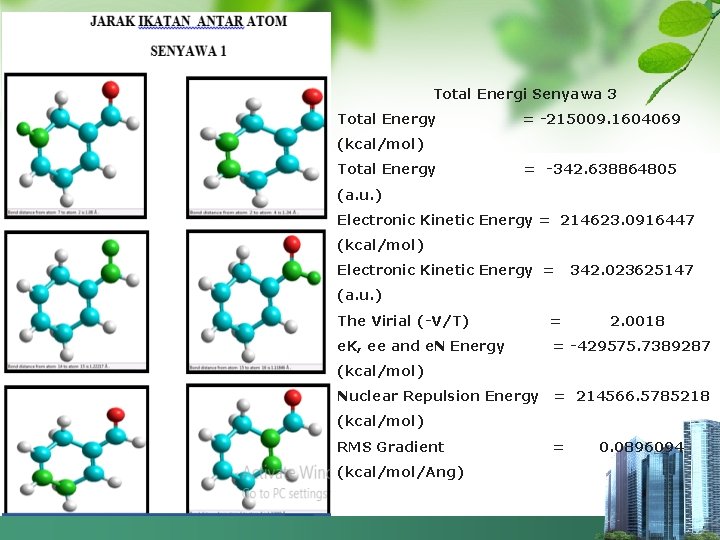
Total Energi Senyawa 3 Total Energy = -215009. 1604069 (kcal/mol) Total Energy = -342. 638864805 (a. u. ) Electronic Kinetic Energy = 214623. 0916447 (kcal/mol) Electronic Kinetic Energy = 342. 023625147 (a. u. ) The Virial (-V/T) = 2. 0018 e. K, ee and e. N Energy = -429575. 7389287 (kcal/mol) Nuclear Repulsion Energy = 214566. 5785218 (kcal/mol) RMS Gradient (kcal/mol/Ang) = 0. 0896094

GAUSSVIEW

BENZENA

Sekian dan Terimakasih…
 Tugas tik kelas 9 semester 2
Tugas tik kelas 9 semester 2 Tugas tik kelas 8 semester 1
Tugas tik kelas 8 semester 1 Bagan lingkungan organisasi
Bagan lingkungan organisasi Tugas pemandu diskusi
Tugas pemandu diskusi Tugas tugas bank
Tugas tugas bank Pertanyaan tentang psikologi perkembangan peserta didik
Pertanyaan tentang psikologi perkembangan peserta didik Kata tugas tahun 6
Kata tugas tahun 6 Pengertian dari serat alam adalah
Pengertian dari serat alam adalah Tugas dan tanggungjawab setiausaha
Tugas dan tanggungjawab setiausaha Apakah tugas bendahara dalam sistem pembesar empat lipatan?
Apakah tugas bendahara dalam sistem pembesar empat lipatan? Peranan guru dalam pendidikan awal kanak-kanak
Peranan guru dalam pendidikan awal kanak-kanak Penyusunan peta jabatan
Penyusunan peta jabatan Tik 12
Tik 12 Soal ujian sekolah tik sma
Soal ujian sekolah tik sma Sel tik
Sel tik Legal aspek produk tik gunadarma
Legal aspek produk tik gunadarma Kiekviename žmoguje yra saulė tik leiskit jai šviesti
Kiekviename žmoguje yra saulė tik leiskit jai šviesti Aspek legal tik property
Aspek legal tik property Pengertian bahan ajar fisika berbasis tik
Pengertian bahan ajar fisika berbasis tik Tata kelola tik
Tata kelola tik Lenda tik
Lenda tik Makalah tik
Makalah tik Contoh modul ajar tik
Contoh modul ajar tik Tik augalais mintantys gyvunai
Tik augalais mintantys gyvunai Magnit maydon
Magnit maydon Menu adalah tik
Menu adalah tik Kiekviename žmoguje yra saulė tik leiskit jai šviesti
Kiekviename žmoguje yra saulė tik leiskit jai šviesti Indikator monitoring tik
Indikator monitoring tik Peranan tik dalam kehidupan sehari-hari
Peranan tik dalam kehidupan sehari-hari Tik tok couter
Tik tok couter Kd tik kelas 9 semester 2
Kd tik kelas 9 semester 2