tomos molculas y moles np numero de partculas









- Slides: 12

Átomos, moléculas y moles np= numero de partículas o de moléculas en un gas np=n. N n=numero de moles N=numero de Avogadro=6. 02 1023 mp=M/N mp=masa de una partícula o molécula M=peso molecular del gas n=m/M n=numero de moles m=masa del gas

Ejemplo: cuantas moléculas de oxigeno O 2 están contenidas en cilindro de 500 ml. a 20ºC y P=745 mm Hg. V=0. 5 lts P=0. 98 atm T=293. 2 K n=PV/RT=0. 0204 moles np=n. N=0. 0204 moles 6. 02 1023 moléculas/mol=1. 227 1022 moléculas Ejemplo: Cuanto pesa una molécula de: a: oxigeno O 2 b: CO 2, c: CH 4 a: oxigeno mp=M/N=32 grs/mol/6. 02 1023 moléculas/mol=5. 32 10 -23 grs/molécula b: para CO 2 mp=7. 31 10 -23 grs/molécula c: Para CH 4 mp=7. 31 10 -23 grs/molécula Ejercicio: Cuanto pesaran y que volumen ocupan en CN (condiciones normales) 4. 55 1024 moléculas de N 2. Resp. m=211. 6 grs V=165. 2 lts

Ejemplo: Cual será el numero de moléculas por cm 3 (n*) para el mismo gas del ejemplo 1. V=0. 5 lts P=0. 98 atm T=293. 2 K np=n. N=0. 0204 moles 6. 02 1023 moléculas/mol=1. 227 1022 moléculas n*= moléculas/mol=1. 227 1022 moléculas/500 cm 3 =2. 454 1019 moléculas/cm 3 Ejercicio: Cuantas moléculas por cm 3 se tienen en un gas a 300 K y a una presión de 2 atm. PV=n. RT n/V=P/RT=2 atm/(0. 082 atm-lts/mol K 300 K)=0. 00813 mol/lt 1 mol=6. 02 1023 moléculas y 1 lto=1000 cm 3 o ml entonces n/V=n*=4. 894 1018 moléculas/cm 3

TEORÍA CINÉTICO MOLECULAR De acuerdo con la teoría cinético molecular P=Presión V=Volumen np=numero de partículas mp=masa de cada partícula U=Velocidad cuadrática media

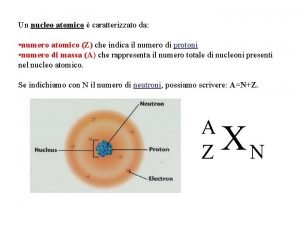
También npmp=m=masa del gas y m=n. M Como PV=n. RT tenemos: np = número total de moléculas o partículas en el recipiente (moléculas) mp = masa de cada partícula (grs/molécula) m = masa del total de partículas de gas (grs) U = velocidad cuadrática media (cm/seg) P = presión del gas (atm) V = volumen del gas (litros) n = numero de moles del gas (moles) M = peso molecular del gas (grs/mol) T = temperatura absoluta del gas (ºK) N=Número de Avogadro=6. 02 1023

R la constante general del estado gaseoso tiene el valor de R=0. 082 atmlts/molºK pero debemos convertirla a unidades compatibles con energía con las siguientes conversiones. atm-lts=24. 23 cal=4. 187 107 ergs y sustituyendo estos valores tenemos que R=8. 32 107 ergios/molºK Ejemplo: Cual será la velocidad cuadrática media U de las moléculas de oxigeno a 300ºK ergs/grs=grs-cm 2/seg 2/grs=cm 2/seg 2

La energía cinética es la energía de movimiento y para un cuerpo de masa m a una velocidad U la energía cinética Ek de este cuerpo es: Ek=(½)m. U 2 Para una molécula de gas, la energía cinética por molécula E’k es: E’k=(½)mp. U 2 Como mp=M/N También como U 2=3 RT/M sustituyendo en la ecuación anterior k=R/N=Constante de Plank=1. 382 10 -19 ergs/moléculaºK

Ejemplo: Cual será la energía cinética promedio de las moléculas de CO 2 a 300ºK U=4. 125 103 cm/seg E’k=44 grs/mol 17. 02 106/2 6. 02 1023=6. 22 10 -17 ergs/molécula También E’k=3/2 1. 382 10 -19 ergs/moléculaºK 300ºK=6. 22 10 -17 ergs/molécula Ejercicio: Encuentre la velocidad cuadrática media y la energía cinética por molécula para el NH 3 a 300ºK

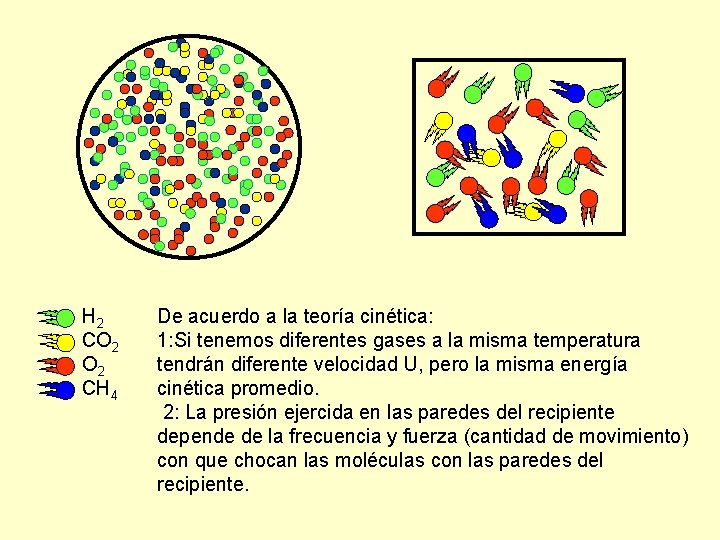
H 2 CO 2 CH 4 De acuerdo a la teoría cinética: 1: Si tenemos diferentes gases a la misma temperatura tendrán diferente velocidad U, pero la misma energía cinética promedio. 2: La presión ejercida en las paredes del recipiente depende de la frecuencia y fuerza (cantidad de movimiento) con que chocan las moléculas con las paredes del recipiente.

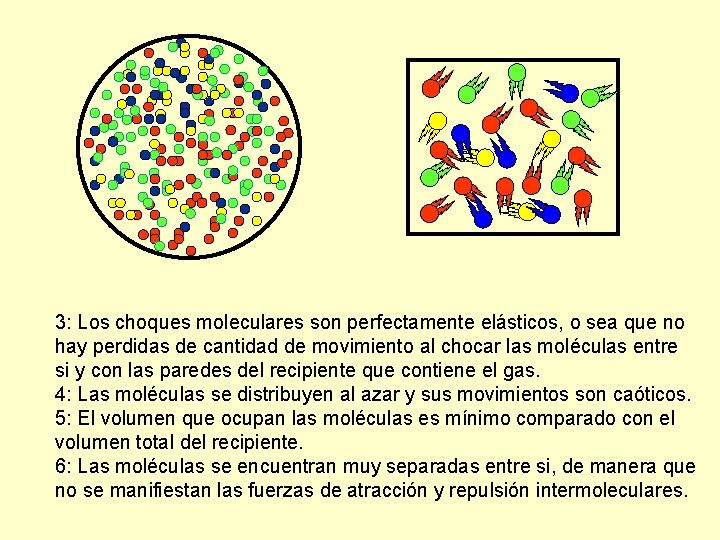
3: Los choques moleculares son perfectamente elásticos, o sea que no hay perdidas de cantidad de movimiento al chocar las moléculas entre si y con las paredes del recipiente que contiene el gas. 4: Las moléculas se distribuyen al azar y sus movimientos son caóticos. 5: El volumen que ocupan las moléculas es mínimo comparado con el volumen total del recipiente. 6: Las moléculas se encuentran muy separadas entre si, de manera que no se manifiestan las fuerzas de atracción y repulsión intermoleculares.

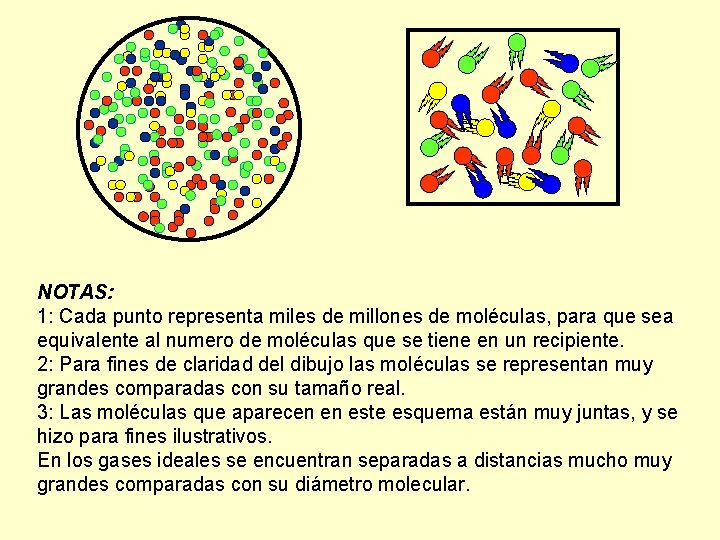
NOTAS: 1: Cada punto representa miles de millones de moléculas, para que sea equivalente al numero de moléculas que se tiene en un recipiente. 2: Para fines de claridad del dibujo las moléculas se representan muy grandes comparadas con su tamaño real. 3: Las moléculas que aparecen en este esquema están muy juntas, y se hizo para fines ilustrativos. En los gases ideales se encuentran separadas a distancias mucho muy grandes comparadas con su diámetro molecular.

Otros conceptos de velocidades moleculares, es la velocidad promedio u y la velocidad mas probable up Otras ecuaciones importantes que son consecuencia directa de la teoría analizada son las siguientes: ℓ ℓ= recorrido libre medio en cm. n*=número de moléculas por cm 3 =diámetro molecular en cm. u=velocidad promedio en cm/seg Z=número total de choques bimoleculares up=velocidad mas probable en cm/seg