Titolazioni La titolazione una tecnica analitica che permette














- Slides: 19

Titolazioni

La titolazione è una tecnica analitica che permette di conoscere la concentrazione (TITOLO) incognita di una soluzione mediante l’impiego di un’altra soluzione a concentrazione esattamente nota (a titolo noto). Tra la soluzione a titolo incognito e la soluzione a titolo noto AVVIENE UNA REAZIONE. A secondo del tipo di reazione le titolazioni si dividono in: Titolazioni ACIDO –BASE; Titolazioni di precipitazione; Titolazioni redox; Titolazioni complessometriche……. etc. La sostanza il cui titolo è esattamente noto si dice TITOLANTE. Quella da titolare si dice TITOLANDO.

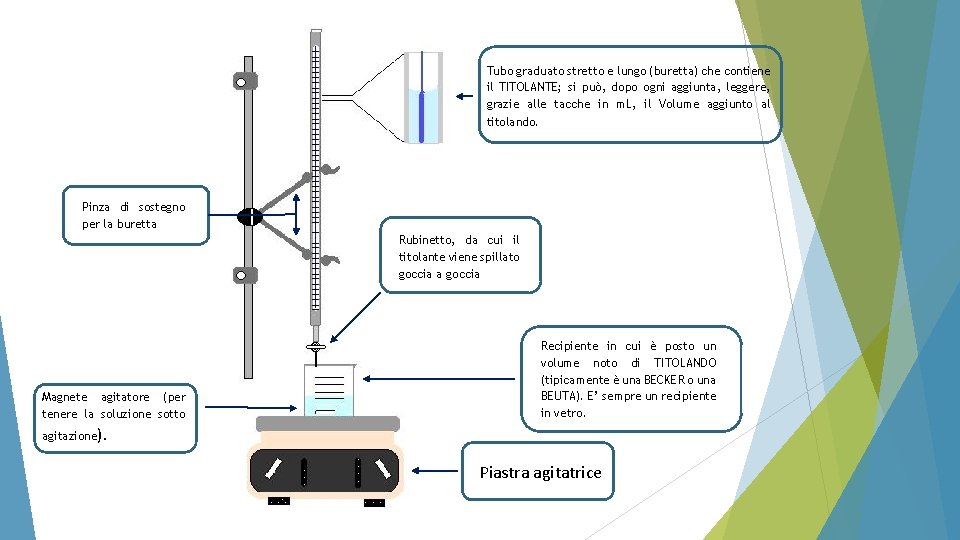
Tubo graduato stretto e lungo (buretta) che contiene il TITOLANTE; si può, dopo ogni aggiunta, leggere, grazie alle tacche in m. L, il Volume aggiunto al titolando. Pinza di sostegno per la buretta Rubinetto, da cui il titolante viene spillato goccia a goccia Magnete agitatore (per tenere la soluzione sotto Recipiente in cui è posto un volume noto di TITOLANDO (tipicamente è una BECKER o una BEUTA). E’ sempre un recipiente in vetro. agitazione). Piastra agitatrice

COME SI PROCEDE: Ad un volume noto della soluzione di titolando, tenuto sotto agitazione nella beuta, si aggiunge goccia a goccia dalla buretta il titolante. QUESTO E’ TIPICAMENTE UN ACIDO O BASE FORTE, CIOE’ NON E’ DI PER SE’ SOGGETTO AD ALTRI EQUILIBRI, RAPPRESNTA COSI’ IL CASO PIU’ SEMPLICE Quando si fa questo, per ogni goccia di titolante aggiunto avviene la reazione Acido – Base. Si procede ad aggiungere sino al PUNTO EQUIVALENTE, al quale si ha viraggio di colore della soluzione. Si annota il volume di titolante usato a tal punto per poter fare i calcoli che permettano di ricavare la concentrazione del titolando. Al di là del punto equivalente si può procedere solo per raccogliere informazioni che permettano di costruire al meglio la CURVA DI TITOLAZIONE PUNTO EQUIVALENTE: punto in cui si ha la perfetta stechiometria (equivalenza) tra titolante e titolando

TITOLAZIONE DI UN ACIDO o BASE FORTE Esempio: si titoli HCl con Na. OH: Per ogni goccia che aggiungiamo dalla buretta alla beuta il TITOLANDO viene consumato dal TITOLANTE e quindi il p. H della soluzione nella BEUTA aumenta. NOI SIAMO IN GRADO (v. INDICATORI) DI SEGUIRE MANO LE VARIAZIONI DI p. H DELLA SOLUZIONE NELLA BEUTA. Continuiamo quindi ad aggiungere la base (il titolante) finché non raggiungiamo un punto ben preciso, quello in cui LE MOLI DI H+ CHE IL TITOLANDO PRODUCE SONO EGUALI ALLE MOLI DI OHCHE PRODUCE IL TITOLANTE.

Nel caso in cui sia l’acido che la base sono monovalenti, il punto equivalente si raggiunge per moli Na. OH = moli HCl A questo punto: AL P. E. RESTA SOLO IL SALE In questo caso, siamo arrivati alla NEUTRALITA’, perché essendo presente solo il sale, Na. Cl, siamo a p. H = 7. IL PUNTO EQUIVALENTE PER TITOLAZIONI Ac. F. + B. F. E’ SEMPRE 7.

Al punto equivalente: moli Na. OH = moli HCl E’ così possibile conoscere la concentrazione (≡ il titolo) della soluzione di titolando. Se la titolazione viene continuata, il risultato è che si aggiunge altro Na. OH ad Na. Cl il p. H dipende solo da Na. OH. Dal punto equivalente in poi p. H > 7 e cresce sempre più per ogni successiva aggiunta di titolante.

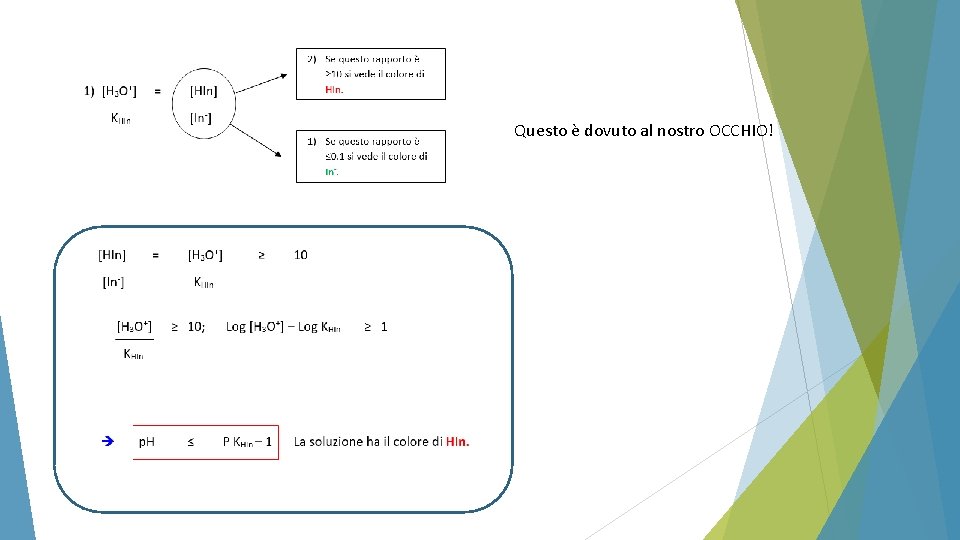
• COME FACCIAMO AD INDIVIDUARE IL PUNTO EQUIVALENTE? INDICATORI: sostanze bicromatiche virano in dipendenza dal p. H (il cui intervallo di viraggio dipende da una Ka ed è di circa 2 unità di p. H intorno al p. Ka) Sono acidi deboli (HIn) che hanno DIVERSO COLORE nella forma in dissociata (HIn) rispetto a quella dissociata (In-).

Questo è dovuto al nostro OCCHIO!

Per intervalli di p. H compresi tra P KHIn -1 il colore sarà intermedio tra quelli di HIn e In-

P KHIn -1 ≤ p. H ≤ P KHIn + 1 L’intervallo di p. H pari a: È detto INTERVALLO DI VIRAGGIO cioè l’intervallo di p. H nel quale avviene il cambio di colore dell’indicatore. Esso è di 2 UNITA’ di p. H: P KHIn + 1 - (P KHIn -1) = 2 ESEMPI DI VIRAGGIO DI INDICATORI: o BLU TIMOLO 1 -3 o ROSSO METILE 4. 5 – 6. 5 ROSSO – GIALLO o TORNASOLE 6– 8 o FENOLFTALEINA 8 -10 ROSSO – GIALLO ROSSO – BLU INCOLORE – ROSSO

Ci sono anche cartine indicatrici universali che danno un colore per ogni p. H, spesso anche con un’incertezza di pochi decimi di p. H. ATTENZIONE! Nella scelta dell’indicatore bisogna tenere presente che il punto equivalente della Titolazione è necessario che capiti all’interno dell’intervallo di viraggio. E’ importante conoscere KHIn, poiché il valore medio dell’intervallo di p. H è ≈ p. KHIn esempio: se la titolazione avrà (p. H)p. eq. ≈ 5 allora andrà bene un indicatore che abbia KHIn ≈10 -5. Nel caso di titolazione Acido Forte + Base Forte il salto di p. H è ben netto e di varie unità di p. H si apprezza bene il viraggio.

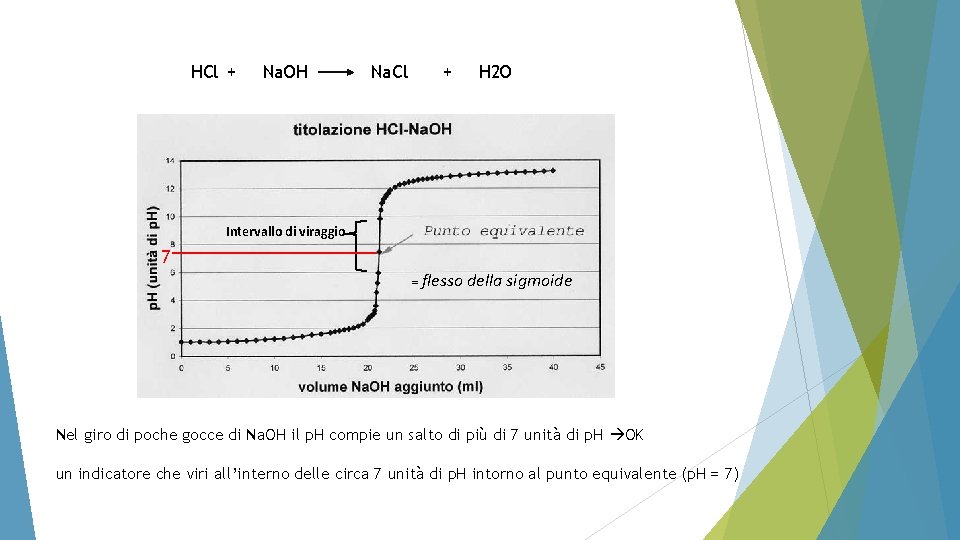
Facciamo un esempio numerico di come varia il p. H di una titolazione Ac. F. : Titoliamo una soluzione di HCl circa 0. 1 M (SPESSO LA CONCENTRAZIONE, ANCHE SE NON ESATTAMENTE, E’ CIRCA NOTA) usando una soluzione di Na. OH esattamente 0. 1000 M. A tale scopo preleviamo 100 m. L di TITOLANDO. Come varia il p. H?



HCl + Na. OH Na. Cl + H 2 O Intervallo di viraggio 7 = flesso della sigmoide Nel giro di poche gocce di Na. OH il p. H compie un salto di più di 7 unità di p. H OK un indicatore che viri all’interno delle circa 7 unità di p. H intorno al punto equivalente (p. H = 7)

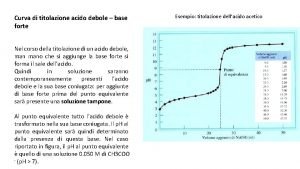
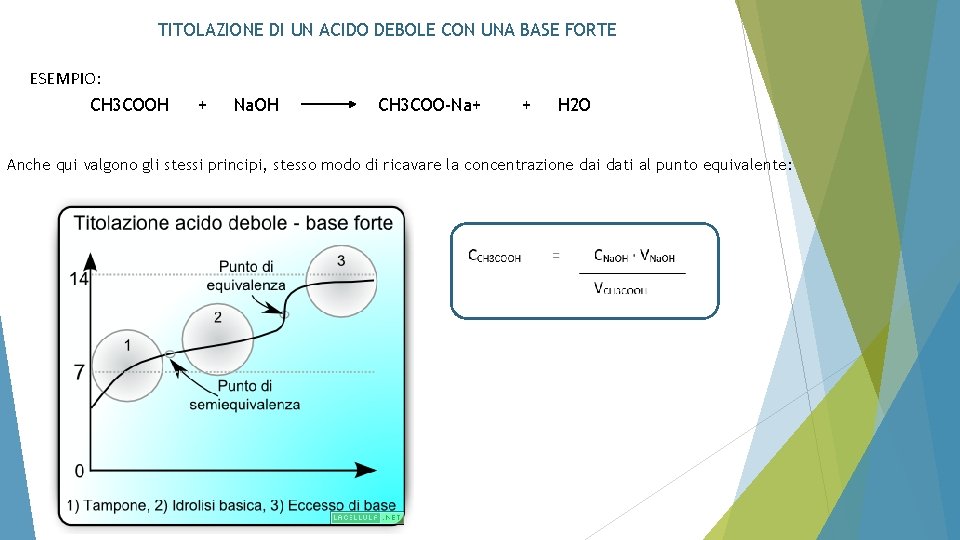
TITOLAZIONE DI UN ACIDO DEBOLE CON UNA BASE FORTE ESEMPIO: CH 3 COOH + Na. OH CH 3 COO-Na+ + H 2 O Anche qui valgono gli stessi principi, stesso modo di ricavare la concentrazione dai dati al punto equivalente:

FONDAMENTALI DIFFERENZE: Il p. H al punto equivalente è > 7. IDROLISI BASICA!!!! Il salto di p. H è meno evidente rispetto al caso Acido Forte + Base Forte. Ciò è dovuto al fatto che: • Nella zona prima del punto equivalente, poiché la Base Forte è IN DIFETTO rispetto all’Acido Debole si crea una soluzione tampone: CH 3 COOH/CH 3 COOChe si oppone a successive variazioni di p. H. Al punto equivalente c’è solo il sale: CH 3 COO-Na+ che da IDROLISI BASICA in CH 3 COOTale idrolisi basica fa si che il p. H > 7 CH 3 COO- CH 3 COOH + OH- Dopo il punto equivalente continuiamo ad aggiungere ad una Base Debole (CH 3 COO-) una Base Forte (Na. OH) cfr. ione a comune. Continuando ancora, il p. H dipende praticamente solo da Na. OH.

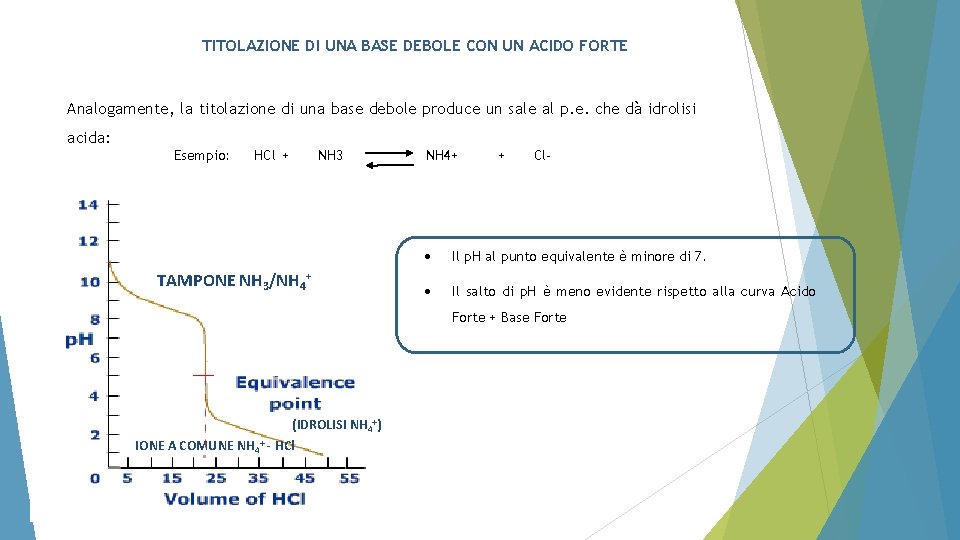
TITOLAZIONE DI UNA BASE DEBOLE CON UN ACIDO FORTE Analogamente, la titolazione di una base debole produce un sale al p. e. che dà idrolisi acida: Esempio: HCl + NH 3 TAMPONE NH 3/NH 4+ + Cl- Il p. H al punto equivalente è minore di 7. Il salto di p. H è meno evidente rispetto alla curva Acido Forte + Base Forte (IDROLISI NH 4+) IONE A COMUNE NH 4+ - HCl
 Titolazioni di precipitazione
Titolazioni di precipitazione Tecnica de instrumentacion step back
Tecnica de instrumentacion step back Meglio una testa ben fatta che una testa ben piena
Meglio una testa ben fatta che una testa ben piena Frasi con subordinata oggettiva esplicita
Frasi con subordinata oggettiva esplicita Ricordo quegli occhi pieni di vita
Ricordo quegli occhi pieni di vita Che che kooley
Che che kooley Facesti come quei che va di notte che porta il lume
Facesti come quei che va di notte che porta il lume Titolazione virale
Titolazione virale Titolazione di precipitazione
Titolazione di precipitazione Titolazione acido base zanichelli
Titolazione acido base zanichelli Titolazione dell'aceto
Titolazione dell'aceto Curva titolazione acido forte base debole
Curva titolazione acido forte base debole Normalità di una soluzione
Normalità di una soluzione Titolazione acido poliprotico
Titolazione acido poliprotico Acidimetria
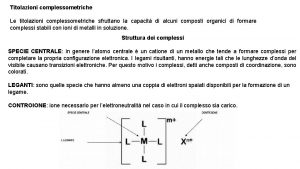
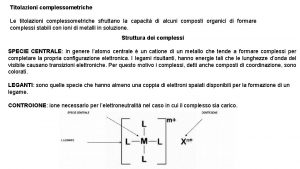
Acidimetria Titolazione complessometrica con edta
Titolazione complessometrica con edta Titolazione acido diprotico
Titolazione acido diprotico Analisi chimiche vino laboratorio
Analisi chimiche vino laboratorio Durezza acqua roma gradi tedeschi
Durezza acqua roma gradi tedeschi Titolazione acido diprotico
Titolazione acido diprotico