Titolazioni Titolazione determinazione della concentrazione titolo titolo di






- Slides: 9

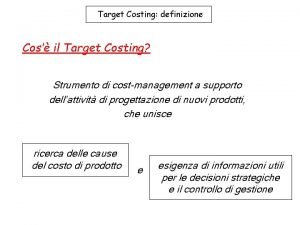
Titolazioni Titolazione = determinazione della concentrazione (titolo) titolo di una soluzione, misurando il volume utilizzato di una soluzione reagente (titolante) titolante con quella data per raggiungere il punto di equivalenza (punto in cui i due reagenti sono in rapporto stechiometrico: nessuno è in eccesso). Se la sostanza da analizzare è un acido (o una base), base il titolante sarà, di conseguenza una base (o un acido): acido si parla di titolazione acido-base Se in gioco c’è una reazione redox, si parla di titolazione redox

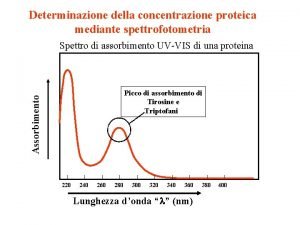
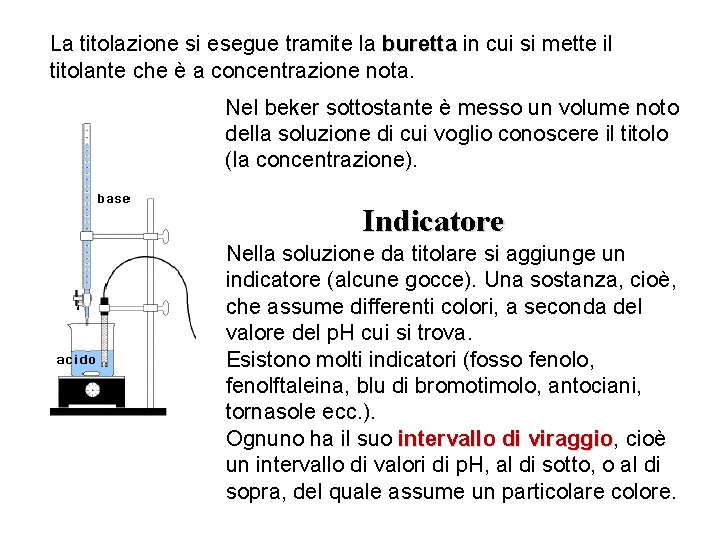
La titolazione si esegue tramite la buretta in cui si mette il titolante che è a concentrazione nota. Nel beker sottostante è messo un volume noto della soluzione di cui voglio conoscere il titolo (la concentrazione). Indicatore Nella soluzione da titolare si aggiunge un indicatore (alcune gocce). Una sostanza, cioè, che assume differenti colori, a seconda del valore del p. H cui si trova. Esistono molti indicatori (fosso fenolo, fenolftaleina, blu di bromotimolo, antociani, tornasole ecc. ). Ognuno ha il suo intervallo di viraggio, viraggio cioè un intervallo di valori di p. H, al di sotto, o al di sopra, del quale assume un particolare colore.

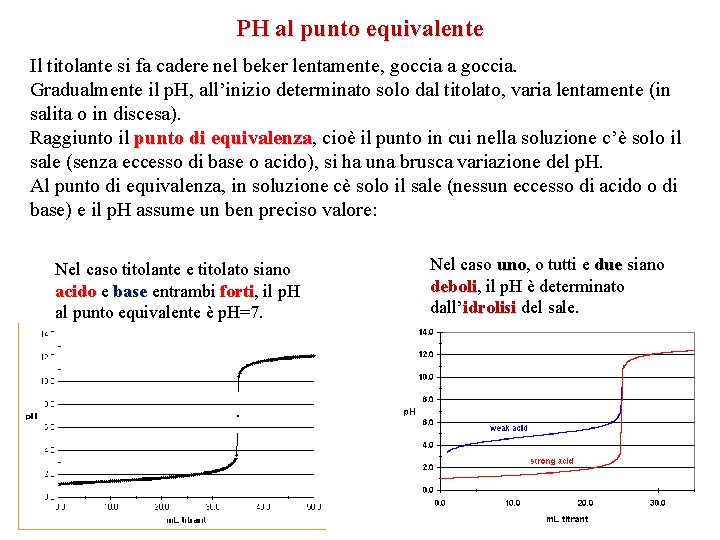
PH al punto equivalente Il titolante si fa cadere nel beker lentamente, goccia a goccia. Gradualmente il p. H, all’inizio determinato solo dal titolato, varia lentamente (in salita o in discesa). Raggiunto il punto di equivalenza, equivalenza cioè il punto in cui nella soluzione c’è solo il sale (senza eccesso di base o acido), si ha una brusca variazione del p. H. Al punto di equivalenza, in soluzione cè solo il sale (nessun eccesso di acido o di base) e il p. H assume un ben preciso valore: Nel caso titolante e titolato siano acido e base entrambi forti, forti il p. H al punto equivalente è p. H=7. Nel caso uno, uno o tutti e due siano deboli, deboli il p. H è determinato dall’idrolisi del sale.

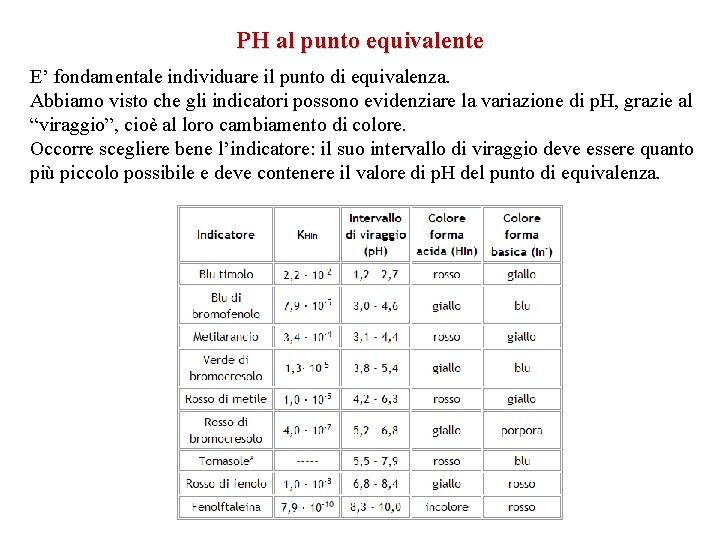
PH al punto equivalente E’ fondamentale individuare il punto di equivalenza. Abbiamo visto che gli indicatori possono evidenziare la variazione di p. H, grazie al “viraggio”, cioè al loro cambiamento di colore. Occorre scegliere bene l’indicatore: il suo intervallo di viraggio deve essere quanto più piccolo possibile e deve contenere il valore di p. H del punto di equivalenza.

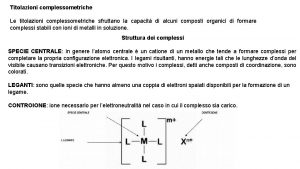
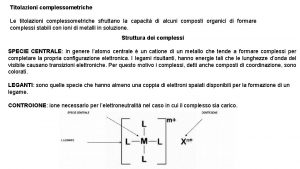
Punto di equivalenza La titolazione è fatta quando si raggiunge il punto di equivalenza, equivalenza quindi in soluzione non esiste altro che il sale prodotto dalla reazione tra titolato e titolante. A quel punto si dice che il numero di moli del titolante (nt) sono equivalenti alle moli del titolato (nx): nt ≡ nx Il titolante è sempre forte e monovalente (cioè ha una sola funzione, funzione acida o basica): Na. OH, Na. OH KOH, HCl HNO 3 ecc. Il titolato può essere forte (come una sostanza elencata precedentemente) o debole (NH 3, CH 3 COOH), mono o polifunzionale (H 2 CO 3, H 2 SO 4, Al(OH)3 ecc, ) Per «funzione acida» acida si intende il numero di ioni H+ che può cedere Per «funzione basica» basica si intende il numero di OH- che può rilasciare (o di ioni H+ che può acquistare)

Formule chiave Nela caso di una sostanza (acida o basica) monofunzionale, all’equivalenza il numero di moli di titolato e titolante sono uguali. nt = nx Es. Titolato = HCl (x) Titolante = Na. OH (t) HCl + Na. OH Na. Cl + H 2 O Nell’equazione bilanciata i coefficienti stechiometrici di titolante e titolato sono uguali, quindi al punto di equivalenza avremo: nt = nx Ma n= Mx. V (molarità per volume), sostituisco e avrò: Mx. Vx = Mt. Vt Conoscendo tre elementi di questa uguaglianza, calcolerò il quarto.

Problema 1 Per titolare 100 ml di una soluzione di acido nitrico, HNO 3 (acido forte) è stata usata una soluzione di idrossido di sodio, Na. OH (base forte) a concentrazione 0, 05 M. Al viraggio, la buretta segnava il consumo di 22, 5 ml di titolante. a) Qual è il titolo dell’acido? b) Quale indicatore potrebbe essere stato usato? c) Qual è il p. H al punto di equivalenza? a) La reazione sarà: HNO 3 + Na. OH Na. NO 3+H 2 O Dato che i coefficienti stechiometrici di acido e base sono uguali: nt = nx, quindi Mx. Vx = Mt. Vt da cui b) Trattandosi di acido forte e base forte, il sale prodotto non avrà idrolisi, quindi p. H=7 c) L’indicatore usato è il rosso fenolo 6, 8< p. H< 8, 4 Na. OH HNO 3

Problema 2 Per titolare 100 ml di una soluzione di acido solforico, H 2 SO 4 (acido forte) è stata usata una soluzione di idrossido di potassio, KOH (base forte) a concentrazione 0, 02 M. Al viraggio, la buretta segnava il consumo di 15 ml di titolante. a) Qual è il titolo dell’acido? b) Qual è il p. H al punto di equivalenza? c) Quale indicatore potrebbe essere stato usato? KOH H 2 SO 4 b) Trattandosi di acido forte e base forte, il sale prodotto non avrà idrolisi, quindi p. H=7 c) L’indicatore usato è il rosso fenolo 6, 8< p. H< 8, 4

Problema 3 Per titolare 100 ml di una soluzione di ammoniaca NH 3 (base monofunzionale con Kb= 1, 8 x 10 -5) è stata usata una soluzione di acido cloridrico HCl (acido forte) a concentrazione 0, 05 M. Al viraggio, la buretta segnava il consumo di 20 ml di titolante. a) Qual è il titolo dell’acido? b) Qual è il p. H al punto di equivalenza? c) Quale indicatore potrebbe essere stato usato? c) L’indicatore probabile: rosso metile 4, 2< p. H< 6, 3