REAZIONI DI SOSTITUZIONE Uno dei meccanismi di reazione







- Slides: 13

REAZIONI DI SOSTITUZIONE Uno dei meccanismi di reazione più importante è quello di addizione: A–B + C A–B–C Esistono anche altre possibilità che hanno due reattivi A e B di reagire tra loro con un meccanismo diverso. Può verificarsi, ad es. , che A reagisca con C sostituendo B, ossia: A–B + C A–C + B Abbiamo avuto la rottura del legame A – B e la formazione del legame A – C. Chi mette a disposizione gli elettroni per il nuovo legame? Ci sono due possibilità: v Lo stesso C porta con sé elettroni per legarsi ad A al posto di B. Se ciò avviene significa che C ha elettroni disponibili, quindi è un nucleofilo, per cui le reazioni sono dette “Sostituzioni nucleofile” v C non ha elettroni disponibili, e dunque è di tipo elettrofilo, per cui le reazioni sono dette “Sostituzioni elettrofile” C è detto “gruppo entrante” B è detto “gruppo uscente” 1

Naturalmente C per entrare deve essere un nucleofilo migliore di B, la carica in tal caso non scompare: A–B + C A – C + BSe C e B sono paragonabili (come nucleofilicità) si ha l’equilibrio: A–B + C- A–C + B - Se C è un elettrofilo si legherà ad A utilizzando gli elettroni del legame A – B , per cui B viene fuori senza elettroni: A–B + C A–C + B Anche in questo caso, se C e B sono paragonabili (come elettrofilicità) si ha l’equilibrio: A–B + C A–C + B 2

REAZIONI DI SOSTITUZIONI NUCLEOFILE ALIFATICHE Consideriamo un composto del C generico, R – X, in cui R è un raggruppamento di atomi di C ed X un atomo più elettronegativo del C: R = CH 3 – CH 2 e X = Cl Come sappiamo, se X è più elettronegativo del C, il legame C – X è spostato verso X (cioè è polarizzato), e dà origine ad un dipolo: + R X - L’entità della polarizzazione è tanto più grande quanto maggiore è la differenza di elettronegatività tra i due atomi. Supponiamo di introdurre nel sistema un nucleofilo: + R X - + Y- R–Y + X- Un nucleofilo entra ed un nucleofilo esce. 3

Vediamo qual è il possibile meccanismo di reazione. Vi possono essere due casi: 1) Si rompe il legame R – X e si forma il legame R – Y (2 stadi di reazione) 2) Man mano che si rompe il legame R – X si forma il legame R – Y (reazioni concertate o contemporanee) Caso 1) Essendo X più elettronegativo di R, richiamerà a sé gli elettroni: 1° stadio: R–X 2° stadio: R Y- + R + X R–Y Questa reazione viene indicata con il simbolo SN 1 , cioè sostituzione nucleofila mononucleare. Tutto il processo si svolgerà con una certa velocità, che però non è la stessa per entrambi gli stadi. Sappiamo che data V 1 la velocità del 1° stadio e V 2 la velocità del 2° stadio, la V totale sarà data da quella più lenta. 4

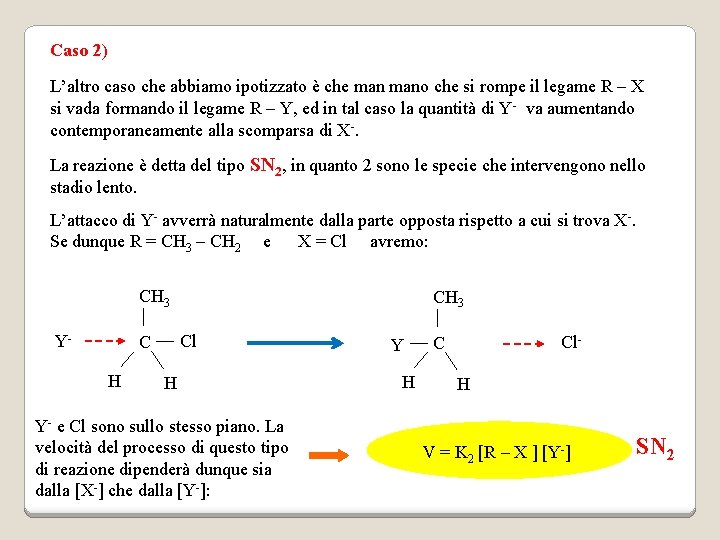
Caso 2) L’altro caso che abbiamo ipotizzato è che mano che si rompe il legame R – X si vada formando il legame R – Y, ed in tal caso la quantità di Y- va aumentando contemporaneamente alla scomparsa di X-. La reazione è detta del tipo SN 2, in quanto 2 sono le specie che intervengono nello stadio lento. L’attacco di Y- avverrà naturalmente dalla parte opposta rispetto a cui si trova X-. Se dunque R = CH 3 – CH 2 e X = Cl avremo: CH 3 Y- Cl C H CH 3 H Y- e Cl sono sullo stesso piano. La velocità del processo di questo tipo di reazione dipenderà dunque sia dalla [X-] che dalla [Y-]: Y H Cl- C H V = K 2 [R – X ] [Y-] SN 2

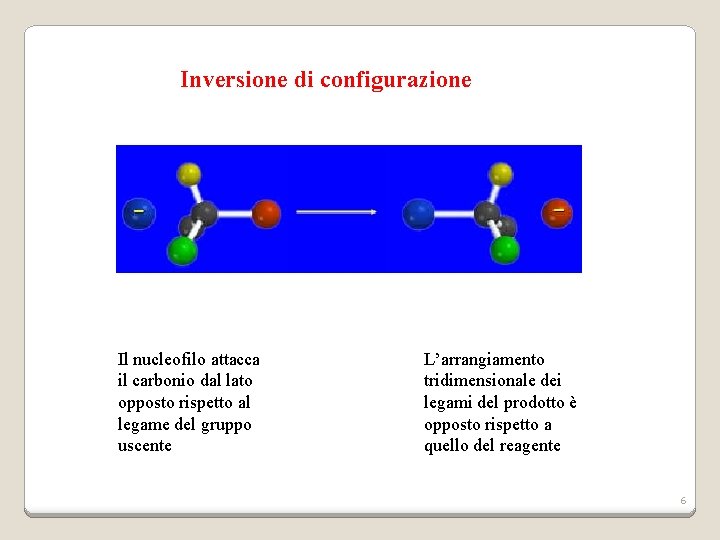
Inversione di configurazione Il nucleofilo attacca il carbonio dal lato opposto rispetto al legame del gruppo uscente L’arrangiamento tridimensionale dei legami del prodotto è opposto rispetto a quello del reagente 6

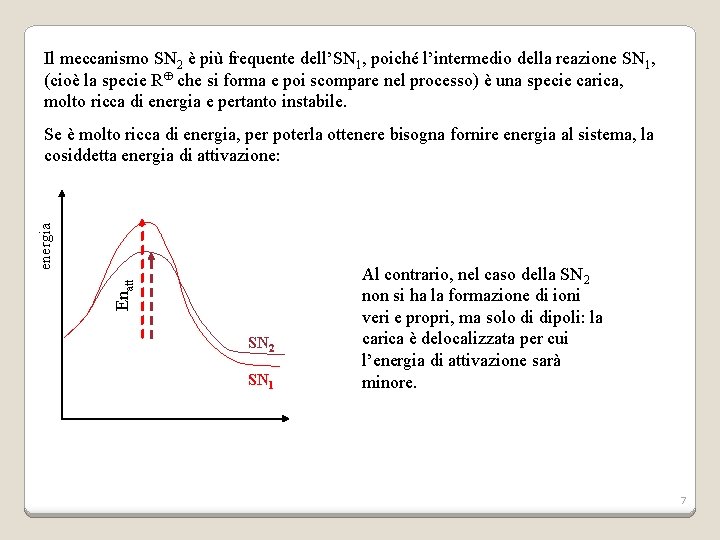
Il meccanismo SN 2 è più frequente dell’SN 1, poiché l’intermedio della reazione SN 1, (cioè la specie R che si forma e poi scompare nel processo) è una specie carica, molto ricca di energia e pertanto instabile. Enatt energia Se è molto ricca di energia, per poterla ottenere bisogna fornire energia al sistema, la cosiddetta energia di attivazione: SN 2 SN 1 Al contrario, nel caso della SN 2 non si ha la formazione di ioni veri e propri, ma solo di dipoli: la carica è delocalizzata per cui l’energia di attivazione sarà minore. 7

ALOGENURI ALCHILICI In generale gli alogenuri alchilici si classificano come: Cl alogenuri primari: CH 3 – CH 2 Cl alogenuri secondari: CH 3 – CH 3 alogenuri terziari: CH 3 – CH – Cl CH 3 8

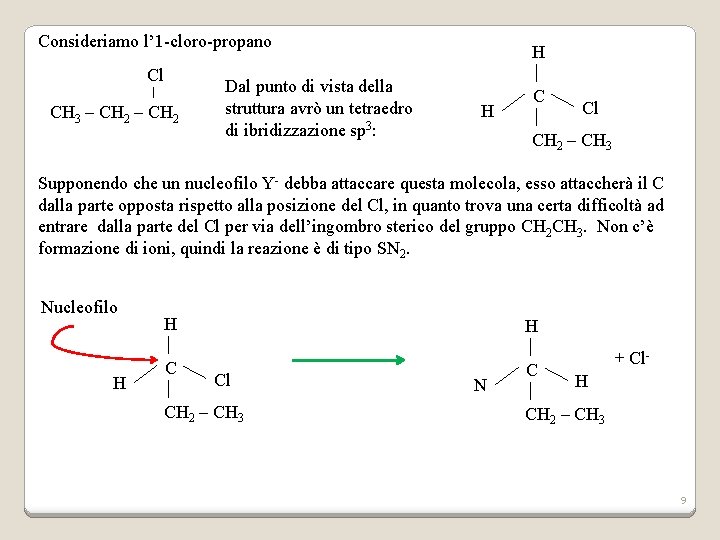
Consideriamo l’ 1 -cloro-propano Cl CH 3 – CH 2 Dal punto di vista della struttura avrò un tetraedro di ibridizzazione sp 3: H H C Cl CH 2 – CH 3 Supponendo che un nucleofilo Y- debba attaccare questa molecola, esso attaccherà il C dalla parte opposta rispetto alla posizione del Cl, in quanto trova una certa difficoltà ad entrare dalla parte del Cl per via dell’ingombro sterico del gruppo CH 2 CH 3. Non c’è formazione di ioni, quindi la reazione è di tipo SN 2. Nucleofilo H H Cl CH 2 – CH 3 N C + Cl. H CH 2 – CH 3 9

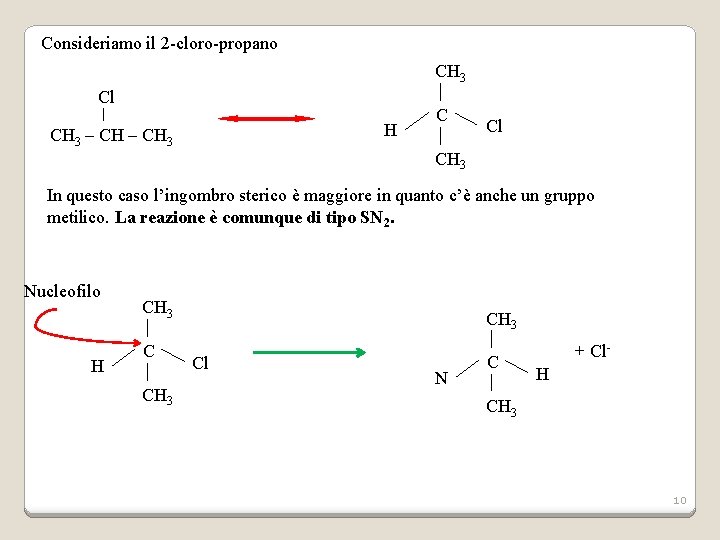
Consideriamo il 2 -cloro-propano CH 3 Cl H CH 3 – CH 3 C Cl CH 3 In questo caso l’ingombro sterico è maggiore in quanto c’è anche un gruppo metilico. La reazione è comunque di tipo SN 2. Nucleofilo H CH 3 Cl N C + Cl. H CH 3 10

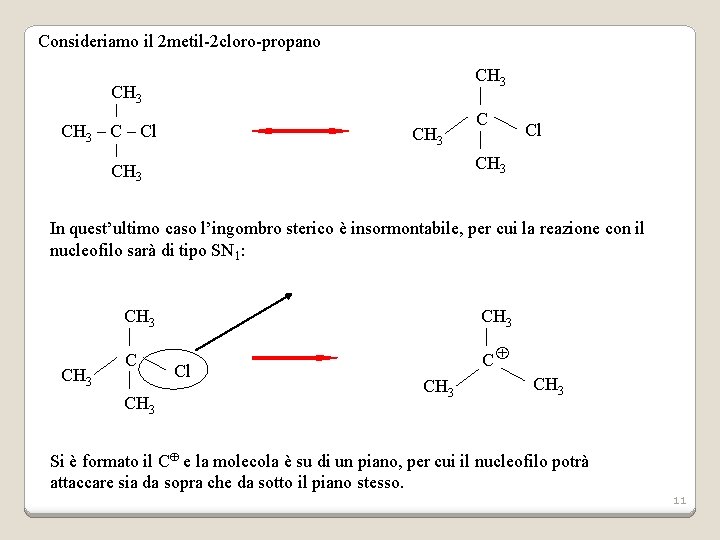
Consideriamo il 2 metil-2 cloro-propano CH 3 – Cl CH 3 C Cl CH 3 In quest’ultimo caso l’ingombro sterico è insormontabile, per cui la reazione con il nucleofilo sarà di tipo SN 1: CH 3 C C CH 3 Cl CH 3 Si è formato il C e la molecola è su di un piano, per cui il nucleofilo potrà attaccare sia da sopra che da sotto il piano stesso. 11

Conclusioni generali: v Le reazioni SN 2 si hanno con tutti gli alogenuri Iari ed anche con i IIari se non c’è un forte ingombro sterico v Le reazioni SN 1 si hanno con gli alogenuri IIIari Importante: Al di là della posizione dell’alogeno (primario, secondario o terziario) è fondamentale valutare l’ingombro sterico dei sostituenti vicini al C cui è legato l’alogeno: se il gruppo presente è molto ingombrante, anche su un alogenuro primario si potrà avere una reazione SN 1 e non la prevedibile SN 2. La velocità di reazione è influenzata dalla natura dell’alogeno, in quanto dipende dall’energia di legame tra il C e l’alogeno stesso: F >> Cl > Br > I Lo ione ioduro reagirà molto più velocemente dei bromuri, e questi dei cloruri, etc. , proprio perché più forte è il legame con il C meno veloce sarà la reazione (è indirettamente correlata all’elettronegatività). 12

RIEPILOGANDO: 1. Le reazioni nucleofile sono reazioni che si verificano in 2 modi diversi a seconda dell’ingombro sterico 2. Le sostituzioni nucleofile sono tanto più difficili quanto più forte è il legame da rompere 3. Le sostituzioni nucleofile si verificano quando il gruppo entrante è un miglior nucleofilo del gruppo uscente 4. Le sostituzioni nucleofile SN 2 sono più favorite rispetto alle SN 1 e si verificano se non c’è un forte ingombro sterico 13
 Meccanismi locali di ribaltamento
Meccanismi locali di ribaltamento Mintzberg organizzazione
Mintzberg organizzazione Test di appercezione tematica
Test di appercezione tematica Fabbisogno energetico
Fabbisogno energetico Meccanismi epigenetici
Meccanismi epigenetici Valvola mucosa di von gubaroff
Valvola mucosa di von gubaroff Uno è il sole che splende di giorno
Uno è il sole che splende di giorno Qulche
Qulche Bilanciamento reazioni redox
Bilanciamento reazioni redox Luana ferri
Luana ferri Leggi ponderali della chimica mappa concettuale
Leggi ponderali della chimica mappa concettuale Formule chimiche esempi
Formule chimiche esempi Dinamica delle strutture esercizi svolti
Dinamica delle strutture esercizi svolti Reazioni tardive al mezzo di contrasto iodato
Reazioni tardive al mezzo di contrasto iodato