Quenching de fluorescencia quenching desactivacin apagamiento menor emisin











- Slides: 28

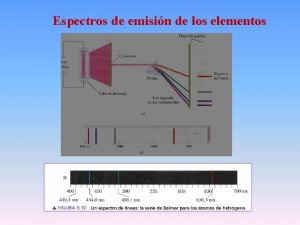
“Quenching” de fluorescencia quenching = desactivación= apagamiento = menor emisión IF (Q) < IF (-Q) Reacciones en el estado excitado (Quenching colisional) Entrecuzamiento intersistema a estado Triplete Rearreglos moleculares Transferencia de energía Transferencia de carga Formación de complejo en el estado basal (Quenching estático)

Mecanismos de desactivación bimolecular F* + Q ® F + Q Quenching colisional F* + Q ® F + Q* Transferencia de energía + + ® + F Q Transferencia de carga F +Q®P Reacción * *

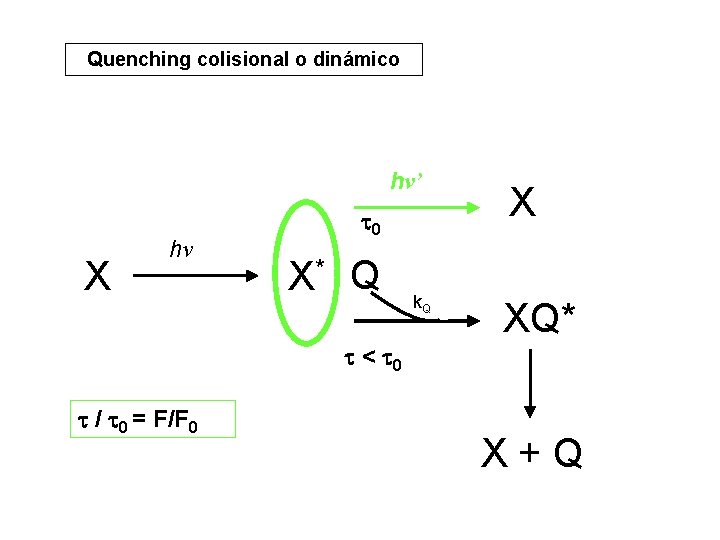
Quenching colisional o dinámico hν’ X hν 0 X* Q k. Q X XQ* < 0 / 0 = F/F 0 X+Q

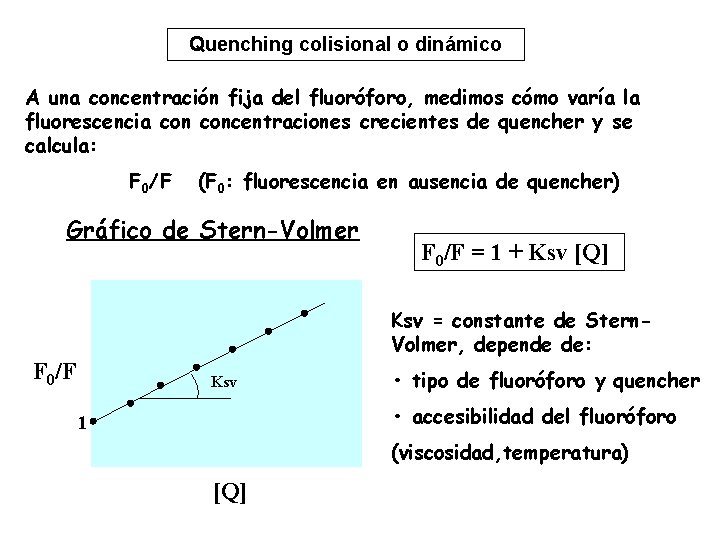
Quenching colisional o dinámico A una concentración fija del fluoróforo, medimos cómo varía la fluorescencia concentraciones crecientes de quencher y se calcula: F 0/F (F 0: fluorescencia en ausencia de quencher) Gráfico de Stern-Volmer F 0/F = 1 + Ksv [Q] Ksv = constante de Stern. Volmer, depende de: F 0/F Ksv • tipo de fluoróforo y quencher • accesibilidad del fluoróforo 1 (viscosidad, temperatura) [Q]

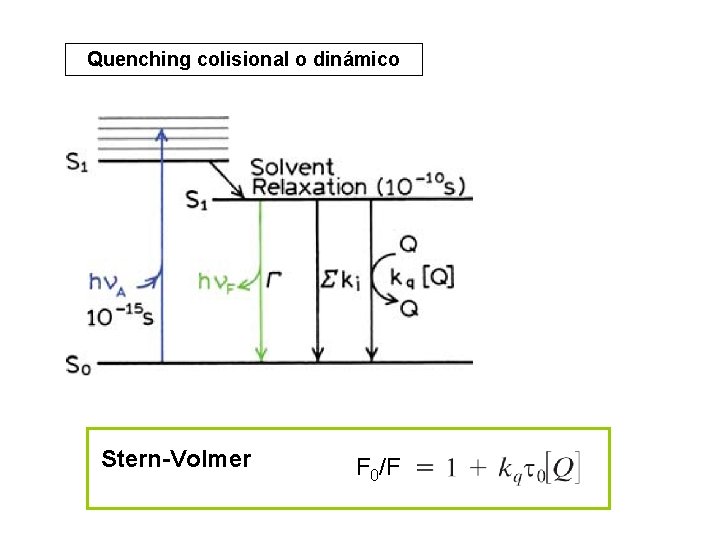
Quenching colisional o dinámico Stern-Volmer F 0/F

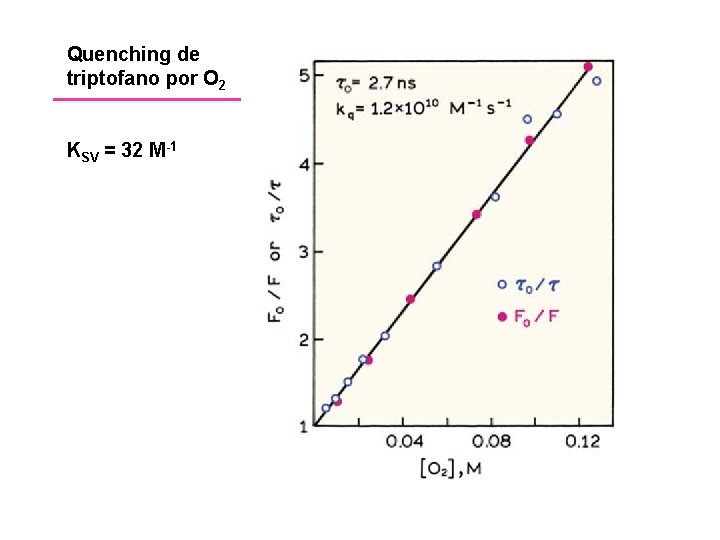
Quenching de triptofano por O 2 KSV = 32 M-1


Quenching colisional o dinámico KSV = kq 0 kq = cte. vel. quenching k 0 = cte. vel. colisional (controlada por difusión) f. Q = fracción de encuentros efectivos que terminan en quenching k. Q se determina experimentalmente a partir de KSV. Se estima la eficiencia de quenching f. Q calculando k 0 según Smoluchowski: O se conoce la eficiencia de quenching f. Q entonces se calcula k 0 para estimar el coeficiente de difusión D usando la ecuación de Stokes-Einstein:

Quenching dinámico o colisional • Se requiere contacto entre Q y F, interacción molecular • Quenching dinámico o colisional: Q + F* • Q debe difundir hacia F distancias moderadas (a diferencia de relajación por solvente) Indica localización del F, exposición de F de manera de ser accesible a Q


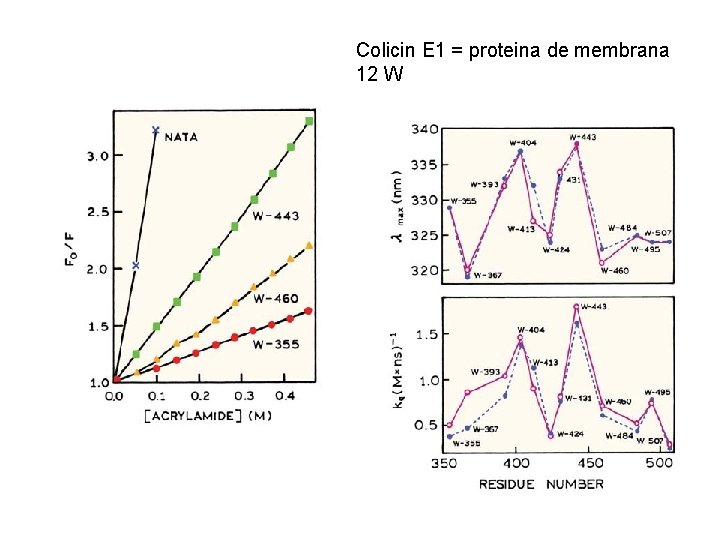
Colicin E 1 = proteina de membrana 12 W


Quenchers of W emission: Iodide, acrylamide, disulfide, e-defficient groups like –NH 3+, -COOH, histidine protonated

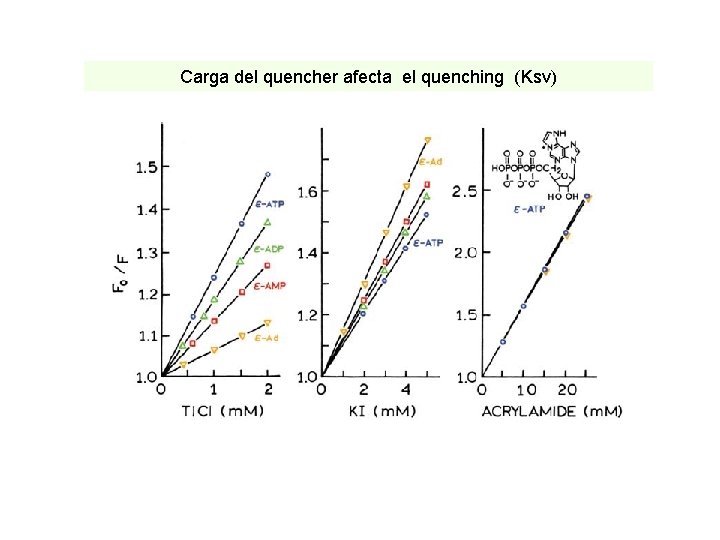
Carga del quencher afecta el quenching (Ksv)

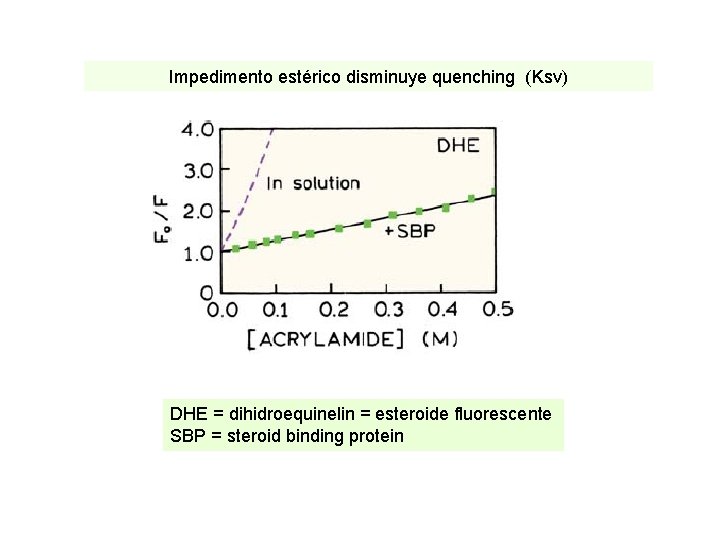
Impedimento estérico disminuye quenching (Ksv) DHE = dihidroequinelin = esteroide fluorescente SBP = steroid binding protein

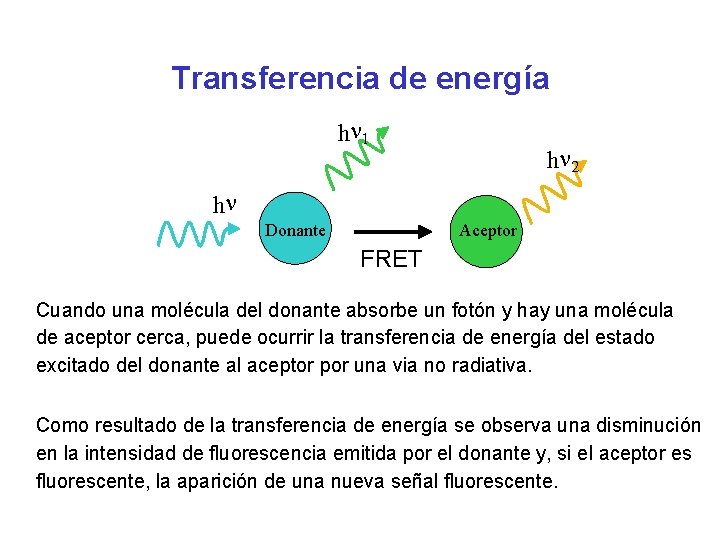
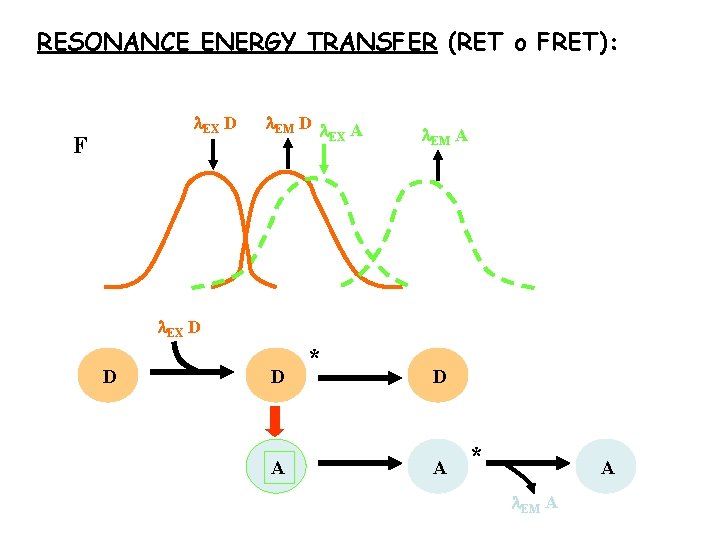
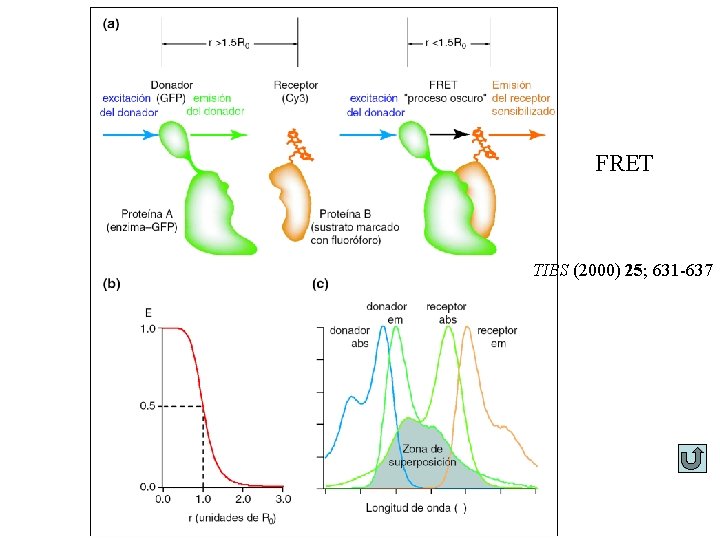
Transferencia de energía hn 1 hn 2 hn Donante Aceptor FRET Cuando una molécula del donante absorbe un fotón y hay una molécula de aceptor cerca, puede ocurrir la transferencia de energía del estado excitado del donante al aceptor por una via no radiativa. Como resultado de la transferencia de energía se observa una disminución en la intensidad de fluorescencia emitida por el donante y, si el aceptor es fluorescente, la aparición de una nueva señal fluorescente.

RESONANCE ENERGY TRANSFER (RET o FRET): EX D F EM D A EX EM A EX D D D A * A EM A

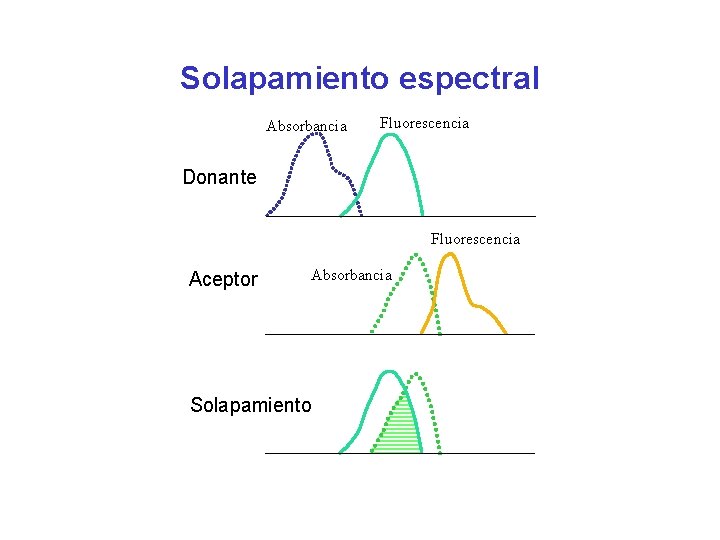
Solapamiento espectral Absorbancia Fluorescencia Donante Fluorescencia Aceptor Absorbancia Solapamiento

La eficiencia de la transferencia depende de: • la distancia entre D y A • el grado de solapamiento entre el espectro de emisión de D y el de absorción de A • la orientación relativa entre D y A • el tiempo de vida de D*

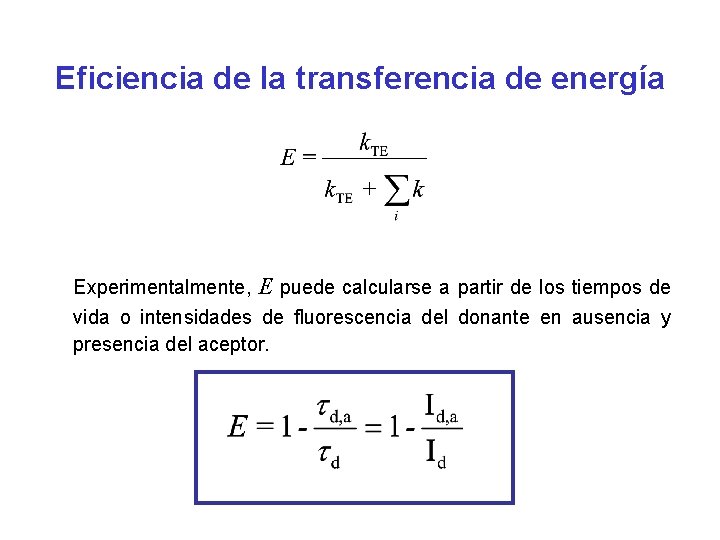
Eficiencia de la transferencia de energía Experimentalmente, E puede calcularse a partir de los tiempos de vida o intensidades de fluorescencia del donante en ausencia y presencia del aceptor.

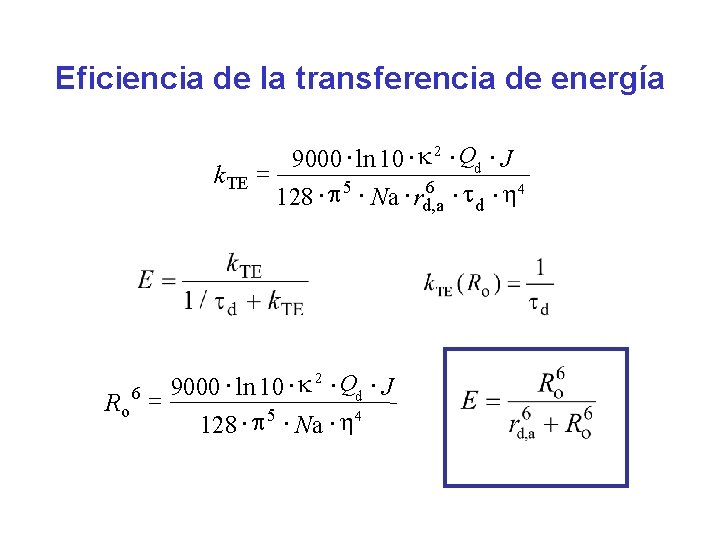
Eficiencia de la transferencia de energía k TE Ro 6 9000 × ln 10 × k 2 × Qd × J = 6 × d × h 4 128 × p 5 × Na × rd, a 9000 × ln 10 × k 2 × Qd × J = 128 × p 5 × Na × h 4

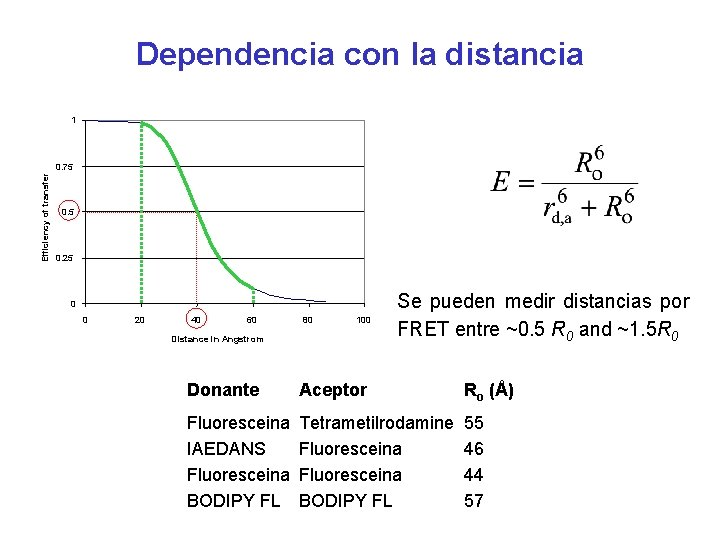
Dependencia con la distancia 1 Efficiency of transfer 0. 75 0. 25 0 0 20 40 60 80 100 Distance in Angstrom Se pueden medir distancias por FRET entre ~0. 5 R 0 and ~1. 5 R 0 Donante Aceptor Ro (Å) Fluoresceina IAEDANS Fluoresceina BODIPY FL Tetrametilrodamine Fluoresceina BODIPY FL 55 46 44 57

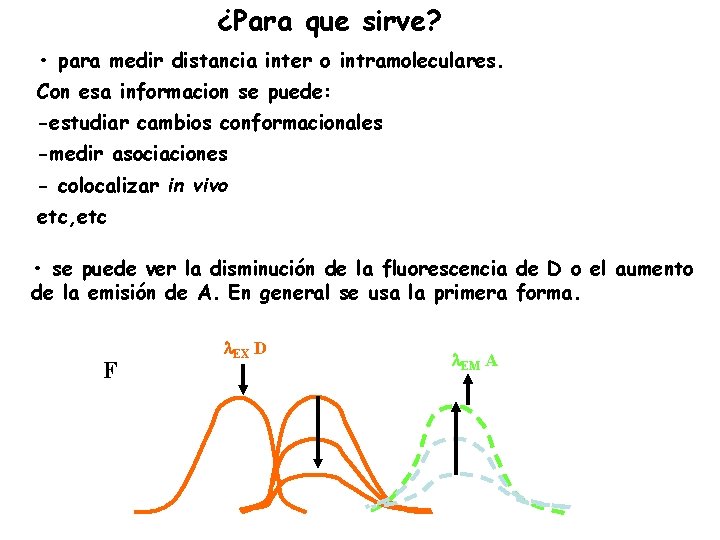
¿Para que sirve? • para medir distancia inter o intramoleculares. Con esa informacion se puede: -estudiar cambios conformacionales -medir asociaciones - colocalizar in vivo etc, etc • se puede ver la disminución de la fluorescencia de D o el aumento de la emisión de A. En general se usa la primera forma. F EX D EM A

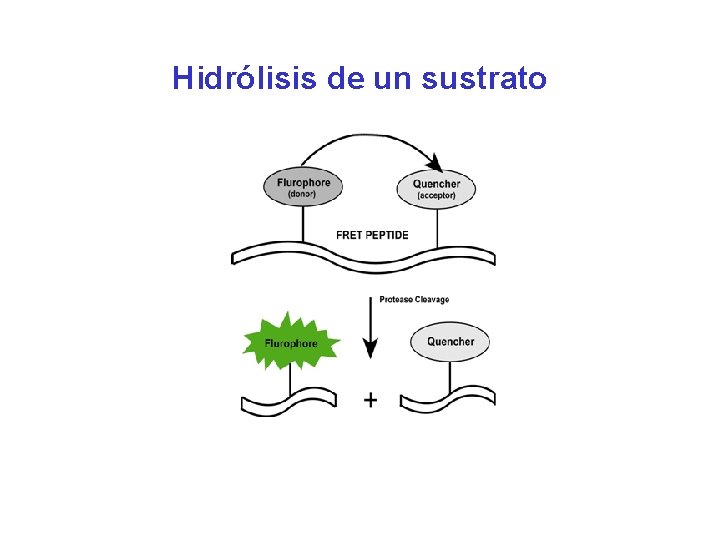
Hidrólisis de un sustrato

FRET TIBS (2000) 25; 631 -637

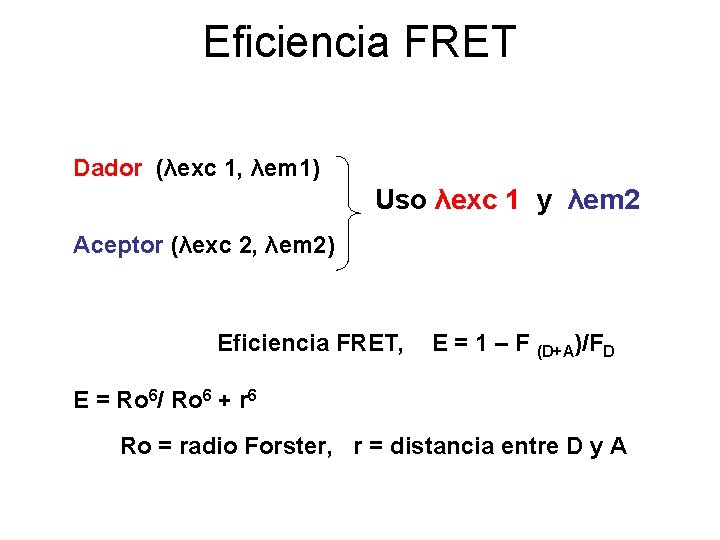
Eficiencia FRET Dador (λexc 1, λem 1) Uso λexc 1 y λem 2 Aceptor (λexc 2, λem 2) Eficiencia FRET, E = 1 – F (D+A)/FD E = Ro 6/ Ro 6 + r 6 Ro = radio Forster, r = distancia entre D y A

Formación de agregados moleculares

Usos de fluorescencia en bioquímica • • Localización subcelular Cambios en la concentración Interacciones moleculares Cambios conformacionales Distancias intra/intermoleculares Difusión rotacional Caracterización estructural Actividad enzimática ●●●
 Quenching
Quenching Fluorescencia
Fluorescencia Jablonksi
Jablonksi Fluorescencia
Fluorescencia Emisin
Emisin Emisin
Emisin Emisin
Emisin Emisin
Emisin Following verbs en español
Following verbs en español Oblicuo menor de la cabeza
Oblicuo menor de la cabeza Humanismo poesia palaciana
Humanismo poesia palaciana Mar menor medusas
Mar menor medusas Divisores
Divisores Membros do braço
Membros do braço Como calcular keq
Como calcular keq Cuál es el mayor número natural
Cuál es el mayor número natural Plipos
Plipos Recto anterior menor de la cabeza
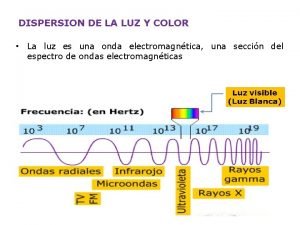
Recto anterior menor de la cabeza Frecuencia colores
Frecuencia colores Amor menor
Amor menor Tabla de presion arterial de acuerdo a la edad
Tabla de presion arterial de acuerdo a la edad 1728 é maior ou menor que 1735
1728 é maior ou menor que 1735 1
1 Musculo de la cintura
Musculo de la cintura Valor absoluto de un numero
Valor absoluto de un numero Oblicuo mayor y menor de la cabeza
Oblicuo mayor y menor de la cabeza Fosa iliaca
Fosa iliaca Origen del musculo pterigoideo interno
Origen del musculo pterigoideo interno Menor distancia entre dois pontos
Menor distancia entre dois pontos