Espectros de emisin de los elementos Luz emitida




- Slides: 6

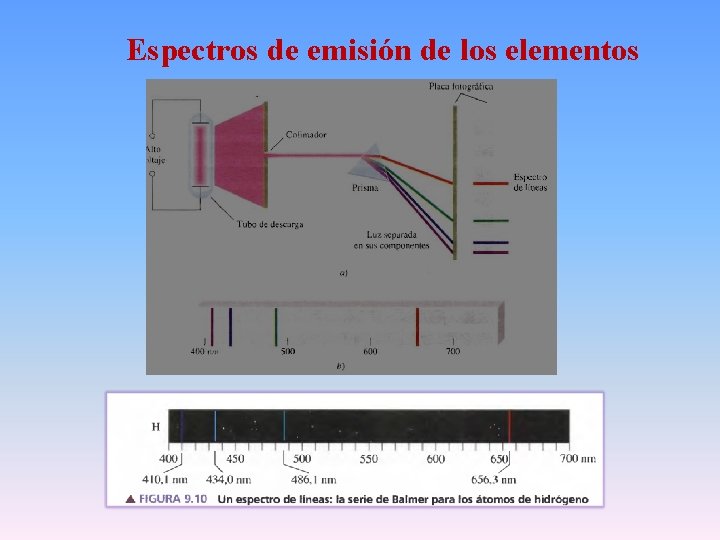
Espectros de emisión de los elementos

Luz emitida por una descarga eléctrica a través de a) hidrogeno b) helio. Luz emitida cuando se queman a la llama c) litio, d) sodio y e) potasio

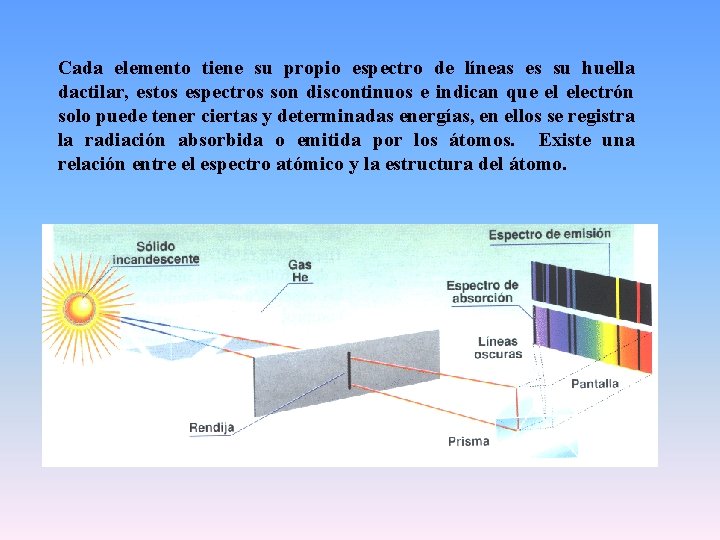
Cada elemento tiene su propio espectro de líneas es su huella dactilar, estos espectros son discontinuos e indican que el electrón solo puede tener ciertas y determinadas energías, en ellos se registra la radiación absorbida o emitida por los átomos. Existe una relación entre el espectro atómico y la estructura del átomo.

Las líneas de los espectros presentan patrones regulares que obedecen a una función matemática que se aproxima a un limite. Para el hidrogeno Rydberg estableció empíricamente una ecuación en 1890: 1/λ=R(1/n 2 - 1/m 2) = v = ν/C Donde: v =es el numero de onda (cm-1) R= constante de Rydberg 109678 cm-1 n y m son números enteros m>n Para n=2 y m=3, 4, 5… se puede calcular ν de las líneas de la serie visible o de Balmer En 1906 Lyman descubrió la serie de la región ultravioleta donde n=1 y m=2, 3, 4…. ∞ Pachen descubrió la región infrarroja donde n=3 y m=4, 5, 6… ∞ Brackett descubrió la serie para n=4 y Pfund para n=5 que pertenecen al infrarrojo lejano.

Hipótesis cuántica de Planck: en el año de 1900 Max Planck plantea que la radiación emitida o absorbida por los cuerpos calientes, no es continua corresponde a cantidades discretas o unidades de energía que llamó cuantos. La energía de un cuanto es directamente proporcional a la frecuencia de la radiación emitida: E= hν

Efecto fotoeléctrico: En 1905 Albert Einstein propuso que la radiación electromagnética tenia propiedades corpusculares. En su experimento Se consideró el choque de dos partículas un fotón y un electrón. Se demostró que la luz tiene una doble naturaleza: onda y partícula La energía mínima para remover un electrón era: Eo =hνo El exceso de energía se transforma en energía cinética Ec=(1/2) m. V 2 Ec=Ei-Eo