Q F Carla Loyola Fredes Seccin Equivalencia Teraputica













- Slides: 19

Q. F. Carla Loyola Fredes Sección Equivalencia Terapéutica Subdepto. Biofarmacia y Equivalencia Terapéutica Instituto de Salud Pública de Chile DEPARTAMENTO AGENCIA NACIONAL DE MEDICAMENTOS BIOEXENCIONES POR SISTEMA DE CLASIFICACIÓN BIOFARMACÉUTICA

• Clasifica los principios activos de acuerdo a las características fisicoquímicas/tecnológicas que pueden incidir en el comportamiento in vivo, según el modelo de Amidon y cols (1994). Instituto de Salud Pública de Chile DEPARTAMENTO AGENCIA NACIONAL DE MEDICAMENTOS Sistema de clasificación biofarmacéutica (SCB)

Parámetros fisicoquímicos: • Permeabilidad del API -> Absorción • Solubilidad del API -> mínima solubilidad -> flujo máximo (sistema saturado) Parámetros tecnológicos: • Disolución de la forma farmacéutica -> rápida/muy rápida • Relacionado con el vaciamiento gástrico Instituto de Salud Pública de Chile DEPARTAMENTO AGENCIA NACIONAL DE MEDICAMENTOS Modelo SCB – Parámetros determinantes

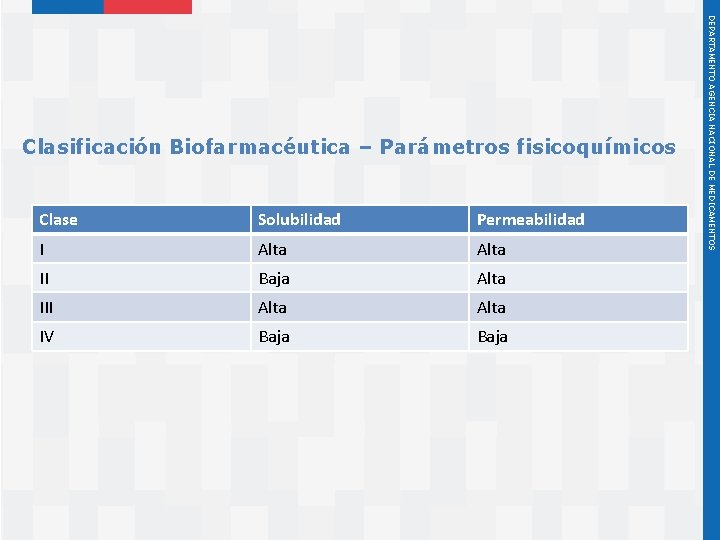
Clase Solubilidad Permeabilidad I Alta II Baja Alta III Alta IV Baja Instituto de Salud Pública de Chile DEPARTAMENTO AGENCIA NACIONAL DE MEDICAMENTOS Clasificación Biofarmacéutica – Parámetros fisicoquímicos

• FFSO-LI con patrones de rápida o muy rápida liberación- disolución (>85% disuelto a los 30 minutos o 15 minutos); • Amplio margen terapéutico. • Fármacos que contengan API clase I. • Fármacos clase III que tengan una muy rápida disolución a p. H 1, 2; 4, 5 y 6, 8. • Evaluación de excipientes. Instituto de Salud Pública de Chile DEPARTAMENTO AGENCIA NACIONAL DE MEDICAMENTOS Requisitos para optar una bioexención

Instituto de Salud Pública de Chile DEPARTAMENTO AGENCIA NACIONAL DE MEDICAMENTOS Novedades

Solubilidad • Solubilidad de la mayor potencia registrada en 250 m. L. • Ejecución de ensayos de saturación por agitación de matraces en varios p. H -> medios tamponados p. H 1, 2; 4, 5 y 6, 8 y p. H=p. Ka ± 1 de la molécula Alta solubilidad Instituto de Salud Pública de Chile DEPARTAMENTO AGENCIA NACIONAL DE MEDICAMENTOS Definiciones de acuerdo al decreto 17/19 - Anexo 3: G Biof -02

Hallazgos durante la revisión: • Desvíos a los procedimientos o al protocolo no justificados; • Volumen de medio del ensayo ejecutado no indicado o inconsistente; • Cálculo de D 0 con potencias menores; • Número de ensayos por p. H (mínimo 3); • Medición de p. H al inicio y al final del ensayo; • Estabilidad de las soluciones de API; • Ausencia de datos crudos (cromatogramas, cálculos); • Ausencia de Certificados de análisis, caracterización de la materia prima, GMP de fabricante de API, regularización de fabricantes de API. Instituto de Salud Pública de Chile DEPARTAMENTO AGENCIA NACIONAL DE MEDICAMENTOS Solubilidad

Permeabilidad Cuando la BD absoluta es > 85%; Cuando fármaco inalterado ≥ 85% de lo administrado (Orina); Cuando el fármaco inalterado + metabolitos ≥ 85% de lo administrado (estabilidad G. I) • Otros métodos aceptados para determinar la alta permeabilidad del principio activo son: ü Perfusión intestinal en humanos ü Perfusión intestinal en animales in situ o in vivo ü Permeabilidad a través del cultivo de monocapas de células epiteliales • • Información bibliográfica de lo anterior es aceptable, pero debe adjuntarse la publicación completa y además debe describirse el método completo. • Detalles en anexo II G-Biof 02 Instituto de Salud Pública de Chile DEPARTAMENTO AGENCIA NACIONAL DE MEDICAMENTOS Definiciones de acuerdo al decreto 17/19: G Biof -02

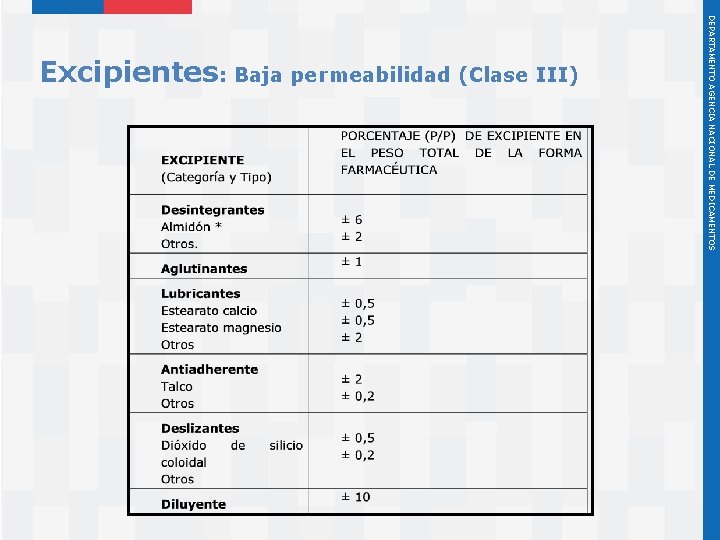
Instituto de Salud Pública de Chile DEPARTAMENTO AGENCIA NACIONAL DE MEDICAMENTOS Excipientes: Baja permeabilidad (Clase III)

• Información bibliográfica marcadores); incompleta (condiciones, p. H, • Datos de metodologías in silico (Log P); • Permeabilidad no concluyente: clasificación provisoria III -> debe haber evaluación de excipientes – EMA, FDA cuali-cuanti!! • No es suficiente afirmar que la nota técnica N° 6 lo indica – las características de disolución del producto de referencia son determinantes. Instituto de Salud Pública de Chile DEPARTAMENTO AGENCIA NACIONAL DE MEDICAMENTOS Permeabilidad Hallazgos durante la evaluación:

• • Liberación/disolución ≥ 85% en 30 minutos -> Rápida disolución (Clase I) Liberación/disolución ≥ 85% en 15 minutos -> Muy rápida disolución (Clase I y III) • Condiciones Temperatura: 37°C ± 0, 5°C Aparato: Aparato 2 USP (paleta) a 50 rpm o el aparato 1 USP (canastillo) a 100 rpm. Volumen: 900 m. L o menos (por ejemplo 500 m. L) de los siguientes medios: Solución de p. H 1, 2 (HCl 0, 1 N o fluido gástrico simulado USP sin enzimas). Solución buffer acetato p. H 4, 5. Solución buffer fosfato p. H 6, 8 (o fluido intestinal simulado USP sin enzimas). • No se permite el uso de surfactantes • La necesidad de utilizar enzimas debe estar justificada. Instituto de Salud Pública de Chile DEPARTAMENTO AGENCIA NACIONAL DE MEDICAMENTOS Disolución

Hallazgos durante la evaluación: • • Velocidad de agitación utilizada (50 rpm); Inconsistencias dentro de los reportes; Alta variabilidad no abordada, no explicada, no justificada; Desgasificado del medio de disolución; calificación de equipos, personal calificado; Incumplimiento en alguno de los p. H (6, 8); Cálculo de f 2 inadecuado; Debe considerar el tiempo de muestreo a los 15 minutos. Datos crudos con los cálculos realizados por el laboratorio. Instituto de Salud Pública de Chile DEPARTAMENTO AGENCIA NACIONAL DE MEDICAMENTOS Disolución

- Protocolo aprobado ≠ informe de resultados aprobado; Certificados de análisis del producto de referencia y prueba; Fórmula debe estar actualizada en ISP; No adjunta planillas de fabricación para trazabilidad; Bioexenciones para clase II – NO PERMITIDAS Instituto de Salud Pública de Chile DEPARTAMENTO AGENCIA NACIONAL DE MEDICAMENTOS Otros hallazgos

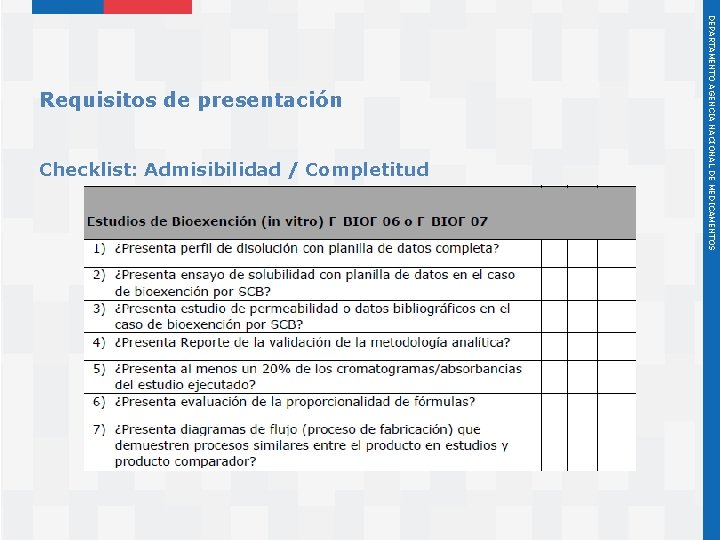
F-Biof 06 y guía al usuario: http: //www. ispch. cl/prestacion/4150051 Instituto de Salud Pública de Chile DEPARTAMENTO AGENCIA NACIONAL DE MEDICAMENTOS Requisitos de presentación

Checklist: Admisibilidad / Completitud Instituto de Salud Pública de Chile DEPARTAMENTO AGENCIA NACIONAL DE MEDICAMENTOS Requisitos de presentación

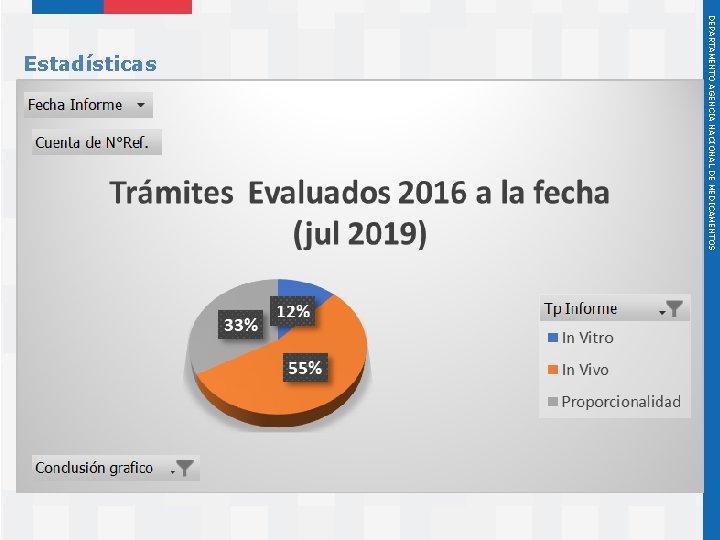
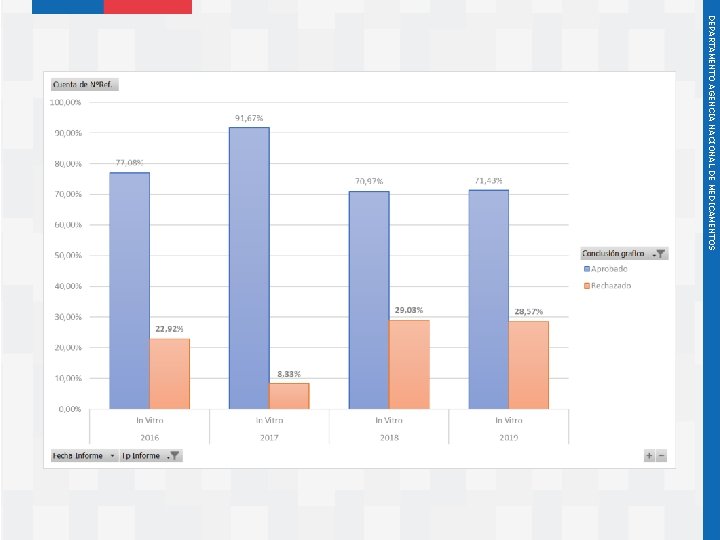
Instituto de Salud Pública de Chile DEPARTAMENTO AGENCIA NACIONAL DE MEDICAMENTOS Estadísticas

DEPARTAMENTO AGENCIA NACIONAL DE MEDICAMENTOS Instituto de Salud Pública de Chile

Instituto de Salud Pública de Chile DEPARTAMENTO AGENCIA NACIONAL DE MEDICAMENTOS MUCHAS GRACIAS