Podle komunikace s okolm okol m t n









- Slides: 19


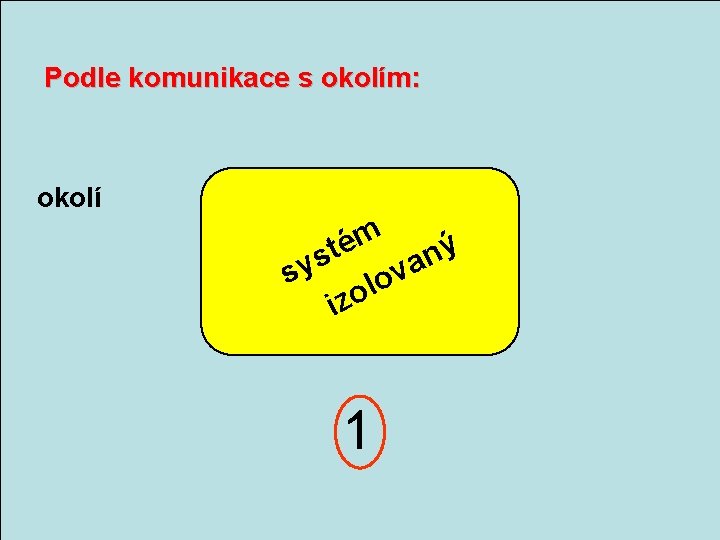
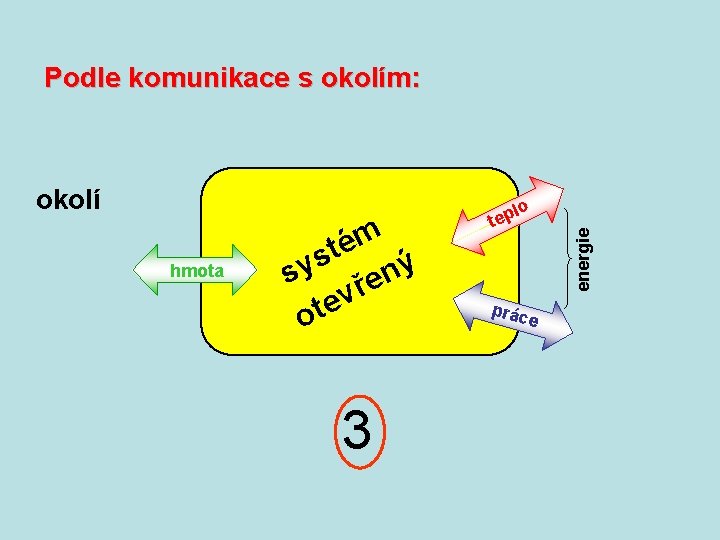
Podle komunikace s okolím: okolí m é ý t n s a v sy lo o iz 1

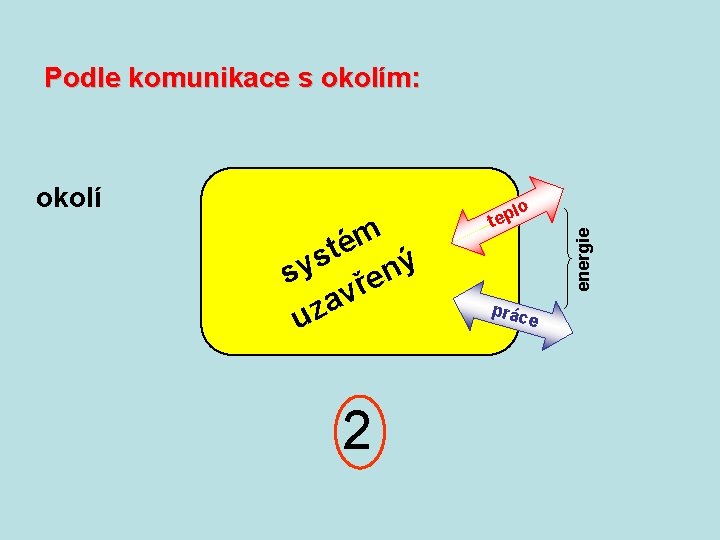
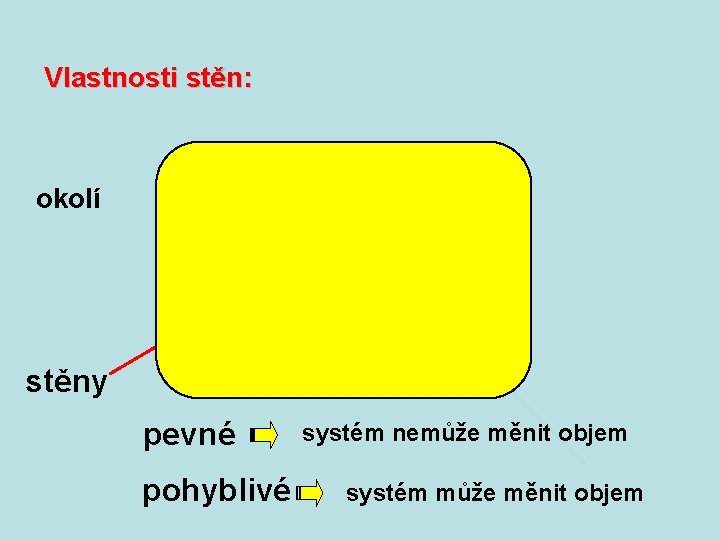
Podle komunikace s okolím: m é t s sy řený v a uz 2 lo tep prác energie okolí e

Podle komunikace s okolím: hmota m é t s sy řený v e t o 3 lo tep prác energie okolí e

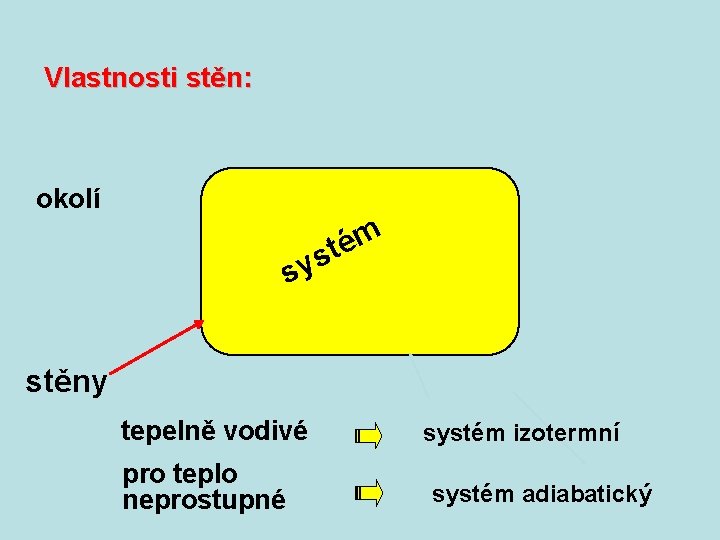
Vlastnosti stěn: okolí m é st sy stěny pevné pohyblivé systém nemůže měnit objem systém může měnit objem

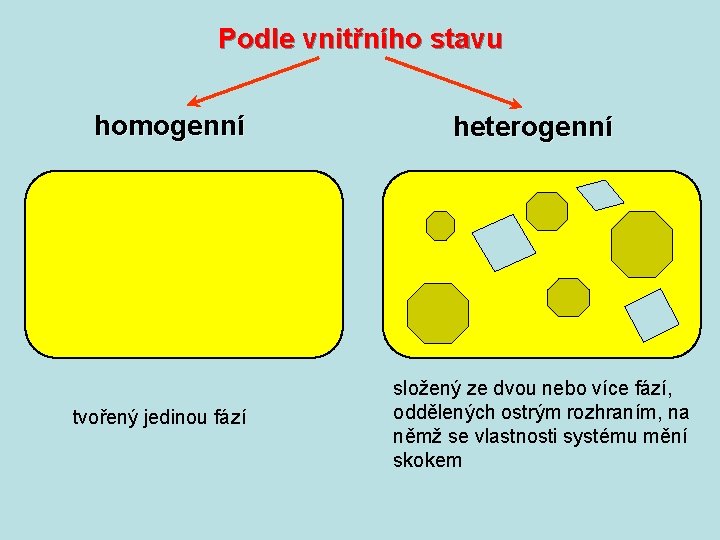
Vlastnosti stěn: okolí m é st sy stěny tepelně vodivé pro teplo neprostupné systém izotermní systém adiabatický

Podle vnitřního stavu homogenní tvořený jedinou fází heterogenní složený ze dvou nebo více fází, oddělených ostrým rozhraním, na němž se vlastnosti systému mění skokem

Fáze - oblast systému, jejíž vlastnosti jsou ve všech částech stejné, po případě se mění plynule V systému může existovat řada fází, z nichž některé mají stejné skupenství. Plyny – za obvyklých podmínek se neomezeně mísí a tvoří homogenní směs. Kapaliny – vzájemně úplně mísitelné omezeně mísitelné (vytvářejí heterogenní systémy, např. voda + nepolární organické látky) Pevné látky – homogenní směs tvoří jen výjimečně

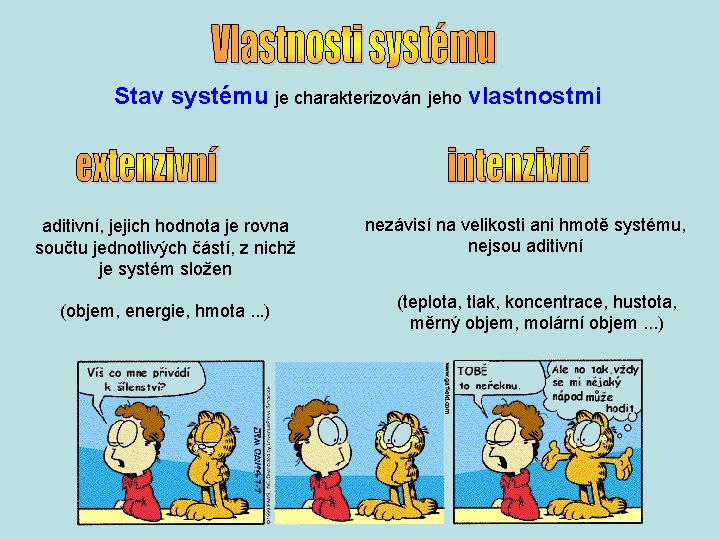
Stav systému je charakterizován jeho vlastnostmi aditivní, jejich hodnota je rovna součtu jednotlivých částí, z nichž je systém složen (objem, energie, hmota. . . ) nezávisí na velikosti ani hmotě systému, nejsou aditivní (teplota, tlak, koncentrace, hustota, měrný objem, molární objem. . . )

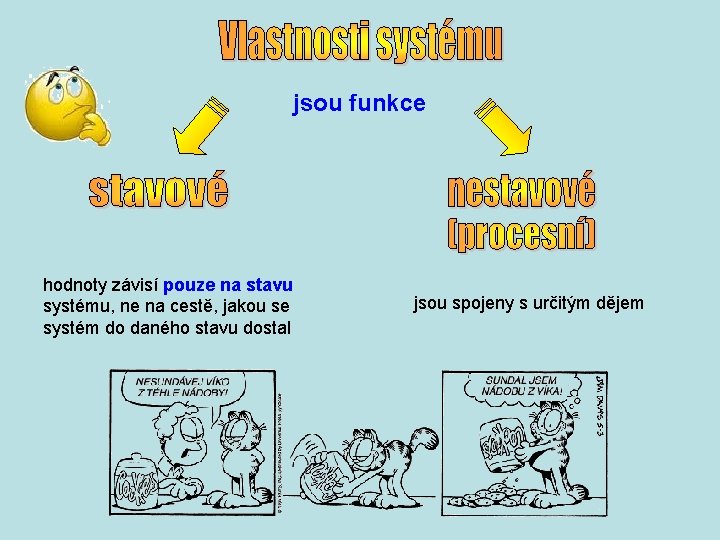
jsou funkce hodnoty závisí pouze na stavu systému, ne na cestě, jakou se systém do daného stavu dostal jsou spojeny s určitým dějem

Hmotnost m základní jednotka 1 kg; menší jednotky: 1 g = 10– 3 kg, 1 mg = 10– 6 kg, 1 g = 10– 9 kg Látkové množství n 1 mol - látkové množství, které obsahuje tolik elementárních jednotek (atomů, molekul, . . . ), kolik je uhlíkových atomů v 0, 012 kg uhlíku 12 C, tj. NA = 6, 02252 1023 atomů/mol (Avogadrova konstanta) Molární hmotnost M hmotnost látky, která obsahuje 1 molekul, tj. tolik molekul, kolik udává Avogadrova konstanta. Rozměr v základních jednotkách SI soustavy: kg mol– 1 - 1000 krát menší než hodnota v g mol– 1, uváděná v tabulkách. m=n M

Základní jednotka: 1 m (délka dráhy, kterou urazí světlo ve vakuu za 1/299792458 s). 1 dm = 10– 1 m, 1 m = 10– 6 m, 1 cm = 10– 2 m, 1 nm = 10– 9 m, 1 mm = 10– 3 m 1 pm = 10– 12 m Základní jednotka absolutní teploty: 1 K (kelvin) 1/273, 16 díl absolutní teploty trojného bodu vody. Celsiova stupnice t (o. C) = T(K) – 273, 15 Fahrenheitova stupnice t (o. F) = 1, 8 [T(K) – 255, 37] Rankinova stupnice t (o. R) = 1, 8 T(K)

Základní jednotka objemu v SI soustavě: 1 m 3 menší jednotky: 1 dm 3, popř. 1 cm 3, dříve 1 litr = 1 dm 3. Molární objem Vm – objem jednoho molu látky Měrný objem Vsp – objem vztažený na určitou hmotnost Měrná hustota – hmotnost objemové jednotky a tedy převrácená hodnota měrného objemu Hustota látkového množství (koncentrace) m látkové množství obsažené v jednotce objemu a tedy převrácená hodnota molárního objemu Vm = M Vsp = M m

síla, kterou systém působí na plošnou jednotku stěny rozměr: síla/plocha v SI soustavě: 1 Pa = 1 N m– 2 = 1 kg m– 1 s– 2 starší jednotky: 1 bar = 105 N m– 2 (v meteorologii, 1 mbar = 102 N m– 2 = hektopascal) 1 atm = 1, 01325 105 N m– 2 1 Torr (= 1 mm Hg) = 1/760 atm = 133, 32 N m– 2

čistá látka - systém, který obsahuje pouze jeden druh molekul směs - systém, který obsahuje více druhů molekul, složky - jednotlivé látky, tvořící systém podle počtu složek: směsi binární (dvousložkové), ternární (třísložkové), kvaternární (čtyřsložkové) roztok - jedna látka je výrazně v přebytku (rozpouštědlo)

Pro určení složení k-složkového systému je zapotřebí k – 1 údajů Hmotnostní zlomek složky i wi = 1 Hmotnostní procento složky i Molární zlomek složky i Molární procento složky i xi = 1

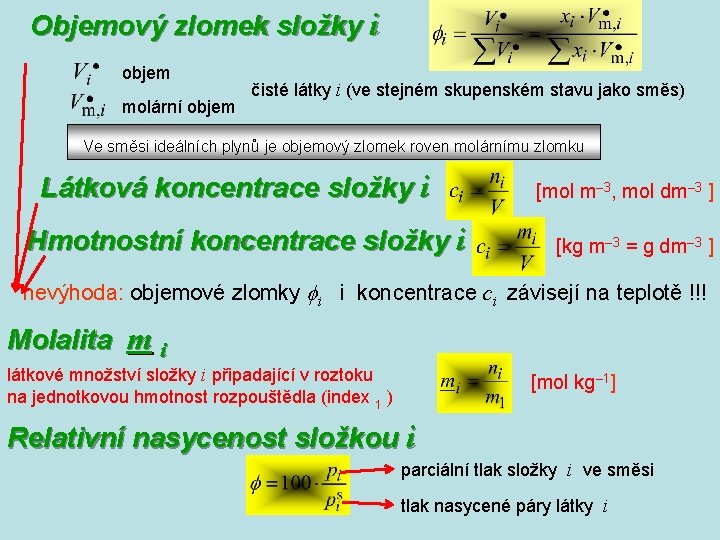
Objemový zlomek složky i objem molární objem čisté látky i (ve stejném skupenském stavu jako směs) Ve směsi ideálních plynů je objemový zlomek roven molárnímu zlomku Látková koncentrace složky i Hmotnostní koncentrace složky i [mol m– 3, mol dm– 3 ] [kg m– 3 = g dm– 3 ] nevýhoda: objemové zlomky i i koncentrace ci závisejí na teplotě !!! Molalita m i látkové množství složky i připadající v roztoku na jednotkovou hmotnost rozpouštědla (index 1 ) [mol kg– 1] Relativní nasycenost složkou i parciální tlak složky i ve směsi tlak nasycené páry látky i

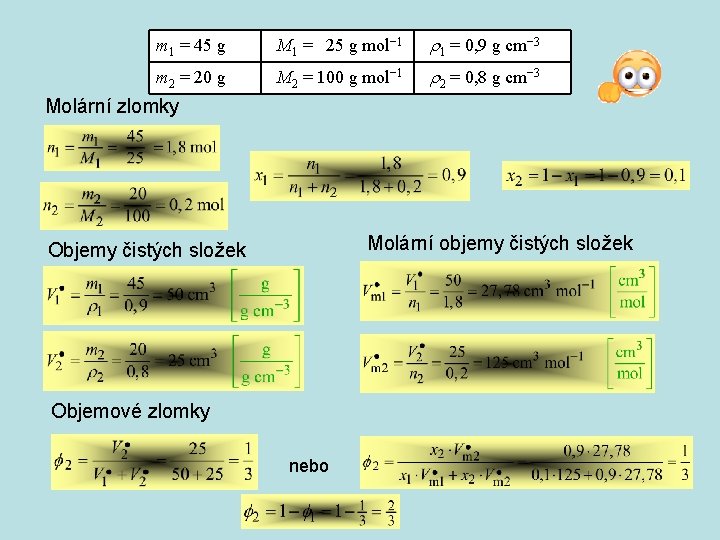
m 1 = 45 g M 1 = 25 g mol− 1 1 = 0, 9 g cm− 3 m 2 = 20 g M 2 = 100 g mol− 1 2 = 0, 8 g cm− 3 Molární zlomky Molární objemy čistých složek Objemové zlomky nebo

Látková koncentrace 2 – rozpuštěná látka, 1 - rozpouštědlo Molalita
 Spisk
Spisk Eva rov
Eva rov Najsk
Najsk Posturologie příklady
Posturologie příklady Zdravá komunikace
Zdravá komunikace Komunikace sklonovani
Komunikace sklonovani Flandersův systém pozorování komunikace ve třídě
Flandersův systém pozorování komunikace ve třídě Skladba komunikace
Skladba komunikace Bliss komunikace
Bliss komunikace Masová komunikace
Masová komunikace Verbální komunikace
Verbální komunikace Diagram komunikace
Diagram komunikace Marketingová komunikace
Marketingová komunikace Dvoustupňový model komunikace
Dvoustupňový model komunikace Pragmatika lidské komunikace
Pragmatika lidské komunikace Surdopedie definice
Surdopedie definice Flandersův systém
Flandersův systém Komunikace sklonovani
Komunikace sklonovani Verbální komunikace
Verbální komunikace Marketingová komunikace
Marketingová komunikace