Oxidan slo Voln atomy a atomy v molekulch















- Slides: 19


Oxidační číslo • Volné atomy a atomy v molekulách prvků mají oxidační číslo 0 • Oxidační číslo vodíku je ve většině sloučenin rovno +I. Výjimkou jsou sloučeniny vodíku s kovy (hydridy), kde má vodík oxidační číslo –I. • Oxidační číslo kyslíku je ve většině sloučenin rovno –II. Výjimkou jsou z běžnějších sloučenin peroxidy, kde má kyslík oxidační číslo –I.

Oxidační číslo • • Fluor má oxidační číslo -I , hliník +III Alkalické kovy (IA. skupina, Li, Na, K) mají oxidační číslo +I Kovy alkalických zemin (IIA. skupina, Be, Mg, Ca, Sr, Ba) mají oxidační číslo +II Kovy mají ve sloučeninách jen kladná oxidační čísla (s výjimkou některých komplexních sloučenin) Součet oxidačních čísel všech atomů v molekule je roven 0, v iontu náboji iontu

Číslovkové předpony 1 3 5 7 9 mono tri penta hepta nona 2 4 6 8 10 Násobné číslovkové předpony dvakrát bis třikrát čtyřikrát tetrakis pětkrát di tetra hexa okta deka tris pentakis

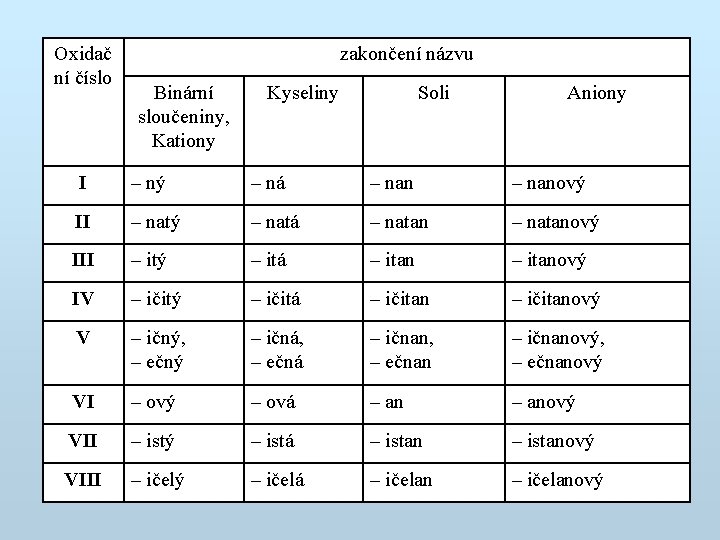
Oxidač ní číslo zakončení názvu Binární sloučeniny, Kationy Kyseliny Soli Aniony I – ný – ná – nanový II – natý – natá – natanový III – itý – itá – itanový IV – ičitý – ičitá – ičitanový V – ičný, – ečný – ičná, – ečná – ičnan, – ečnan – ičnanový, – ečnanový VI – ový – ová – anový VII – istý – istá – istanový VIII – ičelý – ičelá – ičelanový

Binární sloučeniny Záporná oxidační čísla nekovových prvků se pohybují v rozmezí –I až –IV. Podstatné jméno je potom odvozeno od základu mezinárodního názvu prvku zakončením –id, např. halogenid (fluorid, chlorid atd. ) F–I, Cl–I oxid, sulfid, selenid O–II, Se–II borid, nitrid, fosfid, arsenid B–III, N–III, P–III, As–III karbid, silicid C–IV, Si–IV

Názvosloví • Názvosloví hydroxidů a oxokyselin hydroxid vápenatý Ca. II(OH)2–I kyselina sírová H 2 SO 4 • Názvosloví iontů kationt sodný kationt amonný kation oxoniový Na+ NH 4+ H 3 O +

Názvosloví • Názvosloví solí chlorid hlinitý kyanid draselný uhličitan vápenatý hydrogenuhličitan vápenatý • Soli polykyselin tetraboritan disodný Al. Cl 3 KCN Ca. CO 3 Ca(HCO 3)2 Na 2 B 4 O 7

Názvosloví • Hydráty solí heptahydrát síranu zinečnatého Zn. SO 4. 7 H 2 O hemihydrát uhličitanu vápenatého Ca. CO 3. 1/2 H 2 O dihydrát hydrogenfosforečnanu vápenatého Ca. HPO 4. 2 H 2 O • Komplexní sloučeniny ne

Karbidy U karbidů není názvosloví zcela jednoznačné. U mnoha technických karbidů nelze oxidační číslo kovu určit a používá se obecný název karbid kovu, karbid železa Fe 3 C (cementit) Poznámka Ca. C 2 karbid vápenatý triviální název, ve skutečnosti acetylid (ethynid) vápenatý (vápenatá sůl odvozená od acetylénu)

Vícesložkové soustavy V praxi se nejčastěji uplatňují přepočty • látkové množství hmotnost látky • hmotnost látky objem látky • látkové množství objem látky

Výpočty složení roztoků Pět základních vztahů • definice hmotnostního zlomku • definice molární koncentrace • definice hmotnostní koncentrace • definice hustoty • definice počtu molů

Hmotnostní zlomek m(A) w(A) = mc 1, % poměr hmotností přítomných složek

Molární koncentrace n(A) c. M(A) = V mol. dm-3 běžné vyjádření roztoků Relativní molární koncentrace - bezrozměrná

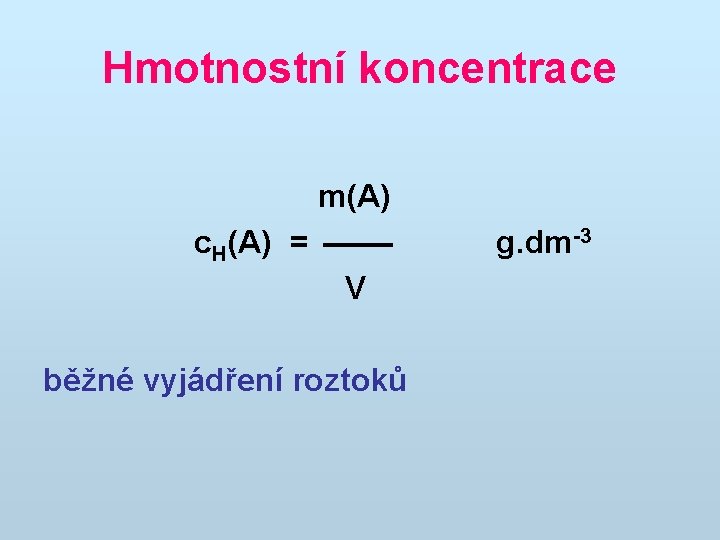
Hmotnostní koncentrace m(A) c. H(A) = V běžné vyjádření roztoků g. dm-3

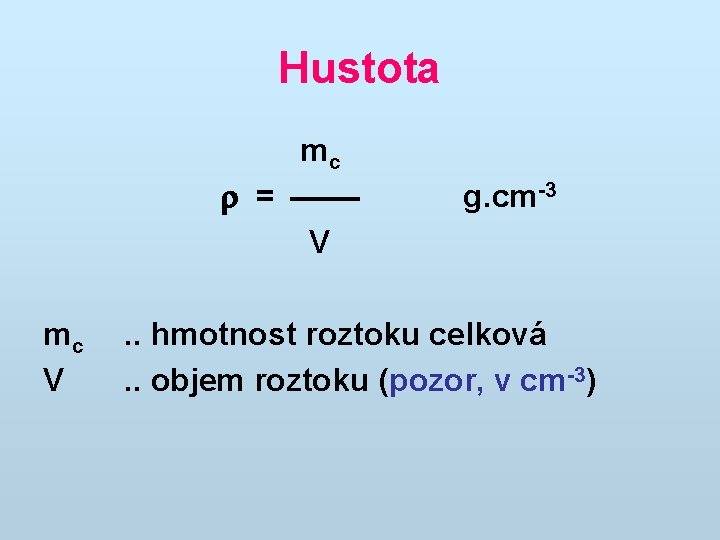
Hustota mc = V mc V g. cm-3 . . hmotnost roztoku celková. . objem roztoku (pozor, v cm-3)

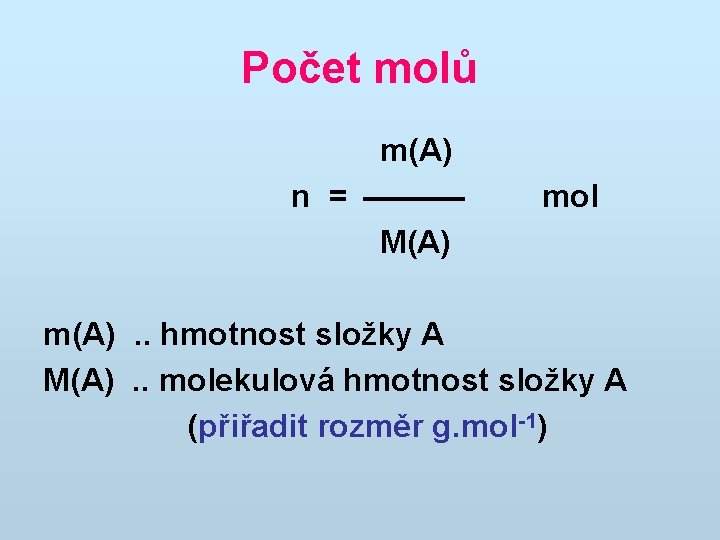
Počet molů m(A) n = M(A) mol m(A). . hmotnost složky A M(A). . molekulová hmotnost složky A (přiřadit rozměr g. mol-1)

Molekulové hmotnosti součet atomových hmotností přítomných atomů Získání z Mendělejevovy tabulky (rozšířené o atomové hmotnosti) z chemických tabulek udávány jako bezrozměrné, přiřadit rozměr g. mol-1

Stechiometrie H 2 SO 4 + 2 Na. OH Na 2 SO 4 + 2 H 2 O 1 x 98 + 2 x 40 142 + 2 x 18 98 g + 80 g 142 g + 36 g
 Pr��ce v cizin��
Pr��ce v cizin�� Voln
Voln Phodn
Phodn ����ad pr��ce chrudim voln�� m��sta
����ad pr��ce chrudim voln�� m��sta Janice toyoshima
Janice toyoshima Slo and ppg examples
Slo and ppg examples Slo by me
Slo by me Learning target examples math
Learning target examples math Slo hoy
Slo hoy Slo abeceda
Slo abeceda Jak šlo šídlo do lesa
Jak šlo šídlo do lesa I slo
I slo Slo+
Slo+ Bcps slo
Bcps slo Class objectives
Class objectives Antropologický obrat
Antropologický obrat Slo student growth tracker
Slo student growth tracker Slo process
Slo process Slo goal statement examples
Slo goal statement examples Slo computational thinking
Slo computational thinking