CO SPOJUJE ATOMY PRVK Co spojuje atomy prvk






























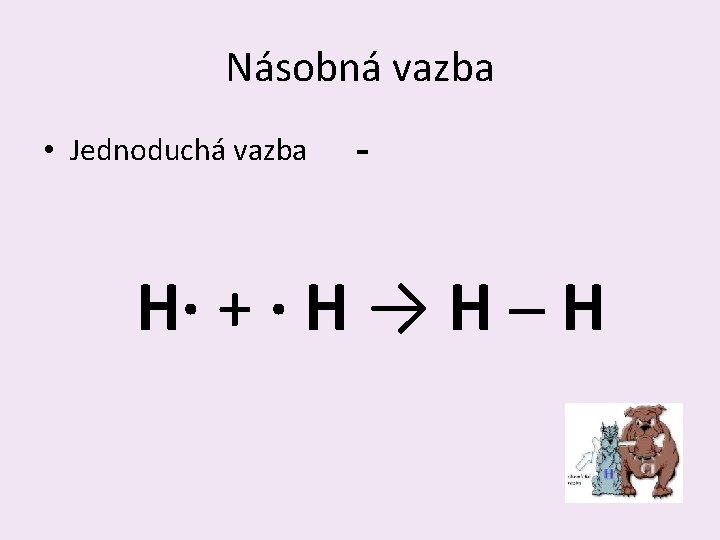
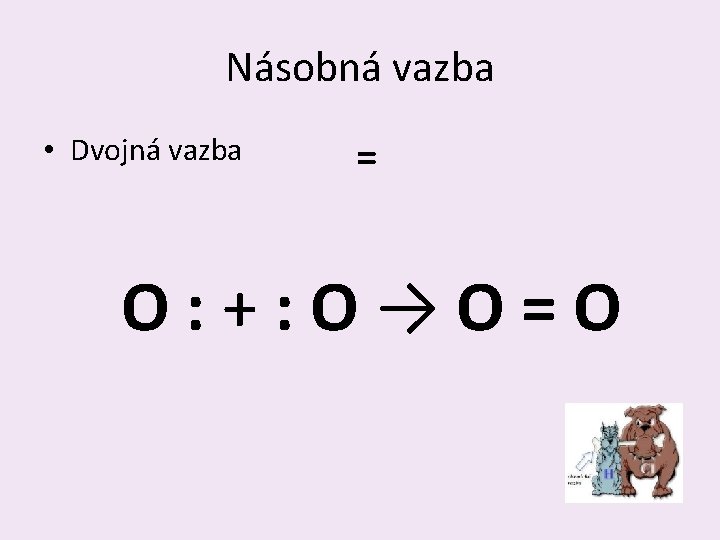
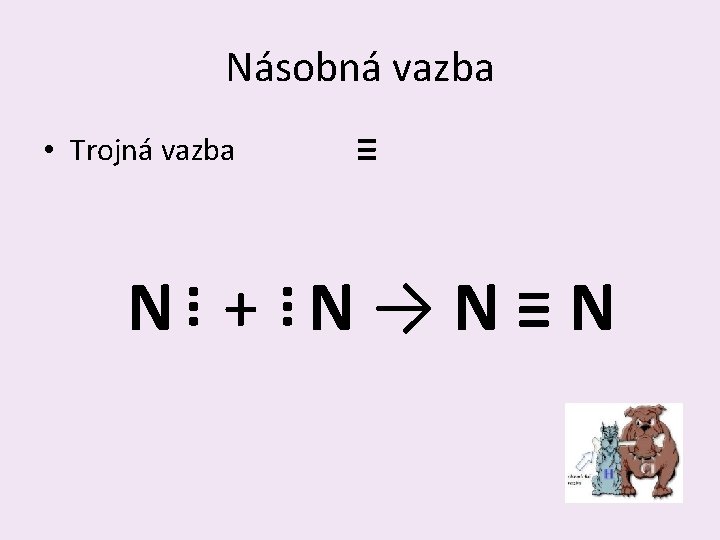

- Slides: 52

CO SPOJUJE ATOMY PRVKŮ ?

Co spojuje atomy prvků? • Molekula = částice tvořená dvěma a více atomy spojenými k sobě

• A jak drží pohromadě? • Co je spojuje? ?

CHEMICKÁ VAZBA • Soudržné síly mezi atomy v molekulách nazýváme chemická vazba

Chemická vazba • Co to je? • Z čeho je?


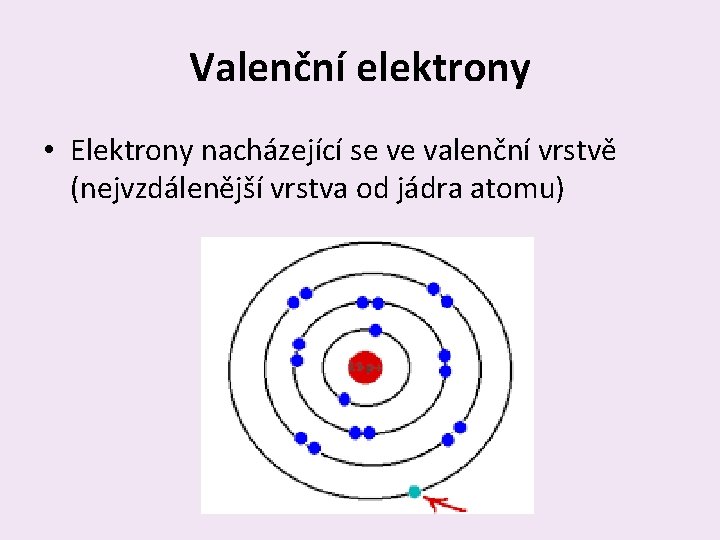
Valenční elektrony • Elektrony nacházející se ve valenční vrstvě (nejvzdálenější vrstva od jádra atomu)

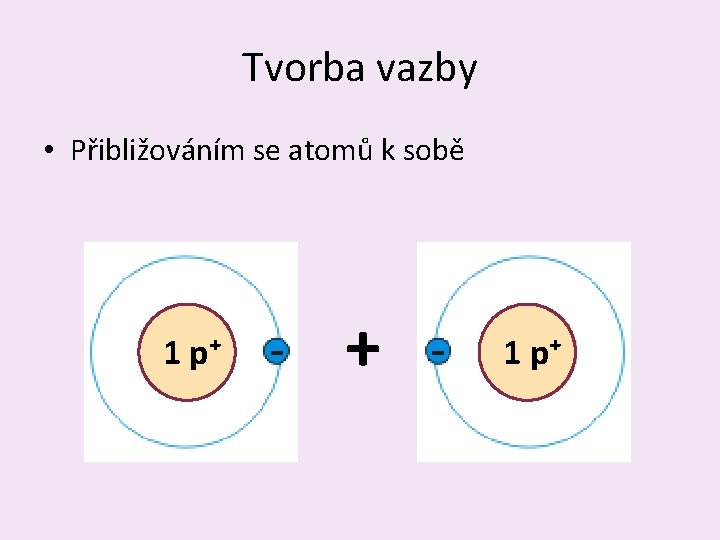
Tvorba vazby • Přibližováním se atomů k sobě 1 p⁺ + 1 p⁺



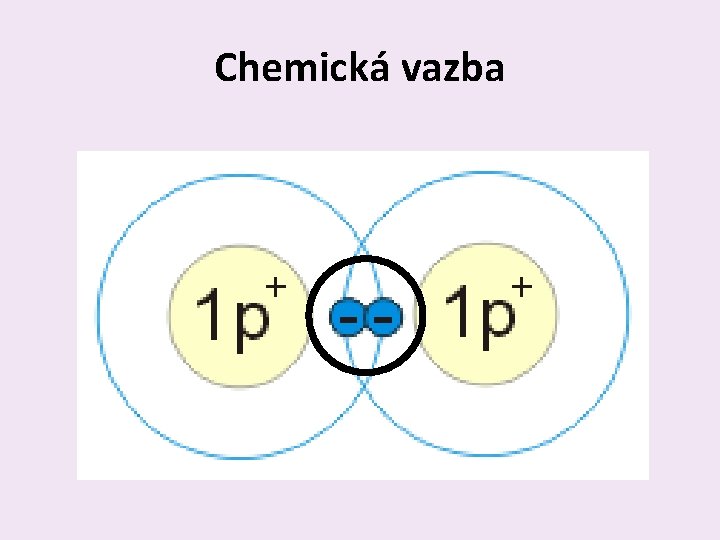
Chemická vazba

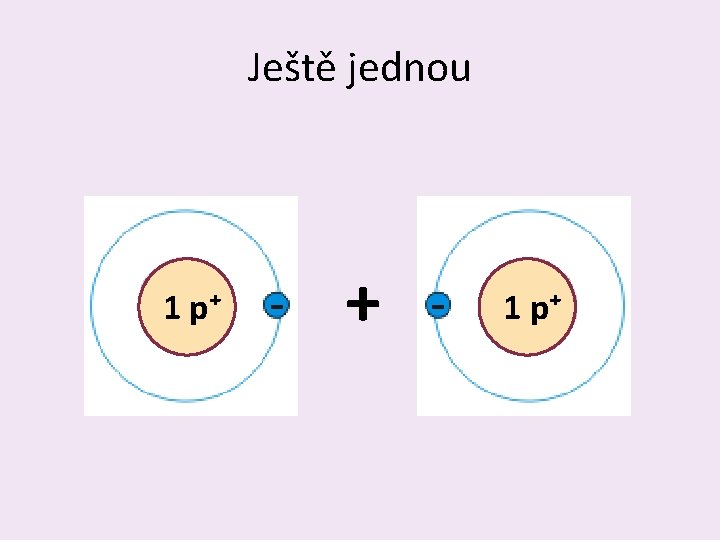
Ještě jednou 1 p⁺ + 1 p⁺



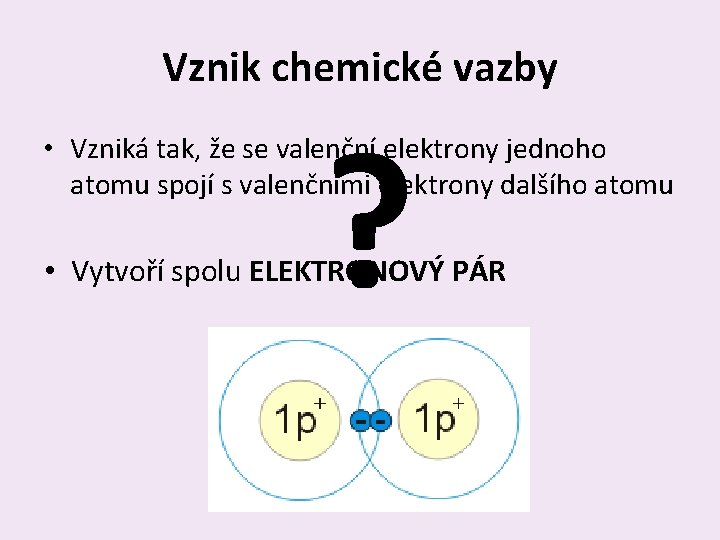
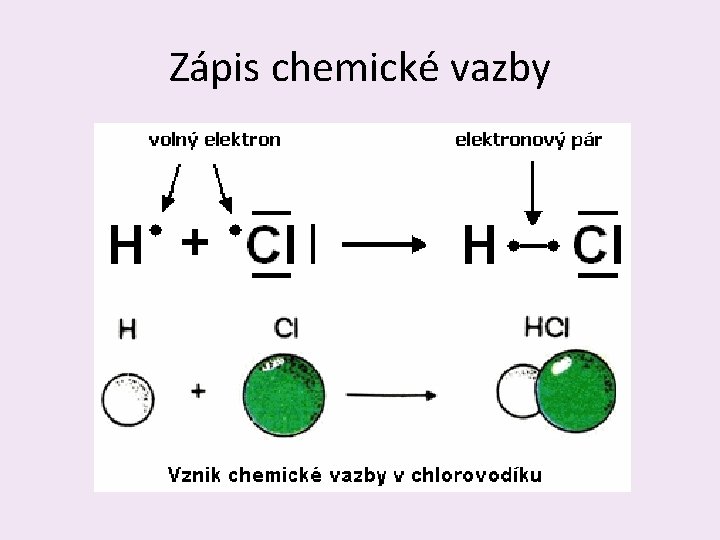
Vznik chemické vazby ? • Vzniká tak, že se valenční elektrony jednoho atomu spojí s valenčními elektrony dalšího atomu • Vytvoří spolu ELEKTRONOVÝ PÁR

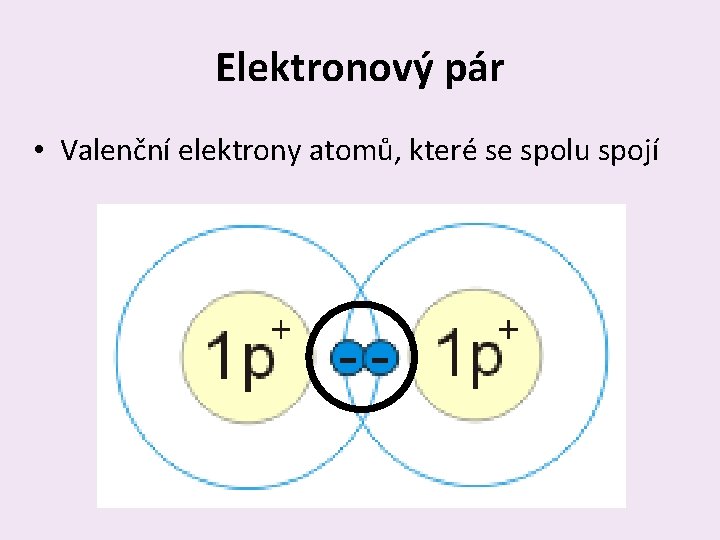
Elektronový pár • Valenční elektrony atomů, které se spolu spojí

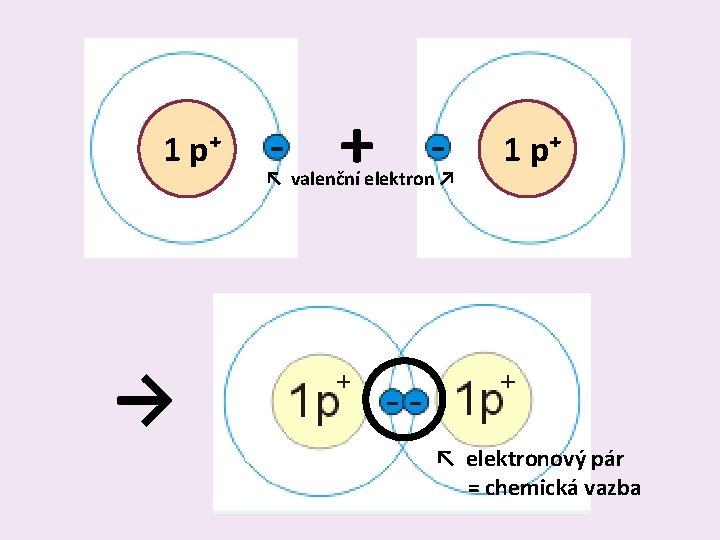
1 p⁺ + ↖ valenční elektron ↗ 1 p⁺ → ↖ elektronový pár = chemická vazba

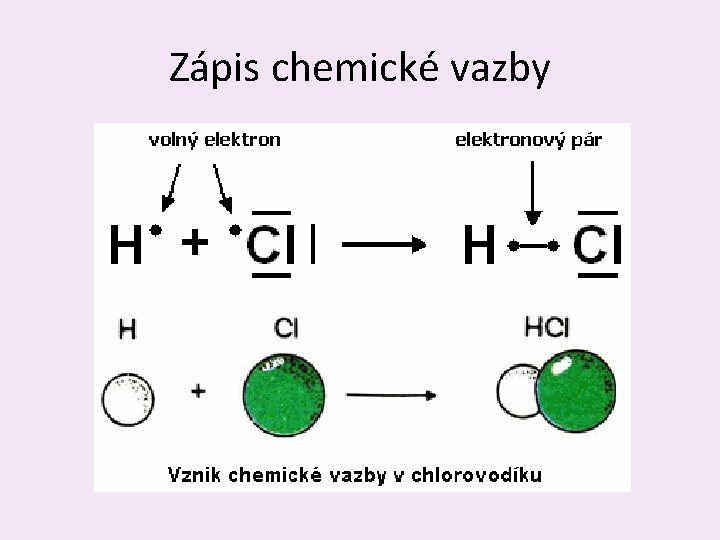
Zápis chemické vazby


Zápis chemické vazby

Příklady ?

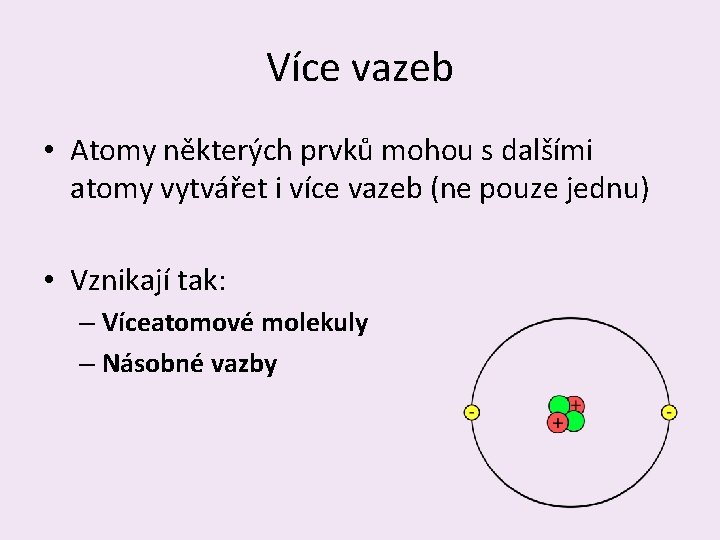
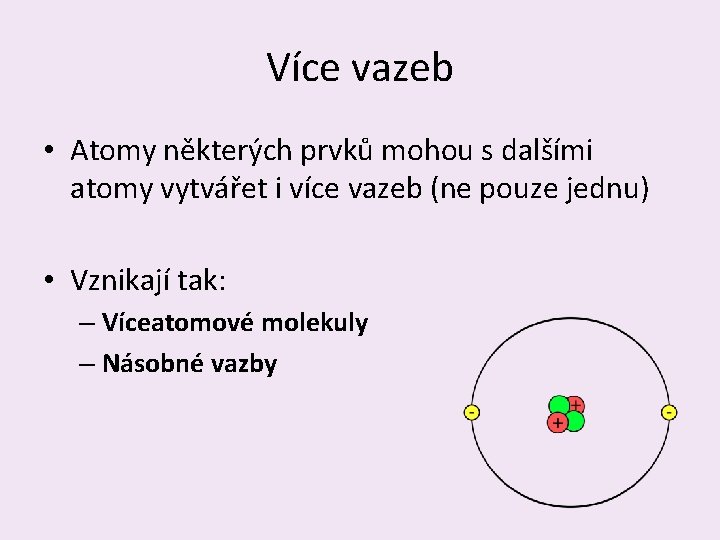
Více vazeb • Atomy některých prvků mohou s dalšími atomy vytvářet i více vazeb (ne pouze jednu) • Vznikají tak: – Víceatomové molekuly – Násobné vazby

Příklady ?

Násobná vazba • Jednoduchá vazba - • Dvojná vazba = • Trojná vazba ≡

Příklady ?

Schopnosti a dovednosti atomů

• Atomy jednotlivých prvků mají různou schopnost poutat k sobě (přitahovat si k sobě) elektrony, které tvoří CHEMICKOU VAZBU

ELEKTRONEGATIVITA • Kde ji najdeme? • Jak ji značíme? • Jak vypadá?

ELEKTRONEGATIVITA • V periodické tabulce prvků • Značka = X • Číslo

Příklady ?

PAMATUJE TE SI

1. Co se stane? + →

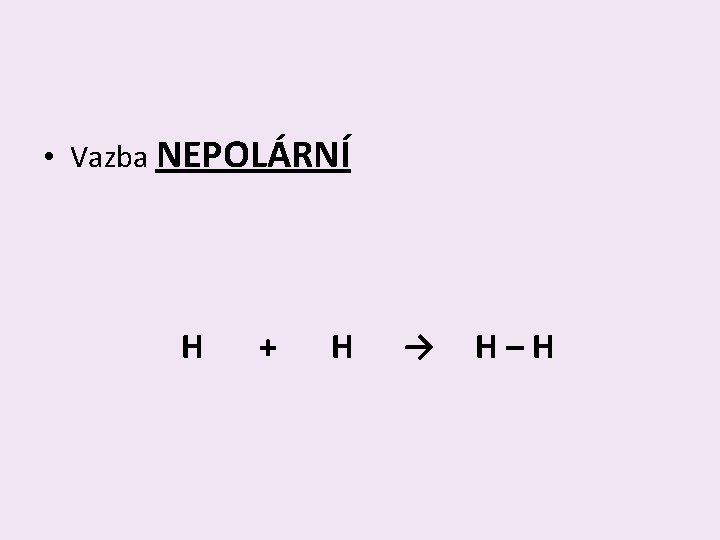
1. Co se stane? • Stejné prvky – Mají STEJNOU sílu (ELEKROMEGATIVITU) H + H → H–H Cl + Cl → Cl – Cl

• Vazba NEPOLÁRNÍ H + H → H–H

2. Co se stane? + →

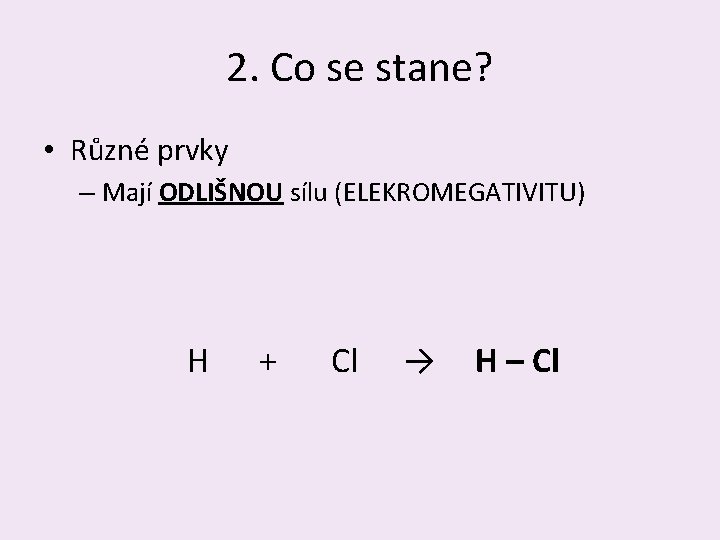
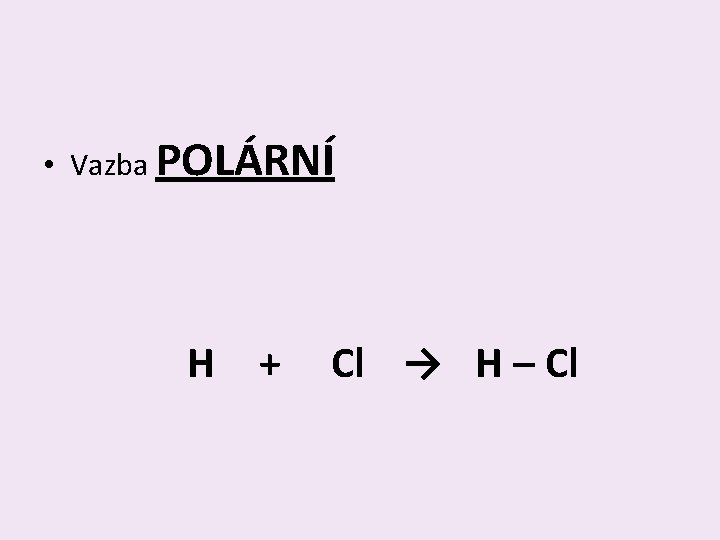
2. Co se stane? • Různé prvky – Mají ODLIŠNOU sílu (ELEKROMEGATIVITU) H + Cl → H – Cl

• Vazba POLÁRNÍ H + Cl → H – Cl

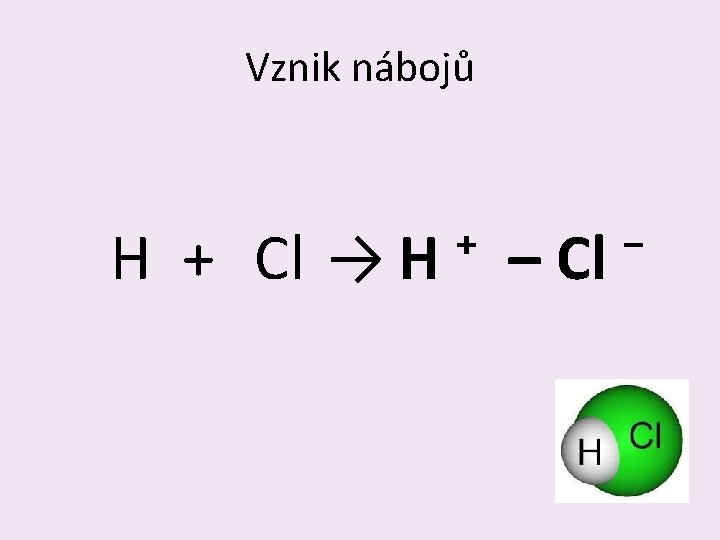
Vznik nábojů H + Cl → H ⁺ – Cl ⁻

• Atom s VĚTŠÍ elektronegativitou získá ZÁPORNÝ náboj (Cl⁻) • Atom s NIŽŠÍ elektronegativitou získá KLADNÝ náboj (H⁺) H ⁺ – Cl ⁻

3. Co se stane? + →

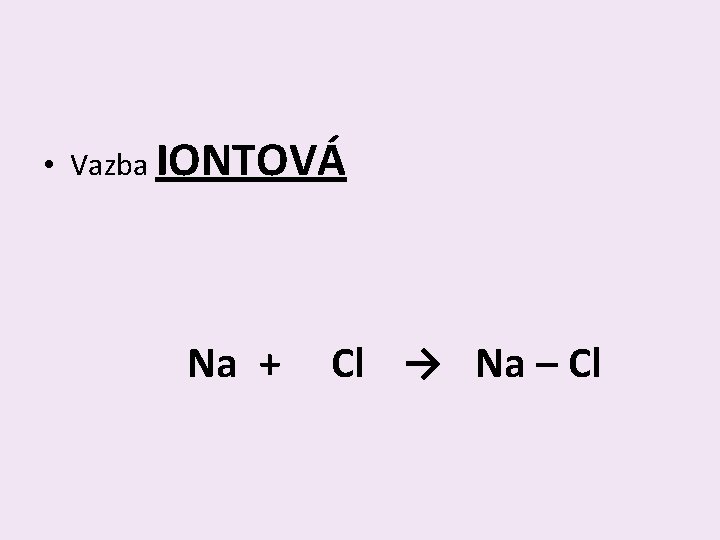
3. Co se stane? • Různé prvky – Mají ODLIŠNOU sílu (ELEKROMEGATIVITU) Na + Cl → Na – Cl

• Vazba IONTOVÁ Na + Cl → Na – Cl

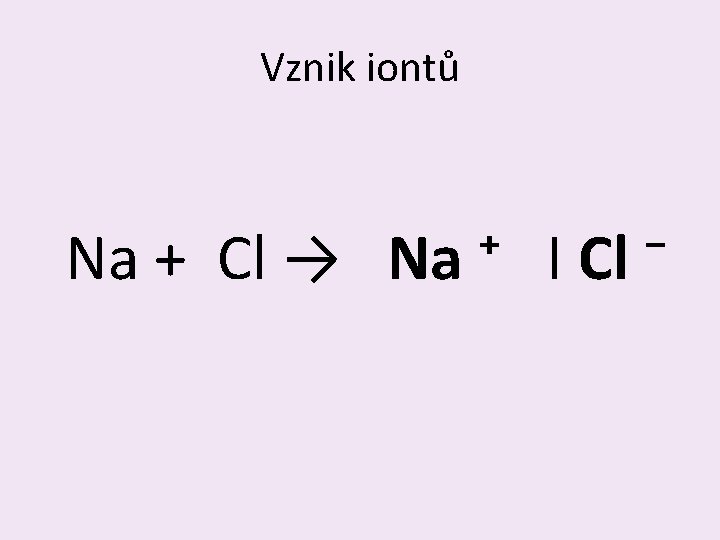
Vznik iontů Na + Cl → Na ⁺ I Cl ⁻

Shrnutí vazeb 1. NEPOLÁRNÍ = H + H → H – H 2. POLÁRNÍ = H + Cl → H – Cl 3. IONTOVÁ = Na + Cl → Na ⁺ I Cl ⁻

Rozdíl elektronegativit 1. NEPOLÁRNÍ = do 0, 4 2. POLÁRNÍ = 0, 4 – 1, 7 3. IONTOVÁ = 1, 7 a výš

Příklady a procvičování ?

CO SPOJUJE ATOMY PRVKŮ - více vazeb

Více vazeb • Atomy některých prvků mohou s dalšími atomy vytvářet i více vazeb (ne pouze jednu) • Vznikají tak: – Víceatomové molekuly – Násobné vazby
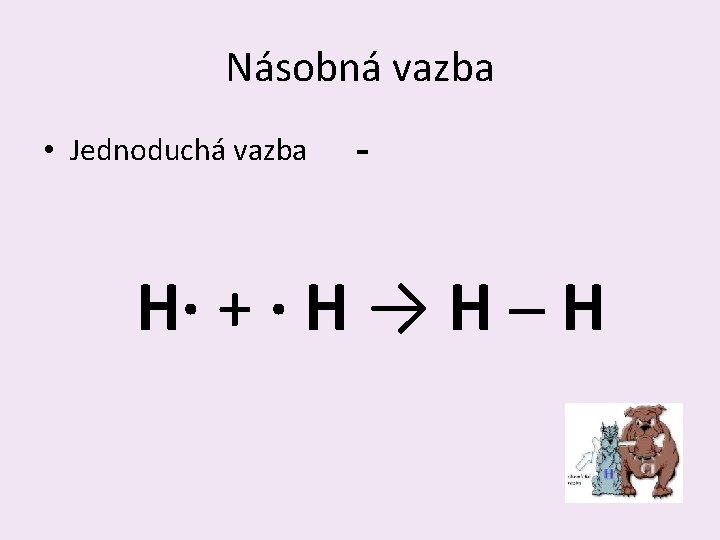
Násobná vazba • Jednoduchá vazba - H∙ + ∙ H → H ─ H
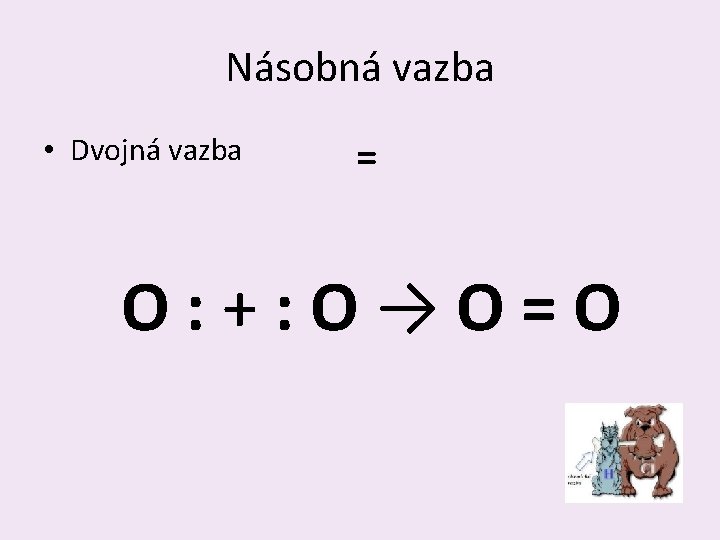
Násobná vazba • Dvojná vazba = O: +: O→O=O
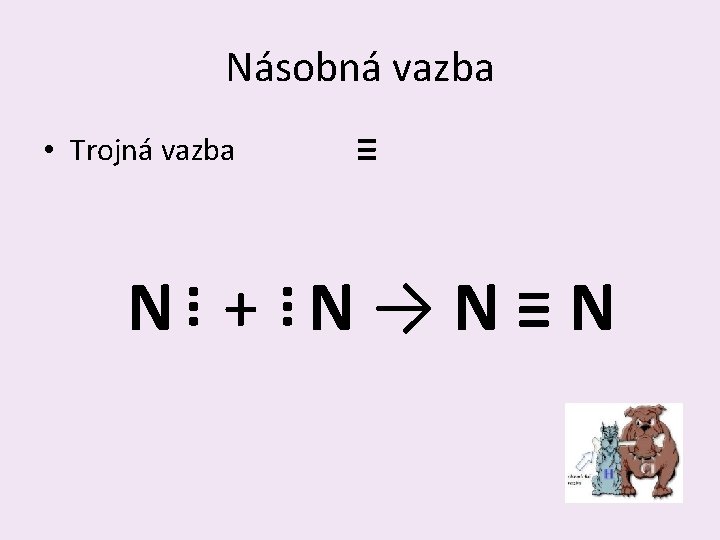
Násobná vazba • Trojná vazba ≡ … … N + N→N≡N

Příklady ?