Jak se atomy spojuj Atomy nejsou samoti V












- Slides: 15

Jak se atomy spojují

Atomy nejsou samotáři V současné době je známo 111 chemických prvků. Z nich je složeno asi 20 000 sloučenin. Každý rok je objeveno 300 000 nových.

Proč se vzácné plyny neslučují Z volných atomů jsou složeny pouze vzácné plyny. Nejstabilnější jsou atomy: a/ s plně obsazenou valenční vrstvou valenčními elektrony b/ s dvojicemi elektronů (páry) ve valenční vrstvě Úkol 1: Napiš značky vzácných plynů a uveď, proč se skládají z volných atomů.

Kontrola úkolu 1 He, Ne, Ar, Kr, Xe, Rn Jejich atomy se neslučují, neboť mají plně obsazenu valenční vrstvu valenčními elektrony.

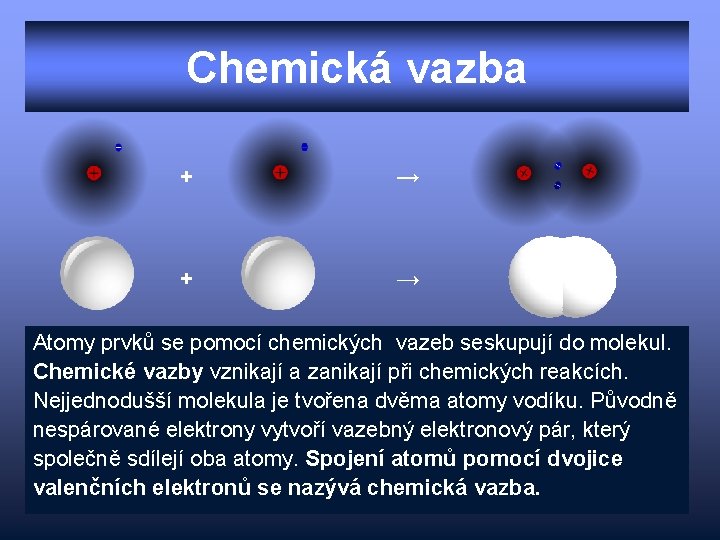
Chemická vazba + → Atomy prvků se pomocí chemických vazeb seskupují do molekul. Chemické vazby vznikají a zanikají při chemických reakcích. Nejjednodušší molekula je tvořena dvěma atomy vodíku. Původně nespárované elektrony vytvoří vazebný elektronový pár, který společně sdílejí oba atomy. Spojení atomů pomocí dvojice valenčních elektronů se nazývá chemická vazba.

Polární a nepolární vazba - Cl 0 – Cl 0 - H+ Cl- Jsou-li vazbou spojeny dva stejné atomy (např. H 2, Cl 2, O 2), jsou vazebné elektrony mezi atomy rozděleny rovnoměrně. Atomy v těchto molekulách mají oxidační číslo 0. Taková vazba je nepolární. V molekule chlorovodíku (HCl) jsou vazebné elektrony více přitahovány atomem chlóru. Na této části molekuly převládá záporný náboj. Molekula má dva póly – kladný a záporný. Vazba je polární.

Elektronegativita (X) je schopnost atomů přitahovat elektrony chemické vazby. Čím je její hodnota větší, tím atom více přitahuje elektrony. Čím je větší rozdíl elektronegativit atomů v molekule, tím je vazba polárnější. U nepolární vazby je rozdíl X = 0, u polární vazby je rozdíl X < 1, 7. Nepolární vazba Cl – Cl: Polární vazba H – Cl: Chlór Vodík Cl Cl Cl H 2, 8 - 2, 8 =0 2, 8 - 2, 2 = 0, 6 Úkol 2: a/ Vyhledej v periodické tabulce prvek s nejmenší a největší X: b/ Šipkou na vazbě označ, který atom více přitahuje vazebné elektrony: Na – F, H – O – H, K – I, Ag – Br, Na – O – H:

Kontrola úkolu 2 a/ nejmenší XFr = 0, 7 největší XF = 3, 98 b/ Na → F H→O←H K→I Ag→ Br Na → O ← H

Iontová vazba v chloridu sodném Jestliže je rozdíl elektronegativit sloučených prvků větší než 1, 7, dochází k odtržení valenčního elektronu od prvku s nižší elektronegativitou (Na). Elektron přijímá atom s vyšší elektonegativitou (Cl). Vznikají tak ionty (kladný kation a záporný anion) a mezi nimi iontová vazba. Atomy jsou vázány k sobě elektrostatickými silami. Vznik kationtu Na+: Nao - e- → Na+ {11 -11+}o - e- → {10 -11+}+ Vznik aniontu Cl-: Clo + e- → Cl{17 -17+}o + e- → {18 -17+}-

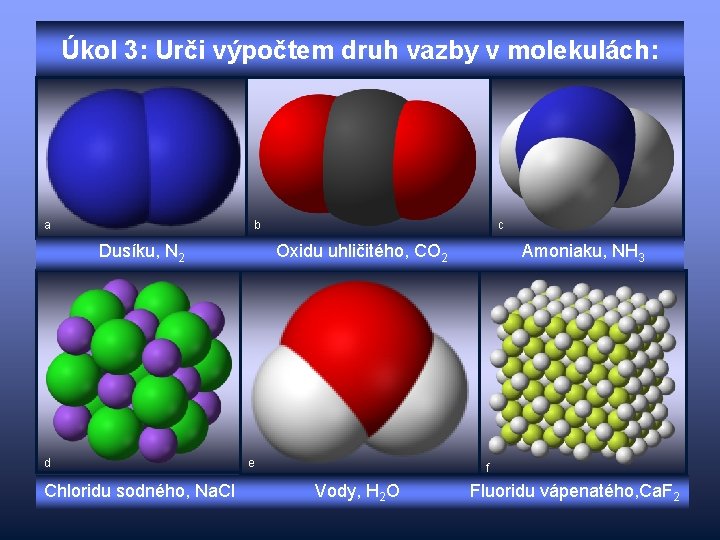
Úkol 3: Urči výpočtem druh vazby v molekulách: a b Dusíku, N 2 d Chloridu sodného, Na. Cl c Oxidu uhličitého, CO 2 e Amoniaku, NH 3 f Vody, H 2 O Fluoridu vápenatého, Ca. F 2

Kontrola úkolu 3 a/ ∆X = XN – XN = 3, 04 – 3, 04 = 0 b/ ∆X = XO – XC = 3, 44 – 2, 55 = 0, 89 c/ ∆X = XN – XH = 3, 04 – 2, 10 = 0, 94 d/ ∆X = XCl – XNa = 3, 16 – 0, 93 = 2, 23 e/ ∆X = XO – XH = 3, 44 – 2, 10 = 1, 34 f/ ∆X = XF – XCa = 3, 98 – 1, 00 = 2, 98 vazba nepolární vazba iontová vazba polární vazba iontová

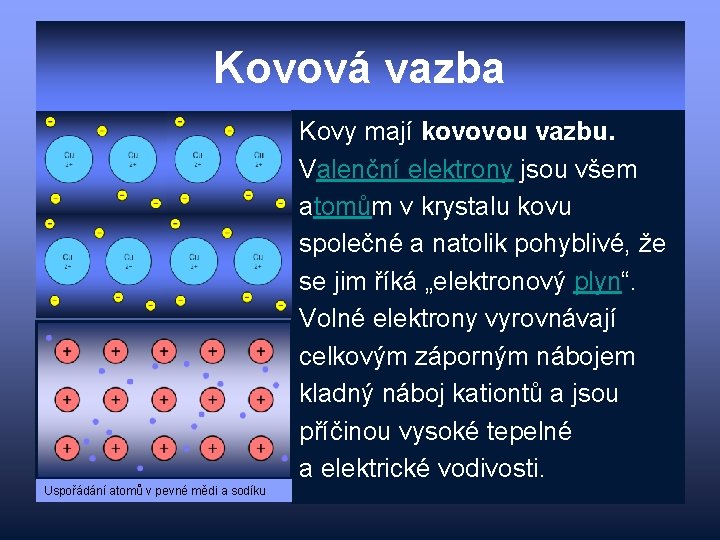
Kovová vazba Kovy mají kovovou vazbu. Valenční elektrony jsou všem atomům v krystalu kovu společné a natolik pohyblivé, že se jim říká „elektronový plyn“. Volné elektrony vyrovnávají celkovým záporným nábojem kladný náboj kationtů a jsou příčinou vysoké tepelné a elektrické vodivosti. Uspořádání atomů v pevné mědi a sodíku

Úkol 4: Shrnutí učiva Z volných atomů jsou složeny pouze …… plyny. Atomy prvků se pomocí chemických …. . seskupují do ……. . Chemické vazby vznikají a zanikají při chemických ……. . E. . …………. . je schopnost atomů přitahovat ……… chemické vazby. U nepolární vazby je rozdíl X =. , u polární vazby je rozdíl X <. , . . Jestliže je rozdíl elektronegativit sloučených prvků větší než 1, 7, dochází ke vzniku ……. vazby. Kovy mají ……. vazbu. …. . elektrony v kovové vazbě jsou příčinou vysoké ……. a ………. vodivosti. Nápověda: kovovou, 0, vzácné, reakcích, 1, 7, tepelné, volné, vazeb, elektronegativita, molekul, elektrony, iontové, elektrické.

Kontrola úkolu 4 Z volných atomů jsou složeny pouze vzácné plyny. Atomy prvků se pomocí chemických vazeb seskupují do molekul. Chemické vazby vznikají a zanikají při chemických reakcích. Elektronegativita je schopnost atomů přitahovat elektrony chemické vazby. U nepolární vazby je rozdíl X = 0, u polární vazby je rozdíl X < 1, 7. Jestliže je rozdíl elektronegativit sloučených prvků větší než 1, 7, dochází ke vzniku iontové vazby. Kovy mají kovovou vazbu. Volné elektrony v kovové vazbě jsou příčinou vysoké tepelné a elektrické vodivosti.

Použité obrázky: Snímek 1: Dostupný pod licencí GNU Free Documentation License na www: http: //commons. wikimedia. org/wiki/File: Oksygenatom. png Snímek 1: Dostupný pod licencí GNU Free Documentation License na www: http: //commons. wikimedia. org/wiki/File: Karbonatom. png Snímek 1: Dostupný pod licencí GNU Free Documentation License na www: http: //commons. wikimedia. org/wiki/File: Carbon-dioxide-3 D-vd. W. svg Snímek 3: Dostupný pod licencí Creative Commons Attribution-Share Alike 2. 0 UK: England & Wales license na www: http: //commons. wikimedia. org/wiki/File: Electron_shell_010_neon. png Snímek 5: Dostupný pod licencí GNU Free Documentation License na www: http: //commons. wikimedia. org/wiki/File: Hydrogen. svg Snímek 5: Dostupný pod licencí GNU Free Documentation License na www: http: //commons. wikimedia. org/wiki/File: Hydrogenatom. png Snímek 5: Dostupný pod licencí public domain na www: http: //commons. wikimedia. org/wiki/File: Hydride. png Snímek 6: Dostupný pod licencí public domain na www: http: //commons. wikimedia. org/wiki/File: Chlorine-3 D-vd. W. png Snímek 6: Dostupný pod licencí GNU Free Documentation License na www: http: //commons. wikimedia. org/wiki/File: HCl_molecule_model. Vd. W_surface. svg Snímek 9: Dostupný pod licencí public domain na www: http: //commons. wikimedia. org/wiki/File: Na. Cl_crystal_structure. png Snímek 10 a: Dostupný pod licencí public domain na www: http: //commons. wikimedia. org/wiki/File: Nitrogen-3 D-vd. W. png Snímek 10 b: Dostupný pod licencí GNU Free Documentation License na www: http: //commons. wikimedia. org/wiki/File: Carbon-dioxide-3 D-vd. W. svg Snímek 10 c: Dostupný pod licencí public domain na www: http: //commons. wikimedia. org/wiki/File: Ammonia-3 D-vd. W. png Snímek 10 d: Dostupný pod licencí public domain na www: http: //commons. wikimedia. org/wiki/File: Sodium-chloride-unit-cell-3 D-ionic. png Snímek 10 e: Dostupný pod licencí public domain na www: http: //commons. wikimedia. org/wiki/File: Water-3 D-vd. W. png Snímek 10 f: Dostupný pod licencí public domain na www: http: //commons. wikimedia. org/wiki/File: Calcium-fluoride-3 D-ionic. png Snímek 12: Dostupný pod licencí public domain na www: http: //commons. wikimedia. org/wiki/File: Metallic_bond_Cu. svg Snímek 12: Dostupný pod licencí public domain na www: http: //commons. wikimedia. org/wiki/File: Nuvola_di_elettroni. svg Mgr. Vaněk Vlastimil, autor
 Polopřímky které nejsou opačné
Polopřímky které nejsou opačné Atomy stainless steel scrubber
Atomy stainless steel scrubber Elektronegativita v psp
Elektronegativita v psp Atomy probiotics faydaları
Atomy probiotics faydaları Academia del exito atomy
Academia del exito atomy Probioticos atomy
Probioticos atomy Atomy a molekuly
Atomy a molekuly Atomy eyebrow pencil
Atomy eyebrow pencil Korean.php4?include= site:com
Korean.php4?include= site:com Eukalides
Eukalides Reakcje kwasow
Reakcje kwasow Algorytm euklidesa dzielenie schemat blokowy
Algorytm euklidesa dzielenie schemat blokowy Jak se jmenujete
Jak se jmenujete Jak řešit šipkové grafy
Jak řešit šipkové grafy Gwiazda socjometryczna
Gwiazda socjometryczna Pseud naczelnika szarych szeregów
Pseud naczelnika szarych szeregów