Organick chemie Vznik organick chemie v Rok 1828






















- Slides: 34

Organická chemie

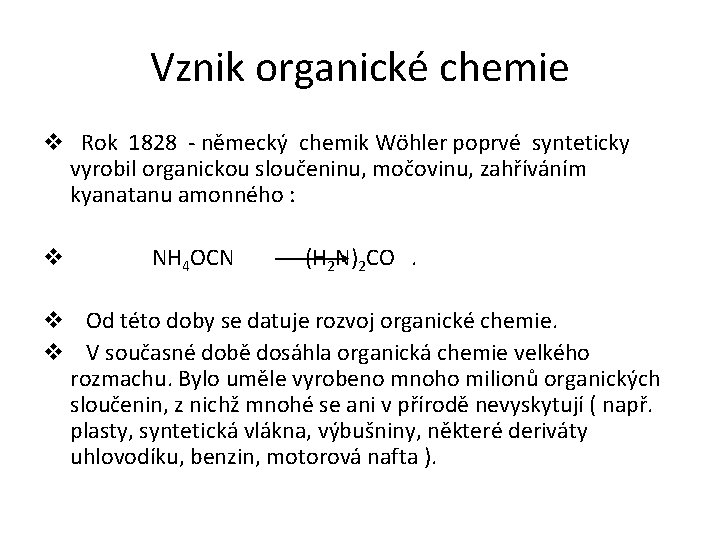
Vznik organické chemie v Rok 1828 - německý chemik Wöhler poprvé synteticky vyrobil organickou sloučeninu, močovinu, zahříváním kyanatanu amonného : v NH 4 OCN (H 2 N)2 CO . v Od této doby se datuje rozvoj organické chemie. v V současné době dosáhla organická chemie velkého rozmachu. Bylo uměle vyrobeno mnoho milionů organických sloučenin, z nichž mnohé se ani v přírodě nevyskytují ( např. plasty, syntetická vlákna, výbušniny, některé deriváty uhlovodíku, benzin, motorová nafta ).

Vlastnosti organických sloučenin V porovnání s anorganickými sloučeninami jsou organické sloučeniny: v méně rozpustné v polárních rozpouštědlech, v jejich reakce jsou pomalejší ( elektronegativita atomu uhlíku je blízká elektronegativitě atomu vodíku ) v většinou nevedou elektrický proud, v mohou být hořlavé, v mají nízké teploty varu, v některé snadno tají, teplem se rozkládají, v jsou lépe rozpustné v nepolárních rozpouštědlech apod. Průběh i rychlost organických reakcí jsou silně ovlivňovány reakčními podmínkami, např. polaritou prostředí, přítomností katalyzátoru, teplotou, koncentrací reaktantů atd. Velmi často lze změnou reakčních podmínek dosáhnout velmi odlišných výsledků (reakce bočné ). Struktura sloučeniny výrazně ovlivňuje reaktivitu organických látek.

Struktura organických sloučenin Stavba elektronového obalu atomu uhlíku: v Z(C) = 6 v A(C) = 12 v počet protonů = 6 v počet elektronů = 6 v počet valenčních elektronů = 4 (2 s 2 2 p 2)

Vazebné možnosti atomu uhlíku v atom uhlíku v základním stavu má konfiguraci 6 C : 1 s 2 2 p 2 , což by umožňovalo vytvořit jen dva překryvy atomových orbitalů 2 p a tím vytvořit jen dvě kovalentní vazby.

v V organických sloučeninách je atom uhlíku téměř vždy čtyřvazný. v Čtyřvaznost atomu uhlíku si vysvětlujeme jeho excitovaným stavem. Po dodání energie je jeden elektron z orbitalu 2 s vybuzen do orbitalu 2 p, ve valenční hladině atomu uhlíku jsou 4 nepárové elektrony, atom uhlíku může vytvořit 4 překryvy vazebných orbitalů, je čtyřvazný : 6 C*: 1 s 2 2 s 1 2 p 3.

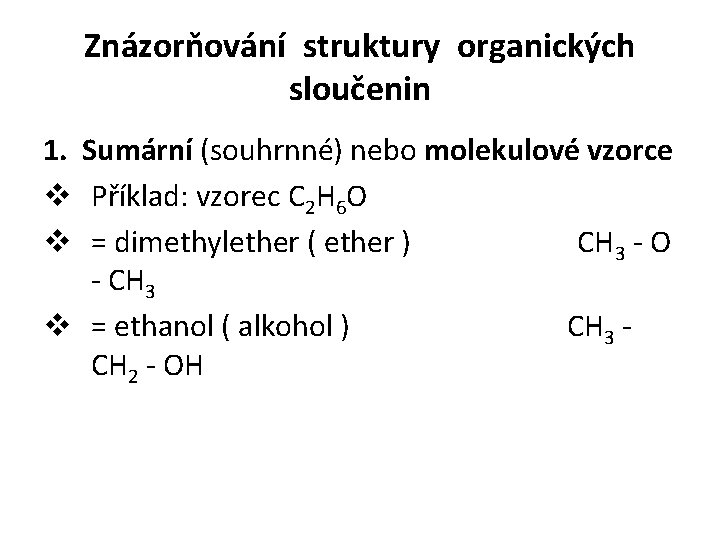
Znázorňování struktury organických sloučenin 1. Sumární (souhrnné) nebo molekulové vzorce v Příklad: vzorec C 2 H 6 O v = dimethylether ( ether ) CH 3 - O - CH 3 v = ethanol ( alkohol ) CH 3 - CH 2 - OH

Izomerie v. Jev kdy více sloučenin majících stejný sumární vzorec se liší strukturou (pořadím atomů, povahou, pořadím nebo prostorovým uspořádáním vazeb), nazýváme izomerie a příslušné sloučeniny jsou izomery.

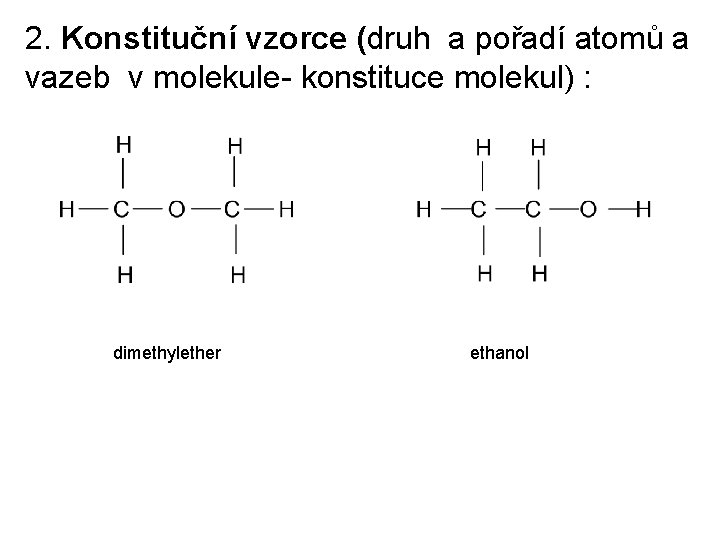
v Pojem struktura = popis uspořádání atomů a vazeb v molekule. v Struktura sloučeniny se popisuje nebo vyjadřuje vzorcem obvykle ve třech různých úrovních - jako konstituce, konfigurace nebo konformace molekuly. v Konstituce popisuje druh a pořadí atomů i vazeb v molekule, nevšímá si však jejich prostorového uspořádání. Sloučeniny se stejným sumárním vzorcem ale odlišnou konstitucí se nazývají konstituční izomery.

v Konfigurace kromě konstituce zahrnuje i popis prostorového uspořádání atomů a vazeb v molekule, zanedbává však rozdíly v prostorovém uspořádání, které vyplývají z otáčení skupin atomů kolem jednoduchých kovalentních vazeb. Sloučeniny stejné konstituce ale lišící se jen konfigurací se nazývají konfigurační izomery.

Konformace popisuje u sloučenin s určitou konfigurací různá prostorová uspořádání, která vznikají rotací částí této molekuly kolem jednoduchých vazeb - konformační izomery (konformery). v v Společný název pro konfigurační a konformační izomery je stereoizomery. v Běžně používané strukturní vzorce organických sloučenin jsou nejčastěji vzorce konstituční.

2. Konstituční vzorce (druh a pořadí atomů a vazeb v molekule- konstituce molekul) : dimethylether ethanol

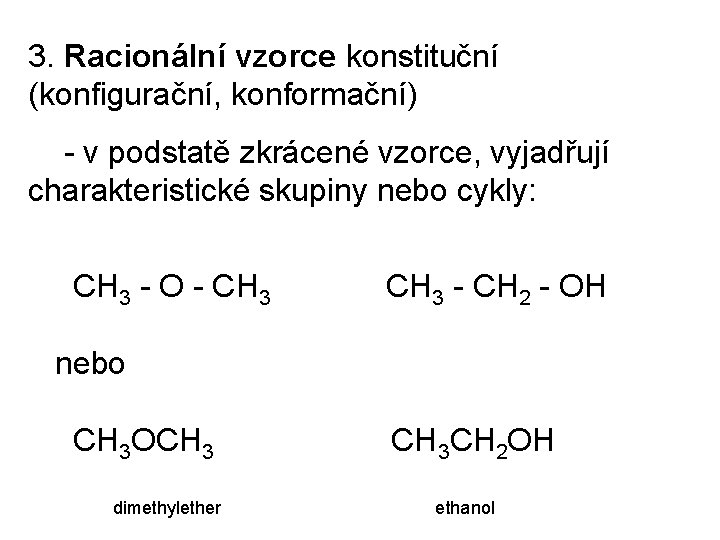
3. Racionální vzorce konstituční (konfigurační, konformační) - v podstatě zkrácené vzorce, vyjadřují charakteristické skupiny nebo cykly: CH 3 - O - CH 3 - CH 2 - OH nebo CH 3 OCH 3 CH 3 CH 2 OH dimethylether ethanol

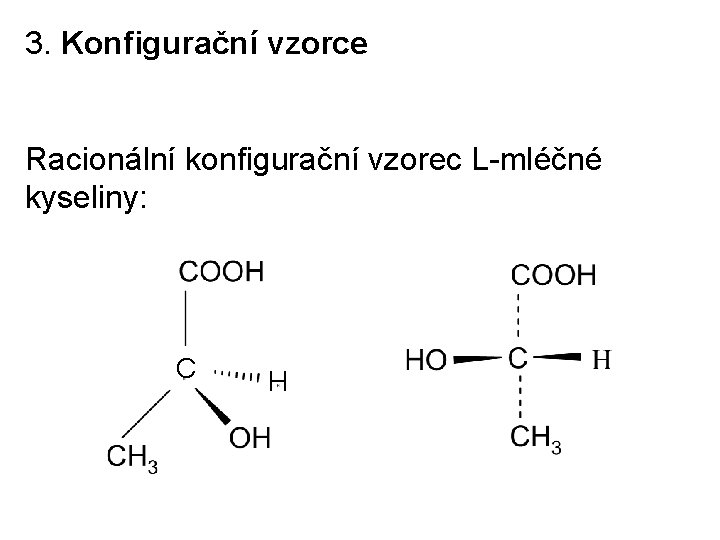
3. Konfigurační vzorce Racionální konfigurační vzorec L-mléčné kyseliny: C H

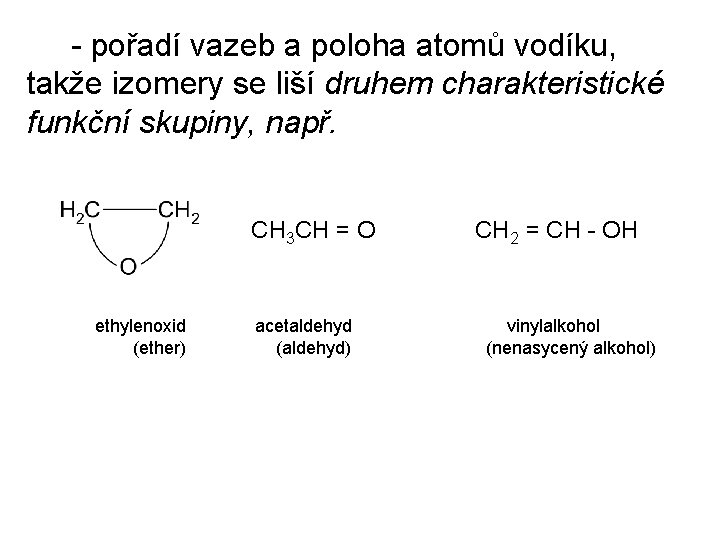
- pořadí vazeb a poloha atomů vodíku, takže izomery se liší druhem charakteristické funkční skupiny, např. CH 3 CH = O CH 2 = CH - OH ethylenoxid acetaldehyd vinylalkohol (ether) (aldehyd) (nenasycený alkohol)

Rozdělení organických sloučenin v uhlovodíky - sloučeniny, jejichž molekuly jsou složeny pouze z atomů uhlíku a vodíku. v deriváty uhlovodíků - organické sloučeniny, které mají v molekule kromě atomů uhlíku a vodíku ještě atom nebo atomy jiných prvků. v Heterocyklické sloučeniny - atom jiného prvku je přímou součástí cyklu, vyskytuje se zde místo atomu uhlíku.

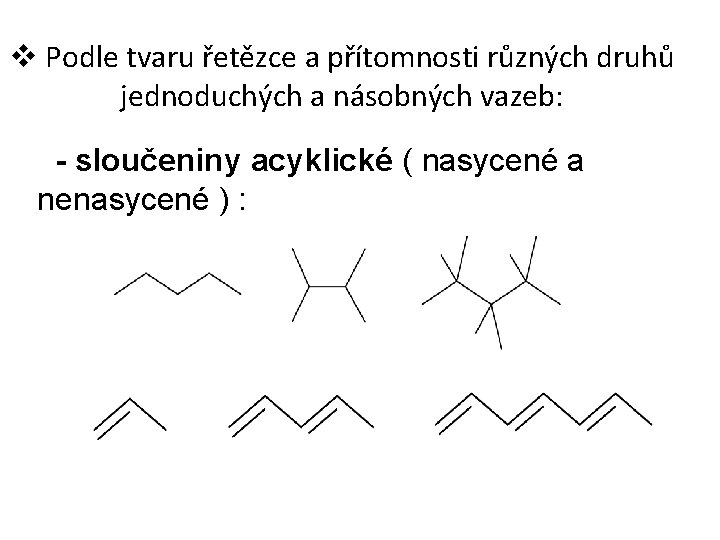
v Podle tvaru řetězce a přítomnosti různých druhů jednoduchých a násobných vazeb: - sloučeniny acyklické ( nasycené a nenasycené ) :

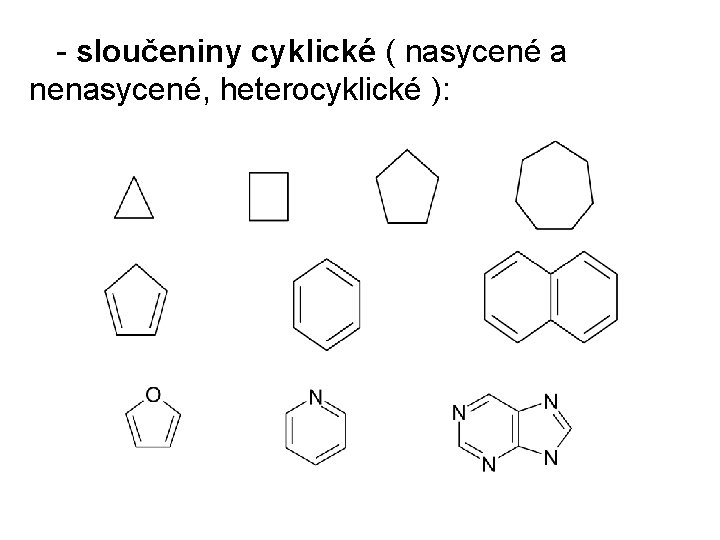
- sloučeniny cyklické ( nasycené a nenasycené, heterocyklické ):

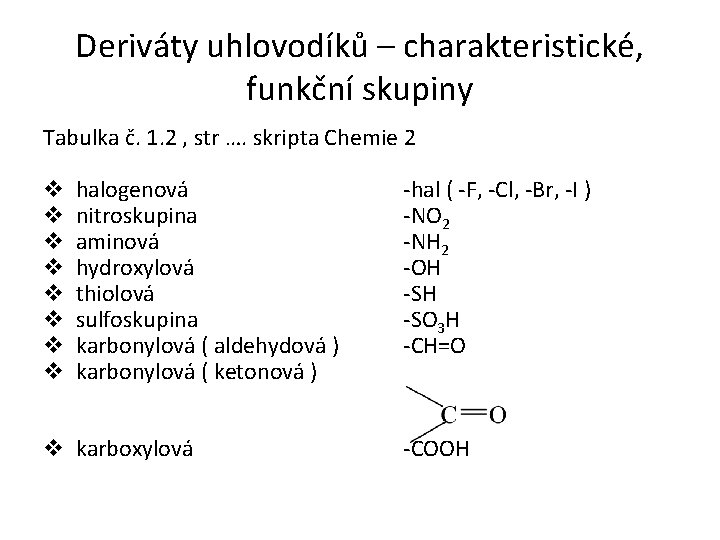
Deriváty uhlovodíků – charakteristické, funkční skupiny Tabulka č. 1. 2 , str …. skripta Chemie 2 v halogenová v nitroskupina v aminová v hydroxylová v thiolová v sulfoskupina v karbonylová ( aldehydová ) v karbonylová ( ketonová ) -hal ( -F, -Cl, -Br, -I ) -NO 2 -NH 2 -OH -SO 3 H -CH=O v karboxylová -COOH

Názvosloví organických sloučenin v Triviální v Systematické ( princip substituční nebo radikálově funkční ) v Polosystematické CH 3 CH 2 COOH = máselná kyselina = butanová kyselina CH 3 CH(OH)CH 2 COOH = β-hydroxymáselná kyselina

Názvosloví necyklických a monocyklických uhlovodíků v Alkany a cykloalkany v Alkeny, cykloalkeny a polyeny v Alkyny v Aromatické uhlovodíky, areny

Princip systematického názvosloví: řecká číslovka ( počet atomů uhlíku meth-, prop-, but-, pent-, hex-, hept-, okt-, non-, dek- ) + zakončení -an -en ( dien, trien ) -yn případně poloha násobné vazby ( číslovka )

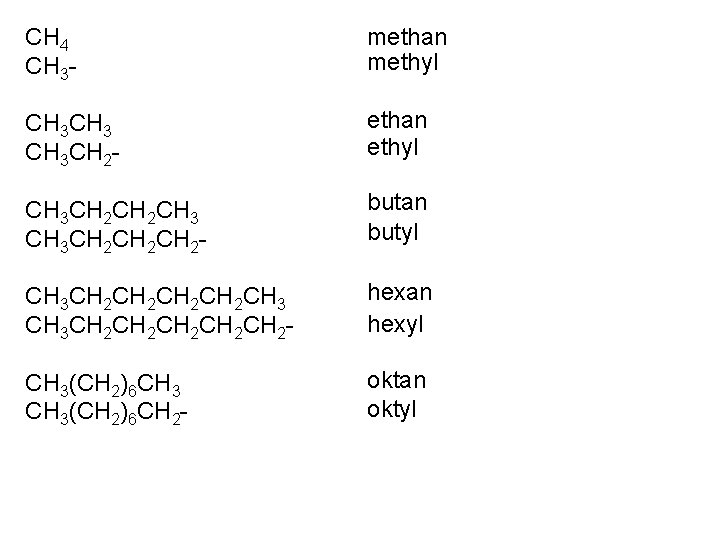
Tvorba složitějších názvů - potřeba znát názvy uhlovodíkových zbytků ( odtržení atomu vodíku z uhlovodíku ): ethan ethyl

methan CH 4 methyl CH 3 - ethan CH 3 ethyl CH 3 CH 2 - butan CH 3 CH 2 CH 3 butyl CH 3 CH 2 CH 2 - CH 3 CH 2 CH 2 CH 3 CH 2 CH 2 CH 2 - hexan hexyl CH 3(CH 2)6 CH 3(CH 2)6 CH 2 - oktan oktyl

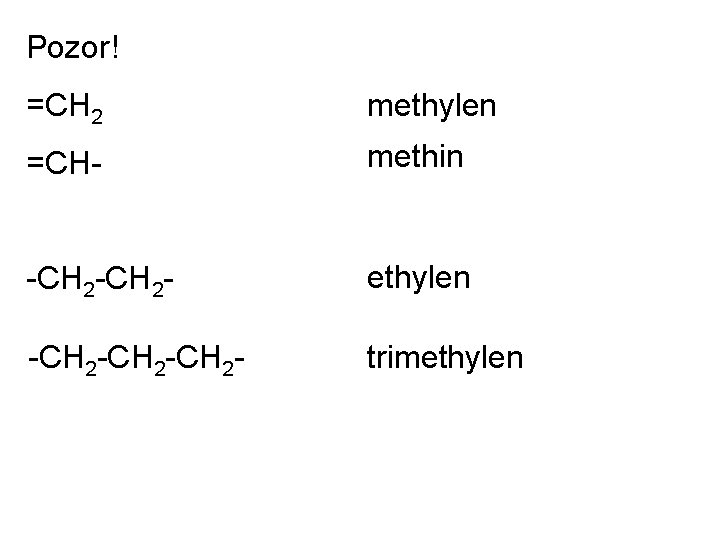
Pozor! =CH 2 methylen =CH- methin -CH 2 - ethylen -CH 2 -CH 2 - trimethylen

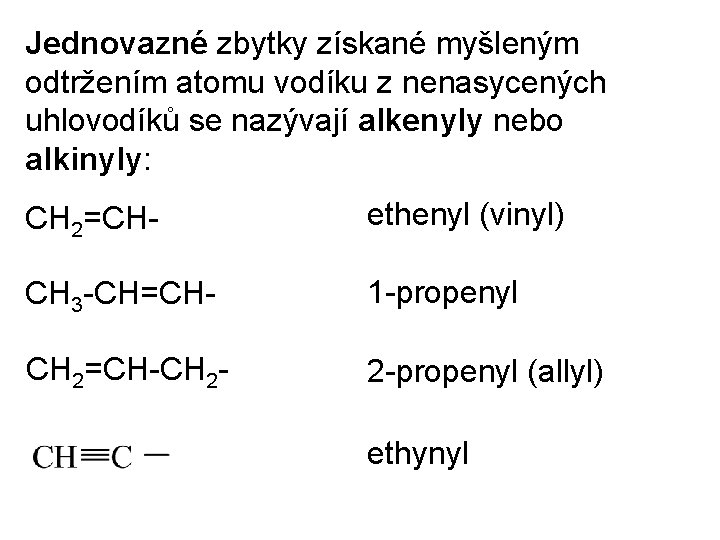
Jednovazné zbytky získané myšleným odtržením atomu vodíku z nenasycených uhlovodíků se nazývají alkenyly nebo alkinyly: CH 2=CH- ethenyl (vinyl) CH 3 -CH=CH- 1 -propenyl CH 2=CH-CH 2 - 2 -propenyl (allyl) ethynyl

Pravidla pro tvoření názvů necyklických uhlovodíků 1. Za základní strukturu označíme nejdelší uhlíkový řetězec jen nejsou-li násobné vazby. V případě, že ve sloučenině jsou násobné vazby, je nejdelší řetězec ten, který obsahuje nejvíce násobných vazeb.

2. Základní řetězec očíslujeme : a) nejsou-li násobné vazby číslujeme od konce, k němuž je nejblíže rozvětvení - připojen postranní řetězec, b) je-li přítomna násobná vazba ( dvojná nebo trojná ) číslujeme od toho konce, k němuž je násobná vazba blíže ( tak, aby atom uhlíku, z něhož dvojná nebo trojná vazba vychází, měl nejnižší možné číslo, přitom má dvojná vazba přednost před trojnou vazbou ).

3. Dále napíšeme název základního řetězce, vyjádříme polohu násobných vazeb a přidáme zakončení vyjadřující přítomnost násobné ( násobných ) vazby ( vazeb ). 4. V názvech oddělujeme čísla a text pomlčkou, mezi čísly píšeme čárku. 5. Názvy vedlejších řetězců, alkylů, seřadíme podle abecedy, před jejich názvy píšeme číslo, které vyjadřuje, na který atom uhlíku hlavního řetězce je vedlejší řetězec připojen.

6. Pokud je to nutné ( rozvětvení vedlejšího řetězce ), očíslujeme i vedlejší řetězce. Očíslujeme je od místa připojení k hlavnímu řetězci. V takovém případě je složený název rozvětveného vedlejšího řetězce psán do závorky.

Pravidla pro tvoření názvů monocyklických uhlovodíků 1. Názvy nasycených monocyklických uhlovodíků bez postranních řetězců vytvoříme připojením předpony cyklo- ke jménu nerozvětveného alifatického uhlovodíku, který má stejný počet atomů uhlíku. 2. Jednovazné zbytky vytvoříme od cykloalkanů stejným způsobem jako u alkanů a uhlík s volnou vazbou nese číslo 1 ( např. cyklopropan - cyklopropyl ).

3. Pokud má cykloalkan jako postranní řetězce jednoduché alkyly, očíslujeme uhlíky kruhu tak, aby těm, z nichž vycházejí alkyly, příslušela nejnižší čísla, uhlovodík pak považujeme za substituovaný cykloalkan. Jeli postranní řetězec složitější, uhlovodík se považuje za odvozený od alkanu s otevřeným řetězcem.

4. U nenasycených cyklických uhlovodíků číslujeme cyklus tak, aby násobná vazba měla co nejnižší číslo. Číslo, jež označuje uhlík, z něhož násobná vazba vychází, se umisťuje za název cyklického uhlovodíku. Podle typu násobné vazby připojíme zakončení -en, -yn, dien, -diyn atd. 5. Pro zjednodušení velmi často používáme grafické znázornění vzorců cykloalkanů, ve kterých nezapisujeme atomy uhlíku a vodíku.

Psaní vzorců uhlovodíků Při psaní vzorců podle názvů postupujeme naopak. Nejprve napíšeme hlavní uhlíkový řetězec, případně cyklický uhlovodík, očíslujeme jej, vyznačíme násobné vazby a zapíšeme postranní řetězce.
 1910-1828
1910-1828 What is the melody of gretchen am spinnrade
What is the melody of gretchen am spinnrade 1905-1828
1905-1828 Revolucion mexicana
Revolucion mexicana When was andrew jackson inaugurated
When was andrew jackson inaugurated Austracos
Austracos Jean henri dunant
Jean henri dunant 1828
1828 The yale report of 1828
The yale report of 1828 1910-1828
1910-1828 1910-1828
1910-1828 1910-1828
1910-1828 Vznik velkej moravy
Vznik velkej moravy Stavovské divadlo
Stavovské divadlo Renesančná novela
Renesančná novela Liturgie
Liturgie Amoniak vazba
Amoniak vazba Vznik jazzu
Vznik jazzu Kabaret vznik
Kabaret vznik Csr vznik
Csr vznik Judaismus vznik
Judaismus vznik Hinduizmus symboly
Hinduizmus symboly Postavení ve volejbale
Postavení ve volejbale Dějiny udatného českého národa vznik čsr
Dějiny udatného českého národa vznik čsr Jak vzniká uhlí
Jak vzniká uhlí Vznik eu
Vznik eu Zakladatel velkej moravy
Zakladatel velkej moravy Nadace albatros vznik
Nadace albatros vznik Vznik hip hopu
Vznik hip hopu Vznik franskej ríše
Vznik franskej ríše Vznik jednosmerneho prudu
Vznik jednosmerneho prudu Slova skladanim
Slova skladanim Vymretie arpadovcov
Vymretie arpadovcov Naturalismus
Naturalismus Slovinsko vznik
Slovinsko vznik