Organick chemie MARTIN VEJRAKA Organick chemie Syntza mooviny





















- Slides: 40

Organická chemie MARTIN VEJRAŽKA

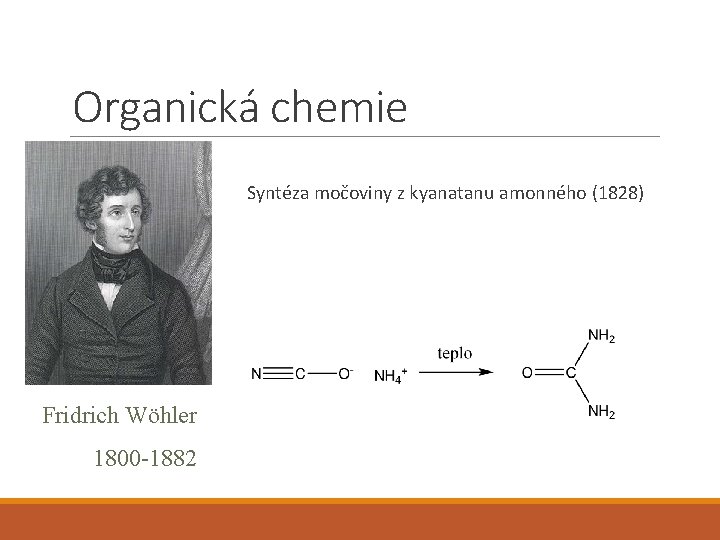
Organická chemie Syntéza močoviny z kyanatanu amonného (1828) Fridrich Wöhler 1800 -1882

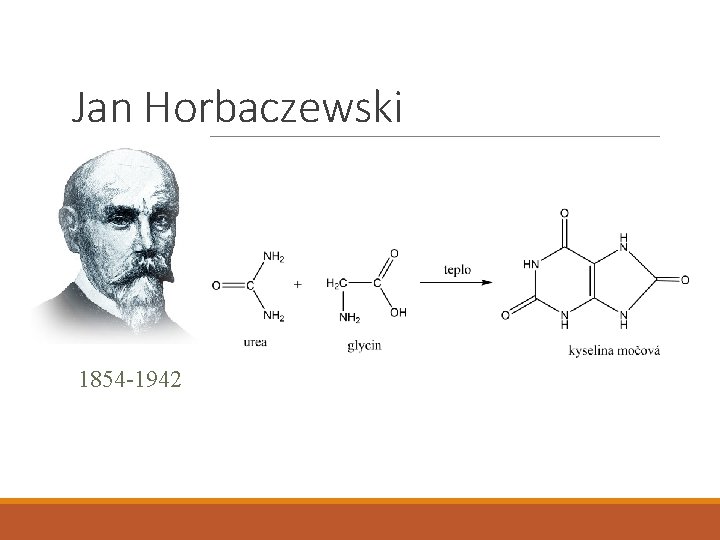
Jan Horbaczewski Absolvent vídeňské lékařské fakulty Zakladatel Ústavu pro lučbu lékařskou (1883) Syntéza kyseliny močové (1882) 1854 -1942

Jan Horbaczewski 1854 -1942

Jan Horbaczewski Během dalších pokusů: • Kyselina močová vzniká pouze při rozpadu jaderných buněk, nikoliv bezjaderných • Oddělil kyselinu močovou od xantinu a dalších purinů 1854 -1942 • Předpokládal, že kyselina močová z nich vzniká

Vazba v organických sloučeninách

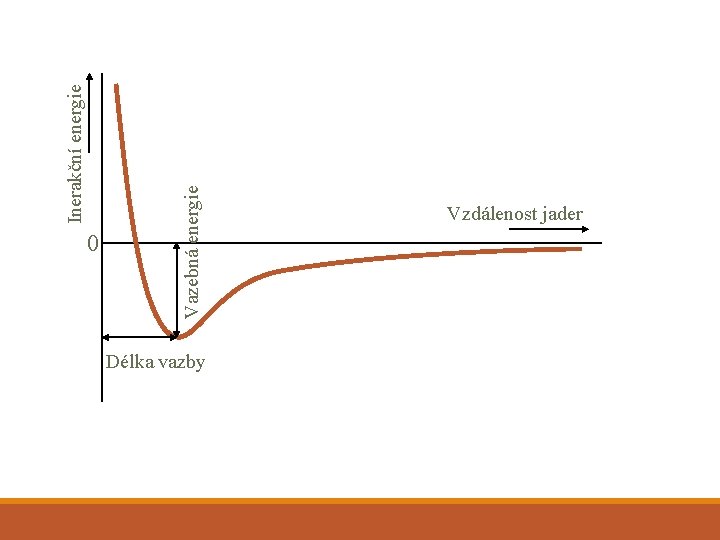
Inerakční energie Vazebná energie 0 Délka vazby Vzdálenost jader

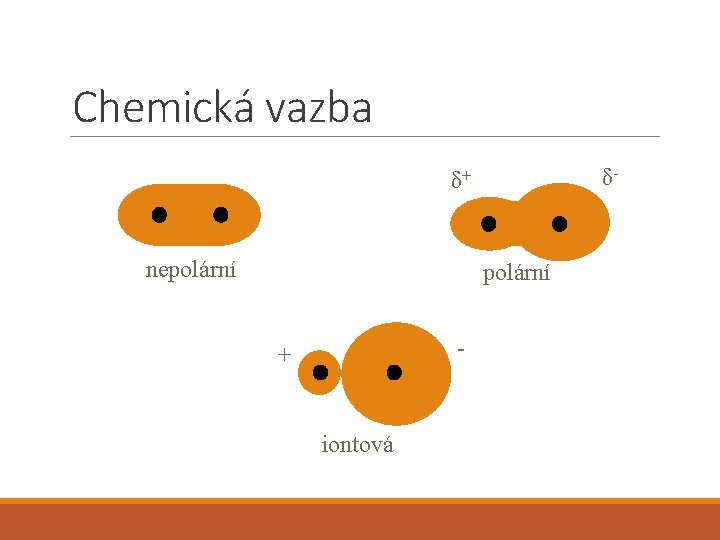
Chemická vazba δ- δ+ nepolární - + iontová

Polarita vazby Rozdíl elektronegativit Nepolární < 0, 4 Polární 0, 4− 1, 7 Iontová > 1, 7

Elektronegativita Převzato z: https: //www. quora. com/What-are-the-definitions-of-oxidation-number-and-formal-charge

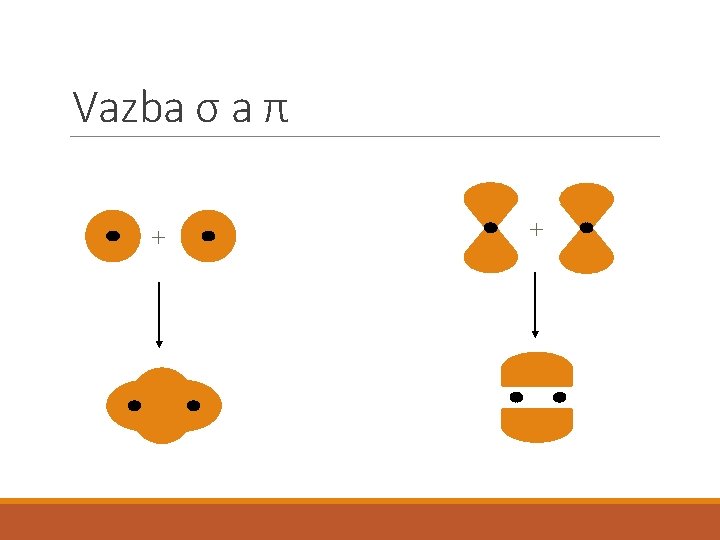
Vazba σ a π + +

Kovalentní vazba σ π Delší Kratší Možná rotace Nemůže rotovat Násobná vazba: pevnější

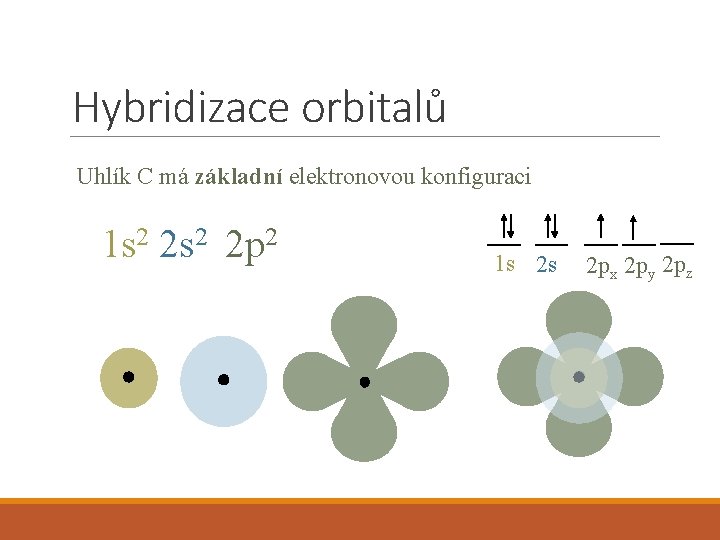
Hybridizace orbitalů Uhlík C má základní elektronovou konfiguraci 1 s 2 2 p 2 1 s 2 s 2 px 2 py 2 pz

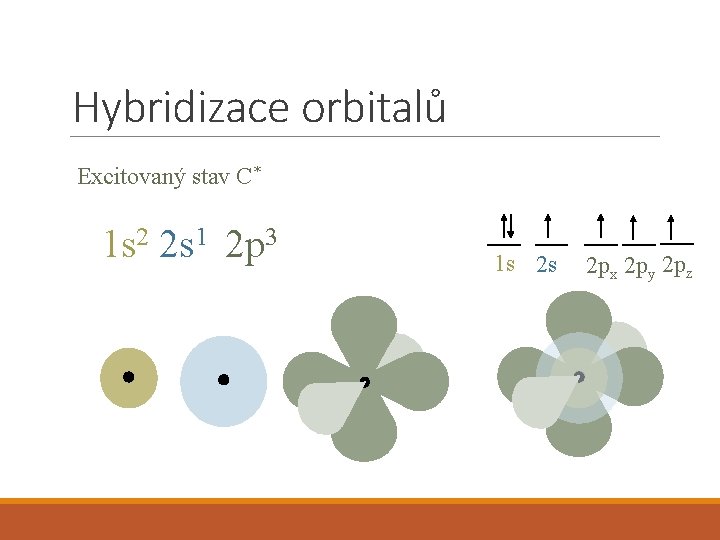
Hybridizace orbitalů Excitovaný stav C* 1 s 2 2 s 1 2 p 3 1 s 2 s 2 px 2 py 2 pz

Hybridizace orbitalů Hybridizace C* 1 s sp 3

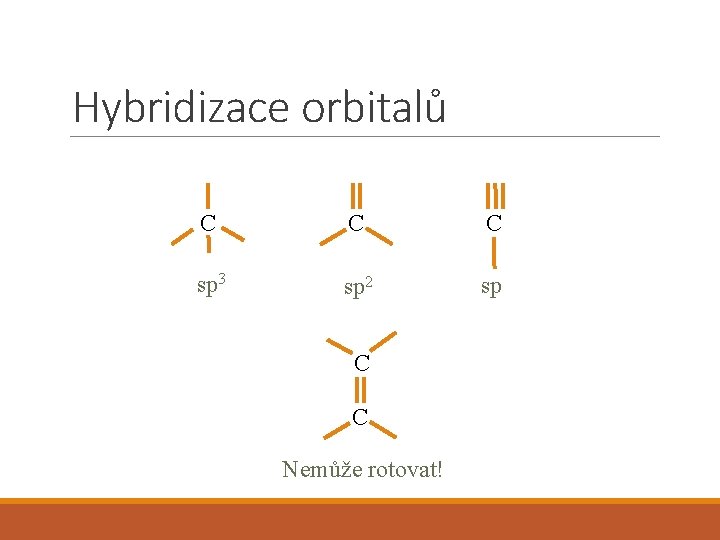
Hybridizace orbitalů C C C sp 3 sp 2 sp C C Nemůže rotovat!

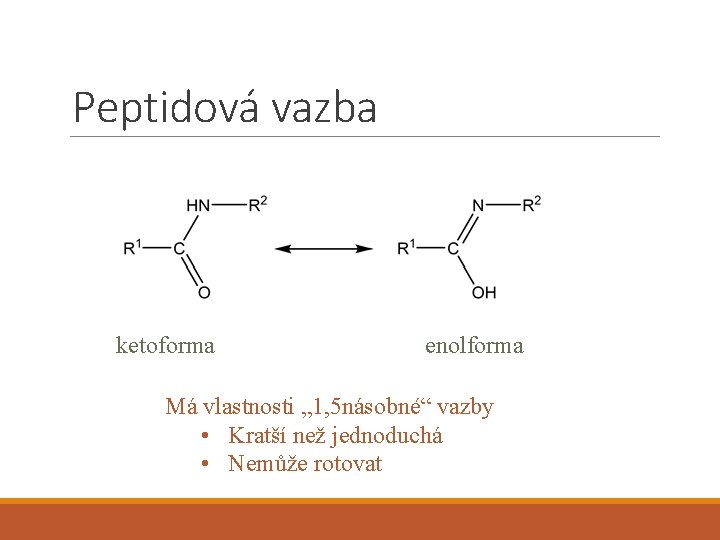
Hybridní vazby Např. „ 1, 5 násobná“ vazba • Delší než dvojná, kratší než jednoduchá • Energetické vlastnosti mezi jednoduchou a dvojnou • Nemůže rotovat • Karboxylová skupina • Benzenové jádro O C O

Nevazebné interakce • Van der Waalsovy síly • Převážně v nepolárních molekulách https: //www. flickr. com/photos/lizard_queen/97118836

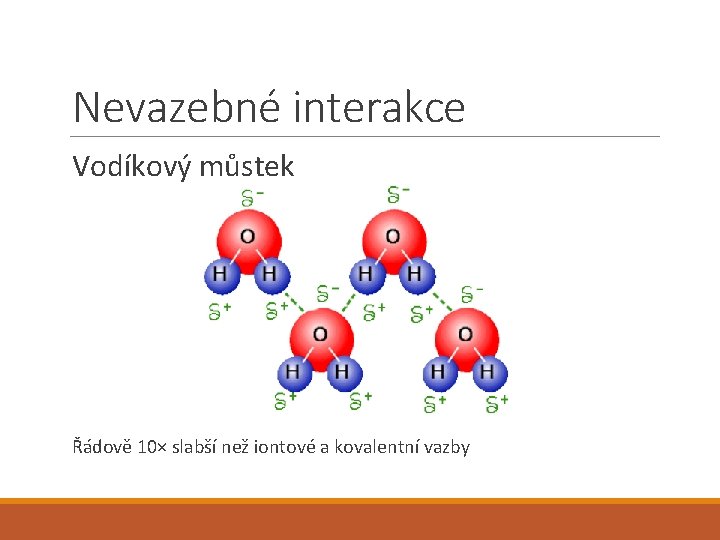
Nevazebné interakce Vodíkový můstek Řádově 10× slabší než iontové a kovalentní vazby

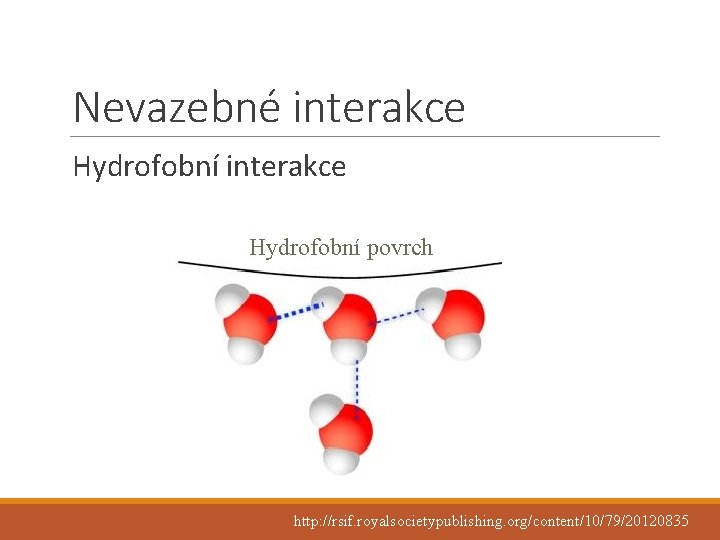
Nevazebné interakce Hydrofobní povrch http: //rsif. royalsocietypublishing. org/content/10/79/20120835

Organické molekuly

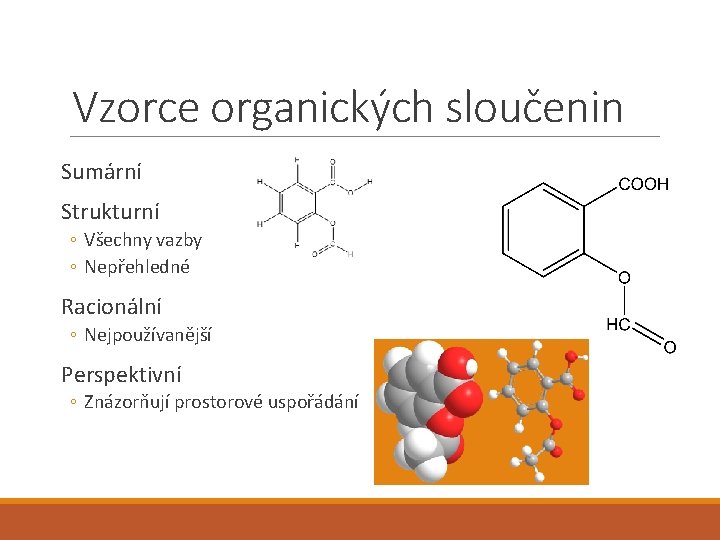
Vzorce organických sloučenin Sumární Strukturní ◦ Všechny vazby ◦ Nepřehledné Racionální ◦ Nejpoužívanější Perspektivní ◦ Znázorňují prostorové uspořádání

Izomerie a konformace Izomery: Stejný sumární vzorec, jiná struktura nebo uspořádání izomerace = štěpení a tvoření vazeb Konformery: Jiné prostorové uspořádání díky rotaci vazeb změna konformace – nesmí se štěpit ani tvořit vazby

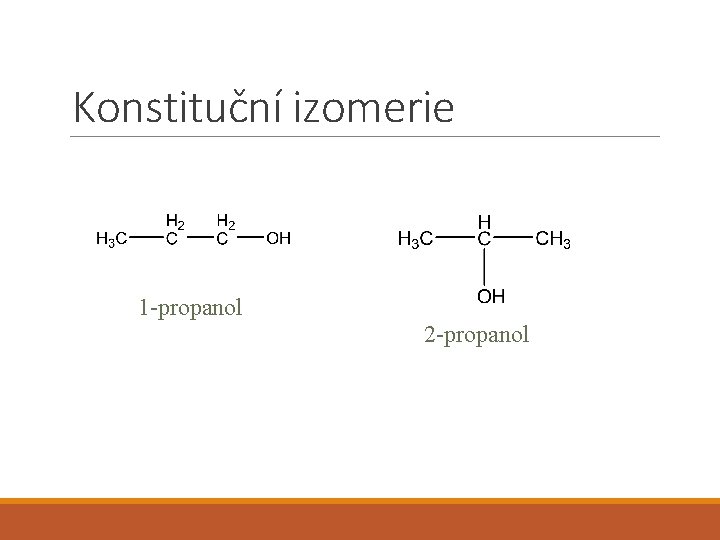
Konstituční izomerie 1 -propanol 2 -propanol

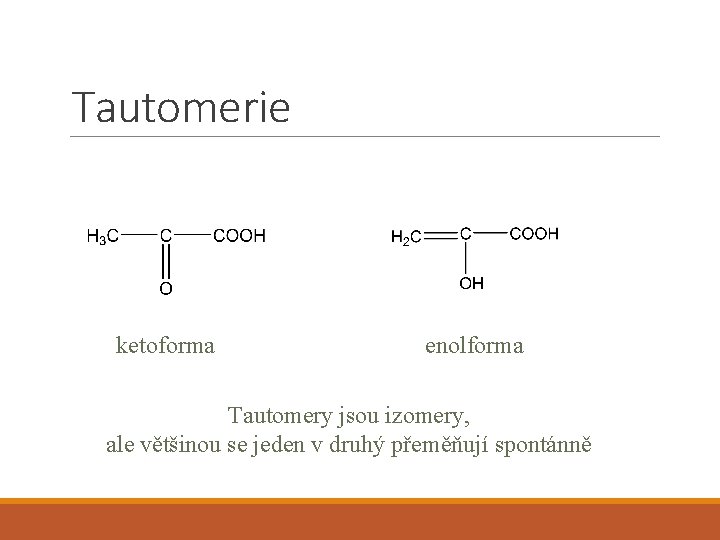
Tautomerie ketoforma enolforma Tautomery jsou izomery, ale většinou se jeden v druhý přeměňují spontánně

Peptidová vazba ketoforma enolforma Má vlastnosti „ 1, 5 násobné“ vazby • Kratší než jednoduchá • Nemůže rotovat

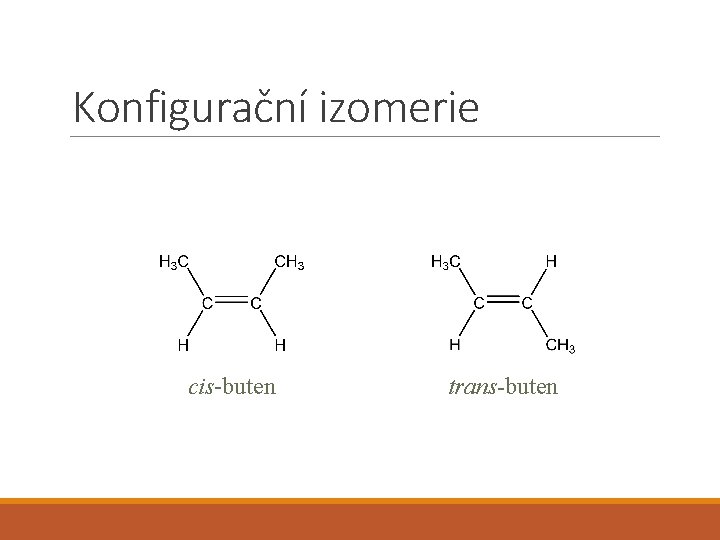
Konfigurační izomerie cis-buten trans-buten

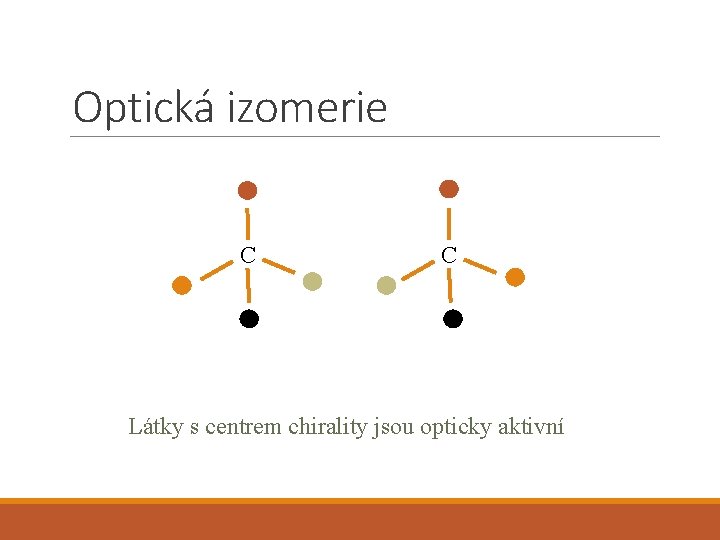
Optická izomerie C C Látky s centrem chirality jsou opticky aktivní

Vybrané deriváty uhlovodíků

Halogenderiváty uhlovodíků Vazba C-Cl, C-Br, C-I je nepolární • Většinou nepolární rozpouštědla, těkavé • Např. tetrachlormetan CCl 4, chloroform CCl 3 H • Narkotický účinek • Freony (např. CCl 3 F)

Hydroxyderiváty Alifatické: alkoholy Aromatické: fenoly Vazba C-OH je silně polární Tvoří vodíkové můstky δ+ C δO H δ+

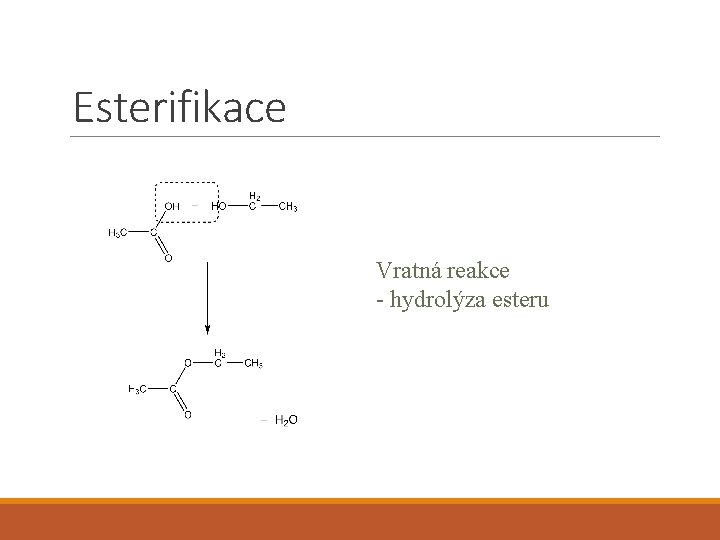
Alkoholy • Esterifikace • Oxidace • Alkoholáty

Esterifikace Vratná reakce - hydrolýza esteru

Oxidace alkoholů Primární Sekundární Terciární

Fenoly • Kyselejší (fenoláty) • Oxidace na (semi)chinony Hydrochinon Fenoxyradikál Benzochinon

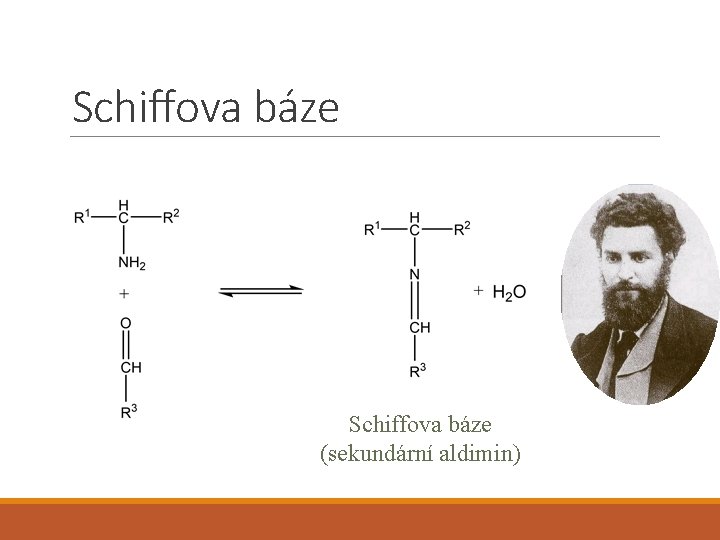
Oxoderiváty • Aldehydy • Ketony • Nemohou tak snadno tvořit vodíkové můstky • Oxidoredukční reakce • Tvorba Schiffových bází

Schiffova báze (sekundární aldimin)

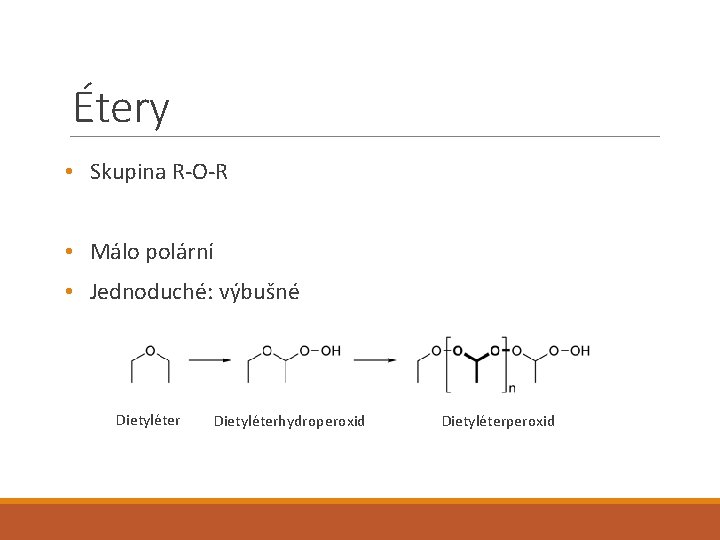
Étery • Skupina R-O-R • Málo polární • Jednoduché: výbušné Dietyléterhydroperoxid Dietyléterperoxid

Karboxylové kyseliny • Slabé kyseliny • Vyšší mastné kyseliny • Vodíkové můstky - dimerizují

Karboxylové kyseliny • Redukce • Dekarboxylace • Anhydridy Kyselina octová Acetanhydrid
 Chemie
Chemie Atoomeconomie
Atoomeconomie Impuls chemie 4
Impuls chemie 4 Ilkovičova rovnice
Ilkovičova rovnice Chemie
Chemie Steigerleren
Steigerleren Oxalsäurediethylester hydrolyse
Oxalsäurediethylester hydrolyse Substrat chemie
Substrat chemie Tenside definition
Tenside definition Impuls chemie
Impuls chemie Sbr6 chemie
Sbr6 chemie Lauterbur
Lauterbur Dichloor
Dichloor Skelettschreibweise
Skelettschreibweise Substrat chemie
Substrat chemie Ppp chemie
Ppp chemie Chemie
Chemie Freie enthalpie gleichgewichtskonstante
Freie enthalpie gleichgewichtskonstante Chemické názvosloví
Chemické názvosloví Donau chemie pischelsdorf
Donau chemie pischelsdorf Autohaus bonnemann
Autohaus bonnemann Organická chemie
Organická chemie Chemie teilgebiete
Chemie teilgebiete Hhu semesterapparat
Hhu semesterapparat Chmia
Chmia Hochofen beschriftung
Hochofen beschriftung Burgerlijk ingenieur chemie
Burgerlijk ingenieur chemie Impuls chemie 4 arbeitsblätter
Impuls chemie 4 arbeitsblätter Scheikunde chemie overal vwo 4
Scheikunde chemie overal vwo 4 Jodometrie
Jodometrie Koncovky chemie
Koncovky chemie Prinzip des kleinsten zwanges
Prinzip des kleinsten zwanges Atoomeconomie
Atoomeconomie Chemie
Chemie Impuls chemie 4 lösungen
Impuls chemie 4 lösungen Boeken over kwantumchemie en theoretische chemie
Boeken over kwantumchemie en theoretische chemie Sucha chemie
Sucha chemie Reaktion 1. ordnung
Reaktion 1. ordnung Bahenní plyn
Bahenní plyn Concept cartoon chemie
Concept cartoon chemie Voda prezentace chemie
Voda prezentace chemie