ndice El hidrgeno Mtodos de produccin Almacenamiento del


















- Slides: 23


Índice El hidrógeno: Ø Métodos de producción Ø Almacenamiento del hidrógeno Celdas de combustible: Funcionamiento Rendimiento Tipos de pilas de combustible: Ø PEM Ø PAFC Ø SOFC Ø MCFC El ciclo del hidrógeno solar Conclusiones

Ø La combustión de combustibles fósiles constituye el principal causante de la emisión de gases de efecto invernadero, responsables del efecto de calentamiento global que sufre nuestro planeta. Ø Esta situación no resulta sostenible a medio plazo, y es necesario preparar una transición controlada hacia una nueva forma de producción y consumo energético que sea limpia, segura y fiable. Ø Una de las alternativas es el uso de hidrógeno como fuente de energía, y su transformación en electricidad por medio de las llamadas pilas de combustible. Ø El hidrógeno no es una fuente primaria de energía, ya que no no se encuentra libre en la naturaleza y no es directamente aprovechable. Es un vector energético, es decir, un portador de energía. Ø Hay que producir el hidrógeno a partir de energías primarias. Hoy en día aproximadamente el 95% del hidrógeno se obtiene a partir de combustibles fósiles. Ø El hidrógeno tiene una densidad energética en masa 3 veces superior a la de la gasolina. Combustible Energía [k. J/g] Energía [k. J/l] Carbón 29. 3 - Madera 8. 1 - Gasolina 43. 5 30590 Diesel 42. 7 29890 Metanol 19. 6 15630 Gas natural 50. 02 31. 7 Hidrógeno 119. 9 10 Contenido energético de diversos carburantes

Ventajas frente a los combustibles fósiles : Alta densidad energética en base másica. Bajo peso de combustible en los tanques de almacenamiento. Alta disponibilidad. Se puede producir a partir de distintas materias primas. Elemento estable y no corrosivo. Combustible "limpio". La combustión del hidrógeno con oxígeno sólo produce agua. Desventajas frente a los combustibles fósiles : Baja densidad energética en base volumétrica. Se requieren tanques contenedores grandes y pesados. Transporte y almacenamiento costosos y de implementación compleja. Combustible secundario: se debe consumir energía para conseguirlo a partir de las distintas materias primas (agua, biomasa, combustibles fósiles), ya que no existe en estado elemental.

A partir de hidrocarburos: • Reformado con vapor: el hidrocarburo es tratado con vapor de agua a temperaturas entre 700 y 1100 ºC. El proceso se realiza en dos fases: 1ª fase: CH 4 + H 2 O CO + 3 H 2 2ª fase: CO + H 2 O CO 2 + H • Oxidación parcial: reacción de combustión entre 1300 y 1500 ºC CH 1, 4 + 0, 3 H 2 O + 0, 4 O 2 0, 9 CO + 0, 1 CO 2 + H 2. A partir del agua: • Electrólisis: proceso mucho más caro que el reformado con vapor. Produce hidrógeno de gran pureza, que se utiliza en la industria electrónica, farmacéutica o alimentaria. Hoy en día aproximadamente el 96% del hidrógeno se obtiene a partir de combustibles fósiles.

• • • Almacenamiento en forma gaseosa: El hidrógeno se almacena a alta presión (P > 20 Mpa). Requiere depósitos pesados y voluminosos. Plantea problemas de seguridad. No resulta competitivo debido a su elevado coste. Almacenamiento en forma líquida: El hidrógeno se almacena en estado líquido en recipientes criogénicos. Requiere alcanzar temperaturas de almacenamiento muy bajas (21, 2 K). El coste es elevado. Indicado sólo para aplicaciones donde el coste del hidrógeno no sea un factor crítico y éste sea consumido en cortos periodos de tiempo (por ejemplo, en aplicaciones aeroespaciales). Combinación química (hidruros metálicos): Diversos metales de transición y sus aleaciones pueden ser utilizados para almacenar hidrógeno en forma de hidruros metálicos. El principal inconveniente es el elevado peso del sistema de almacenamiento, como consecuencia de los bajos niveles de retención de hidrógeno que se consiguen (< 2% a temperaturas inferiores a 423 K). Adsorción en sólidos porosos (nanoestructuras de carbono): Se está estudiando la utilización de nanoestructuras de carbono con elevada superficie específica como medio de almacenamiento. Sería una forma segura y sencilla de almacenar el hidrógeno sin usar altas presiones.

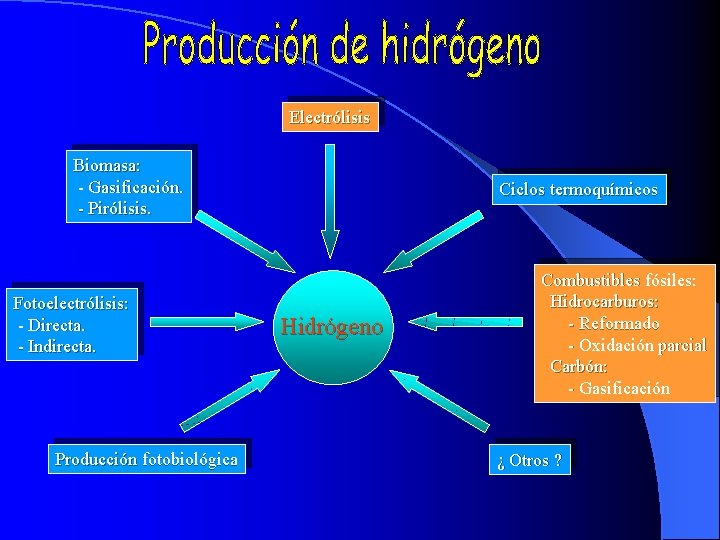
• • A partir de biomasa: Gasificación: Combustión incompleta de la biomasa entre 700 y 1200ºC. Productos: H 2, CH 4, CO. Pirólisis: Combustión incompleta en ausencia de oxígeno, a unos 500 ºC Productos: H 2, CO 2 e hidrocarburos ligeros. • • • Fotoelectrólisis: Indirecta: Paneles fotovoltaicos + radiación solar. Directa: Celdas fotoelectroquímicas (material semiconductor) + radiación solar. • Ciclos termoquímicos: Consisten en una combinación de reacciones químicas a alta temperatura que producen la disociación de la molécula de agua. Se han alcanzado eficiencias del 40%. Para realizar los ciclos termoquímicos se puede emplear energía nuclear o solar. • • Producción fotobiológica: Ciertas bacterias y algas verdes pueden producir hidrógeno, utilizando únicamente luz solar, agua y una enzima llamada hidrogenasa.

Electrólisis Biomasa: - Gasificación. - Pirólisis. Fotoelectrólisis: - Directa. - Indirecta. Producción fotobiológica Ciclos termoquímicos Hidrógeno Combustibles fósiles: Hidrocarburos: - Reformado - Oxidación parcial Carbón: - Gasificación ¿ Otros ?

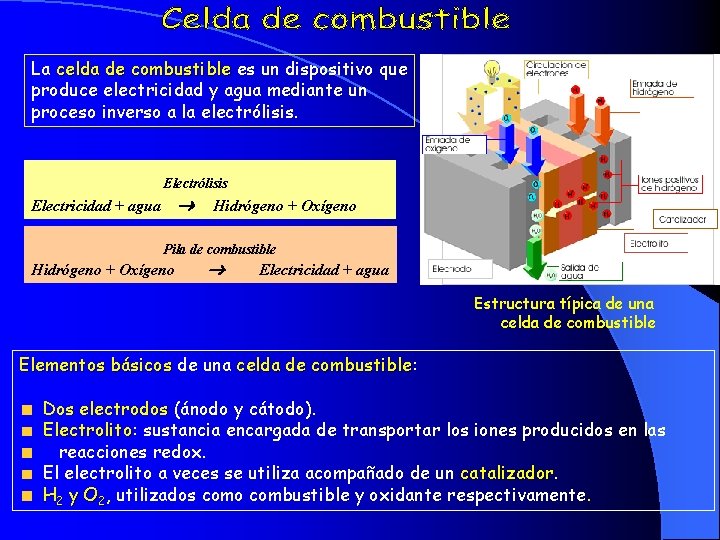
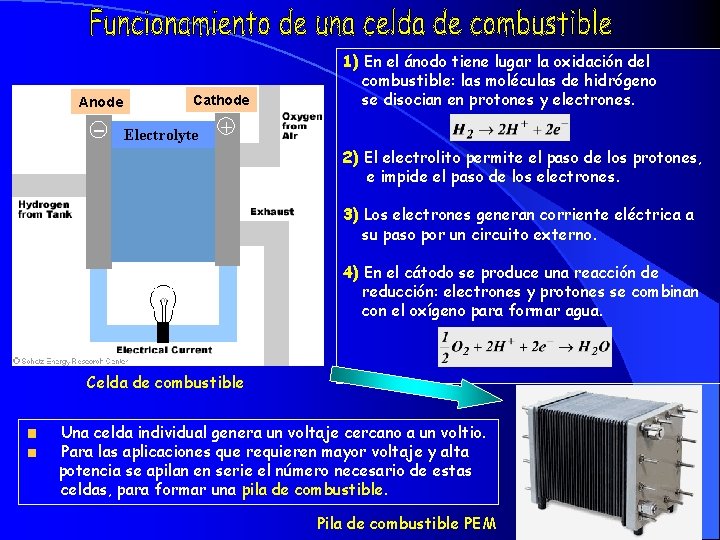
La celda de combustible es un dispositivo que produce electricidad y agua mediante un proceso inverso a la electrólisis. Electrólisis Electricidad + agua Hidrógeno + Oxígeno Pila de combustible Hidrógeno + Oxígeno Electricidad + agua Estructura típica de una celda de combustible Elementos básicos de una celda de combustible: combustible Dos electrodos (ánodo y cátodo). Electrolito: Electrolito sustancia encargada de transportar los iones producidos en las reacciones redox. El electrolito a veces se utiliza acompañado de un catalizador H 2 y O 2, utilizados como combustible y oxidante respectivamente.

Anode -- Cathode Electrolyte 1) En el ánodo tiene lugar la oxidación del combustible: las moléculas de hidrógeno se disocian en protones y electrones. + 2) El electrolito permite el paso de los protones, e impide el paso de los electrones. 3) Los electrones generan corriente eléctrica a su paso por un circuito externo. 4) En el cátodo se produce una reacción de reducción: electrones y protones se combinan con el oxígeno para formar agua. Celda de combustible Una celda individual genera un voltaje cercano a un voltio. Para las aplicaciones que requieren mayor voltaje y alta potencia se apilan en serie el número necesario de estas celdas, para formar una pila de combustible. Pila de combustible PEM

Diferencias entre celdas de combustible y dispositivos de combustión interna. : • Los dispositivos de combustión interna se basan en la conversión de energía térmica en energía mecánica. La eficiencia de este proceso está limitado por el Ciclo de Carnot. • Las celdas de combustible convierten directamente la energía química en energía eléctrica. Desde el punto de vista termodinámico este proceso es mucho más eficiente Diferencias entre celdas de combustible y baterías: Las baterías son dispositivos de almacenamiento de energía. La producción de energía cesa cuando se consumen los reactivos químicos almacenados dentro de la batería. No pueden proporcionar un flujo continuo de energía eléctrica. En las celdas de combustible, tanto el combustible como el oxidante proceden de una fuente externa, y permiten generar corriente eléctrica de manera casi indefinida, en la medida en que pueda suministrarse combustible de forma continuada.

El potencial eléctrico ideal generado por una celda de combustible viene dado por la ecuación de Nernst: E: Potencial eléctrico de la pila (volts. ) Eo: Potencial redox estándar( T=25º C , 1 Molar) R: Cte. de los gases (8. 31 J/Kmol) T: Temperatura absoluta (K) F: Cte. de Faraday (96. 6 k. J/mol) C[ ]: Concentraciones molares de reactivos y productos Ø La ecuación de Nerst permite calcular el potencial ideal de una celda de combustible en función de la temperatura y de las concentraciones de reactantes y productos.

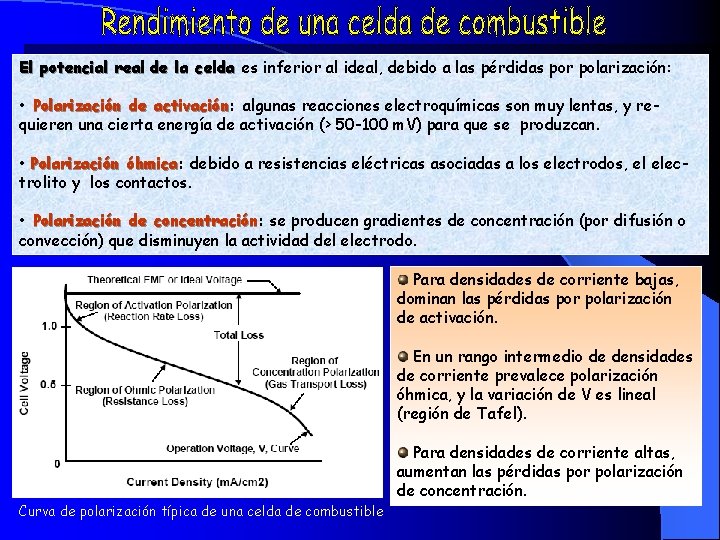
El potencial real de la celda es inferior al ideal, debido a las pérdidas por polarización: • Polarización de activación: activación algunas reacciones electroquímicas son muy lentas, y requieren una cierta energía de activación (> 50 -100 m. V) para que se produzcan. • Polarización óhmica: óhmica debido a resistencias eléctricas asociadas a los electrodos, el electrolito y los contactos. • Polarización de concentración: concentración se producen gradientes de concentración (por difusión o convección) que disminuyen la actividad del electrodo. Para densidades de corriente bajas, dominan las pérdidas por polarización de activación. En un rango intermedio de densidades de corriente prevalece polarización óhmica, y la variación de V es lineal (región de Tafel). Curva de polarización típica de una celda de combustible Para densidades de corriente altas, aumentan las pérdidas por polarización de concentración.


Las pilas PEM usan como electrolito un polímero sólido. Utilizan un catalizador de platino. Ventajas: Rapidez de arranque. Operan a relativamente bajas temperaturas (80ºC). Desventajas: Extremadamente sensible a la contaminación por CO. Aplicaciones: Generación de energía estacionaria. Transporte (coches, autobuses). Características: Temperatura: 80 ºC Eficiencia (%): 32 -45 Potencia: 5 -250 k. W

Las pilas PAFC utilizan ácido fosfórico como electrolito. Requieren un catalizador de platino. Ventajas: Son menos sensibles a la contaminación por CO que las pilas PEM. Desventajas: Gran peso y tamaño. Son caras (3500 -4000 € por kilovatio) Aplicaciones: Generación de energía estacionaria. Transporte (vehículos pesados). Características: Temperatura: 205 ºC Eficiencia (%): 36 -45 Potencia: 50 k. W - 11 MW

Las pilas alcalinas utilizan una solución de hidróxido de potasio en agua como electrolito. Como catalizador se pueden emplear diversos metales no preciosos. Ventajas: Alto rendimiento y eficiencia. Desventajas: Son muy sensibles a la contaminación por CO 2. Menor duración debido a su susceptibilidad a ese tipo de contaminación. Aplicaciones: ambientes donde hay contaminación por CO 2 (espacio, fondo del mar). Características: Temperatura: 65 -220 ºC Eficiencia (%): > 50 Potencia: 5 -150 k. W

Las pilas de óxido sólido emplean como electrolito un componente de cerámica duro y no poroso. No necesitan catalizador. Ventajas: Menor coste (no necesitan catalizador). Alto rendimiento en sistemas de cogeneración (electricidad + calor) Muy resistentes a la corrosión y a la contaminación por CO. Desventajas: Arranque lento. Las altas temperaturas afectan a la duración de los materiales de la pila. Aplicaciones: Sistemas estacionarios. No es adecuada para transportes o sistemas portátiles. Características: Temperatura: 600 -1000 ºC Eficiencia (%): 43 -55 Potencia: 100 -250 k. W

Las pilas de carbonato fundido utilizan un electrolito compuesto de una mezcla de sales de carbonato fundidas dispersas en una matriz cerámica porosa. Como catalizador emplean metales no nobles. Ventajas: Resistentes a la contaminación por CO y CO 2 No necesitan reformador externo: debido a las altas temperaturas los combustibles se convierten en hidrógeno dentro de la propia pila, mediante un proceso de conversión interna. Desventajas: Arranque lento. Corta duración: Las altas temperaturas y el electrolito corrosivo deterioran los componentes de la pila. Aplicaciones: Generación de energía estacionaria. Características: Temperatura: 600 -650 ºC Eficiencia (%): 43 -55 Potencia: 100 k. W - 2 MW


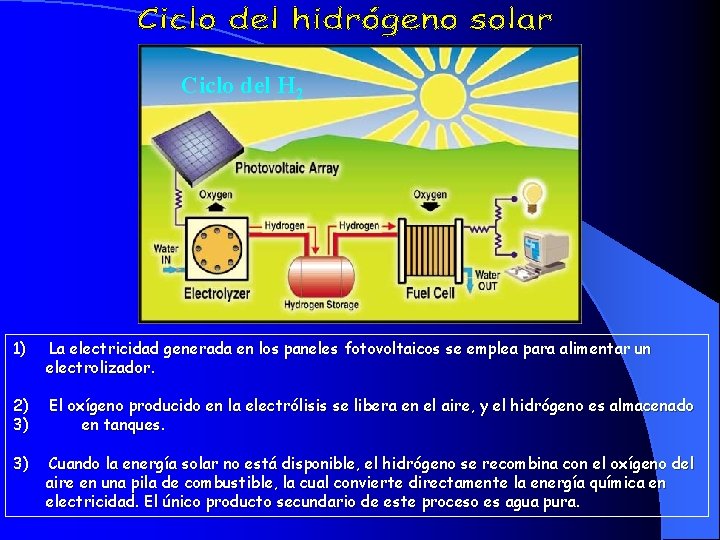
Ciclo del H 2 1) La electricidad generada en los paneles fotovoltaicos se emplea para alimentar un electrolizador. 2) 3) El oxígeno producido en la electrólisis se libera en el aire, y el hidrógeno es almacenado en tanques. 3) Cuando la energía solar no está disponible, el hidrógeno se recombina con el oxígeno del aire en una pila de combustible, la cual convierte directamente la energía química en electricidad. El único producto secundario de este proceso es agua pura.

El hidrógeno es un recurso energético limpio, y constituye una alternativa prometedora al panorama energético actual La utilización de las pilas de combustible de hidrógeno ofrece varias ventajas sobre otros tipos de fuentes de energía, con una alta eficiencia y sin emisión de contaminantes. La pilas de combustible de hidrógeno tiene un amplio rango de aplicación: desde equipos portátiles hasta grandes centrales de producción de energía estacionaria. La producción hidrógeno a partir de energías renovables permitiría desarrollar un sistema de energía sostenible y reducir la dependencia actual respecto de los combustibles fósiles. Existen varios problemas técnicos por resolver: el almacenamiento del hidrógeno, la producción de hidrógeno a partir fuentes distintas de los combustibles fósiles. Se está realizando un gran esfuerzo para implantar esta tecnología en el sector de transportes y automoción.

Libros: ØJ. Larminie, A. Dicks. “Fuel Cell Systems Explained”, Second Edition (2003). SAE Bookstore. Ø A. J. Appleby and F. R. Foulkes. “Fuel Cell Handbook”, Van Norstand Reinhold, New York. Documentos y páginas web: Asociación Española de Pilas de Combustible- APPICE Tecnociencia: Especial Pilas de Combustible de Hidrógeno Red de Pilas de Combustible del CSIC
 Hidrgeno
Hidrgeno Hidrgeno
Hidrgeno Produccin de video
Produccin de video Produccin
Produccin Produccin
Produccin Ndice
Ndice Ndice
Ndice Ndice
Ndice Formula indice de precios
Formula indice de precios Higroscopicidad
Higroscopicidad Ndice
Ndice Ndice
Ndice Surgislip
Surgislip Atmico
Atmico Ndice
Ndice Almacenamiento secundario caracteristicas
Almacenamiento secundario caracteristicas Evolucion del almacenamiento informatico
Evolucion del almacenamiento informatico Mtodos
Mtodos Mtodos
Mtodos Mtodos
Mtodos Mtodos
Mtodos Mtodos
Mtodos Funda de plastico latex que evita el paso de espermatozoide
Funda de plastico latex que evita el paso de espermatozoide Mtodos
Mtodos