MANAGEMENT DELLINFEZIONE DA CITOMEGALOVIRUS NEI PAZIENTI TRAPIANTATI Dott




















- Slides: 22

MANAGEMENT DELL’INFEZIONE DA CITOMEGALOVIRUS NEI PAZIENTI TRAPIANTATI Dott. Giuseppe Indellicati Scuola di specializzazione in Malattie dell’Apparato Digerente – Università degli Studi di Bari Tutor: Dott. ssa Maria Rendina

S. V. • Familiarità per k polmone (padre) e glioblastoma multiforme (madre) • APR muta • 22/7 CMV-Ig. G pos, Ig. M neg • OLT il 24/07/2020 per Epatite fulminante di ndd. Nessuna complicanza chirurgica. Trasferimento in rianimazione. • 31/7 CMV-DNA PCR 667 UI/ml - 725 copie/ml • 3/8 CMV-DNA PCR 1273 UI/ml - 1384 copie/ml • Avvia f. u. c/o UO Chirurgia epatobiliare: § Sin dal 12/8 incremento GGT x 11 e lieve delle AST x 1. 1 § 5/9 CMV-DNA PCR n. r. , CMV-Ig. G pos, Ig. M pos § riscontro di ipertransaminasemia in data 08/10 (AST x 9. 2, ALT x 10. 6, GGT x 25, Bil tot 2. 3) e peggioramento della funzione renale (creat 1. 74, e. GFR 33), Tacrolemia 6 § esegue 3 boli di corticosteroidi da 1 g nei giorni 8 -9 -10/10 § in data 15/10 esegue biopsia epatica (EI: rigetto epatico lieve, RAI score 3) § 27/10 rimozione del Kehr (esame liquido positivo per A. baumannii) ed ecografia nella norma. Nuovi EE nello stesso giorno mostrano miglioramento dell’ipertransaminasemia (AST x 1. 9, ALT x 2. 3, GGT x 14, bil tot 0. 9) e della funzione renale (creat 1. 13, e. GFR 55) • Avvio follow up c/o la scrivente UO: § 11/11 EE di controllo (AST x 2. 3, ALT x 2. 9, GGT x 17. 7, ALP x 3. 86, bil tot 0. 79), in terapia con Adoport 2 mgx 2/die e Deltacortene 5 mg 2 cpx 2/die. Switch a Envarsus 3. 75; § 19/11 nuovo controllo, AST x 2. 08, ALT x 2. 6, GGTx 16. 5, ALP x 3. 12, bil nella norma. Eseguiva HCV-RNA, HBV-DNA negativi. Eseguiva CMV-DNA PCR 696 UI/ml - 756 copie/ml § 26/11 CMV-DNA PCR 867 UI/ml – 942 copie/ml

COME INTERPRETARE QUESTI DATI? COME GESTIRE UN PAZIENTE TRAPIANTATO CON POTENZIALE INFEZIONE DA CMV?


DEFINIZION I Entrambe primitive o riattivate

PUNTI CHIAVE NELLA 1) Sierologia CMV-Ig. G nel donatore e nel ricevente (assessment pre-trapianto) GESTIONE • CMV-Ig. M non raccomandate • Ripetere la sierologia al momento del trapianto se precedentemente negativa • In caso di risultati dubbi nel ricevente, interpretare come positivo; nel donatore interpretare in modo da assegnare il rischio maggiore Rischio decrescente di sviluppo di CMV disease o rigetto Altri fattori di rischio aggiuntivi da tenere in considerazione: • Infezione primitiva • In trattamento per rigetto • Presenza di altri fattori di rischio infettivo addizionali, es deplezione di T-cells

2) CMV-DNAemia (assessment post-trapianto) • Possibilmente su sangue intero (preferibile al plasma), ma non necessariamente, purché si utilizzi sempre lo stesso tipo di campione nel monitoraggio • Possibilmente espresso in UI/ml (in linea con le direttive OMS); spesso i valori non sono confrontabili tra laboratori diversi, a meno di essere sicuri che le metodiche e i reagenti siano gli stessi • Preferibile alla antigenemia • La sierologia non ha valore nella diagnosi di replicazione attiva o nel follow-up post-trapianto. • Alterazioni quantitative della CMV-DNAemia sono considerate clinicamente significative solo se eccedono 0. 5 log 10 UI/ml (cioè almeno di 3 volte) • Non raccomandato il dosaggio durante la profilassi routinaria • Settimanalmente se si monitora la risposta al trattamento • Se in uso metodiche ad alta sensibilità (PCR), si può interrompere la terapia dopo 1 risultato < al limite di sensibilità (circa 200 UI/ml); se invece il test non è ad alta sensibilità, interrompere la terapia dopo 2 risultati negativi consecutivi. • Raccomandate l’istologia e l’immunoistochimica per la diagnosi della malattia invasiva tissutale (tissue invasive disease). • Non definite soglie per l’inizio della terapia nella strategia preemptive

3) Status immunologico • Fattori genetici dell’ospite e parametri immunologici (es. bassa conta linfocitaria, ipocomplementemia, bassi livelli di NK cells, così come iporeattività dei T linfociti) hanno mostrato associazione con maggiore incidenza di infezione da CMV. • L’assessment immunologico cellulare CMV-specifico, valutato mediante IGRAs (Interferon Gamma Release Assay), ha dimostrato di poter predire l’infezione da CMV nel setting pre- e post-trapianto in studi osservazionali. Sono ancora in corso studi di tipo trial clinico per stabilirne l’effettiva utilità nella pratica clinica.

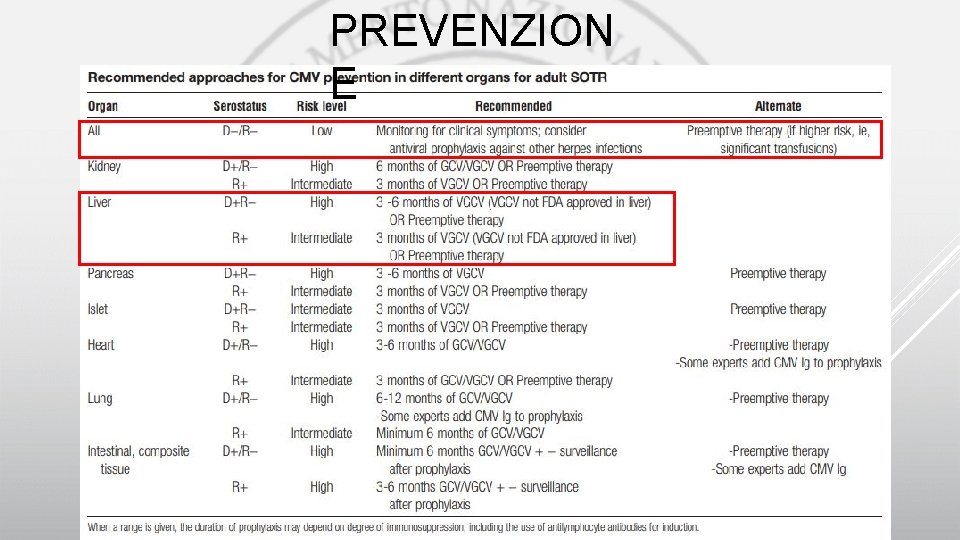
PREVENZION E


• PREEMPTIV E preemptive è raccomandato Nell’approccio il monitoraggio della CMV-DNAemia settimanale per 3 -4 mesi dopo il trapianto ( «cinetica virale» ); monitoraggio più lungo se si ritiene che il pz sia a più elevato rischio • Ogni centro dovrebbe individuare i propri valori soglia al di sopra dei quali iniziare il trattamento • Quando la viremia è al valore soglia, si raccomanda di iniziare la terapia antivirale a dosaggio terapeutico e continuare sino a negativizzazione della viremia con un minimo di due settimane di trattamento • Dopo la risoluzione, continuare la sorveglianza settimanale interrompendo la terapia. UNIV. PROPHYLAXIS • Preferire la profilassi in donatori e/o riceventi sieropositivi il cui rischio di infezione da CMV può essere aumentato, ad es. quelli sottoposti a recente tp antilinfociti o quelli sottoposti a regimi immunosoppressori più potenti come nei protocolli di incompatibilità AB 0 (Rituximab, Bortezomib, Eculizumab, Plasmaferesi/Immunoadsorbimento) e quelli con HIV; può essere utile una durata più lunga della profilassi (6 mesi) • Non è raccomandabile il monitoraggio routinario della CMV-DNAemia nei pazienti sottoposti a profilassi con dosi standard adattate alla funzione renale • Il monitoraggio della CMV-DNAemia potrebbe essere utile nei pazienti ad elevato rischio di infezione tardiva (D+/R−, durata profilassi breve, livelli elevati di immunosoppressione e rigetto)

N. B. in uno studio una CMV-DNAemia in sangue intero di più di 2000 UI/ml era un fattore fortemente predittivo di perdita del graft.

UNIV. PROPHYLAXIS: raccomandazioni D+/RDurata del trattamento: da 3 a 6 mesi (per OLT, maggiore se induzione con anti-linfociti) R+ D-/R- Durata del trattamento: 3 mesi per trapianti di routine; da 3 a 6 mesi in caso di regimi immunosoppressori particolari (anti-linfociti) • Considerare la profilassi per altre infezioni erpetiche • Soprattutto in questo gruppo, preferire trasfusioni di sangue leucoridotto o di donatori sieronegativi

SITUAZIONI PARTICOLARI • Non è raccomandato l’uso routinario di profilassi secondaria in pazienti già trattati per infezione o malattia, tranne che in particolari contesti (immunosoppressione importante, trattamento di rigetto acuto, sia con corticosteroidi che con anti-linfociti, rischio aumentato di complicanze da infezione da CMV ricorrente o difficoltà nell’applicare uno stretto monitoraggio); in queste circostanze può essere applicato sia il protocollo di profilassi che l’approccio pre-emptive. • I pazienti che ricevono inibitori di m. TOR come immunosoppressori hanno un rischio significativamente inferiore di contrarre l’infezione o la malattia da CMV, per cui è suggerito il loro uso nei R+



TRATTAMENTO DELLA MALATTIA DA CMV

• VGCV nei casi di malattia lieve-moderata in pazienti in grado di assumere terapia per os; • GCV endovena nei casi di malattia grave • Nei pazienti senza rigetto concomitante, è raccomandata la riduzione dell’immunosoppressione nei seguenti casi: § Malattia severa § Risposta inadeguata § Citopenie § Elevata carica virale • Raccomandata la valutazione plasmatica settimanale della CMV-DNAemia, per valutare la risposta al trattamento • Raccomandato il monitoraggio frequente della funzione renale per l’eventuale aggiustamento del dosaggio, la cui riduzione è giustificata solo in questo caso, poiché dosaggi subottimali possono essere associati allo sviluppo di resistenze • In caso di leucopenia durante il trattamento con GCV, interrompere altri farmaci potenzialmente mielotossici o tentare con fattori stimolanti le colone di granulociti prima di cambiare antivirale. • A causa delle variazioni interindividuali nella risposta virologica, se vi è risposta clinica seppure in assenza di miglioramento della CMV-DNAemia, non è indicato cambiare antivirale • Durata della terapia: minimo 2 settimane, sino a risoluzione clinica della malattia e ad azzeramento della CMV-DNAemia (<200 UI/ml) in 1 o 2 campioni settimanali




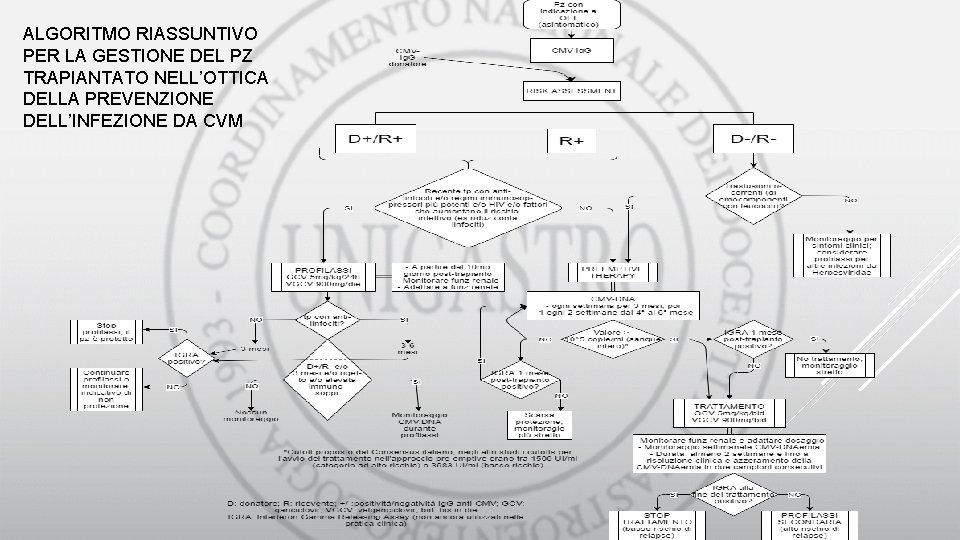
ALGORITMO RIASSUNTIVO PER LA GESTIONE DEL PZ TRAPIANTATO NELL’OTTICA DELLA PREVENZIONE DELL’INFEZIONE DA CVM
 Medžio galva sidabro plaukai
Medžio galva sidabro plaukai Nei šertas nei girdytas o diena dienon tunka
Nei šertas nei girdytas o diena dienon tunka Associazione pazienti italiani colangiocarcinoma
Associazione pazienti italiani colangiocarcinoma Prima e seconda legge di ohm
Prima e seconda legge di ohm Andai nei boschi walt whitman testo
Andai nei boschi walt whitman testo Nelson nei granato neto
Nelson nei granato neto Padre nostro che sei nei cieli sia santificato il tuo nome
Padre nostro che sei nei cieli sia santificato il tuo nome Scuola media giovanni verga barrafranca
Scuola media giovanni verga barrafranca Padre nostro
Padre nostro Comunicazione nei gruppi di lavoro
Comunicazione nei gruppi di lavoro Lo straniamento in rosso malpelo
Lo straniamento in rosso malpelo Nei 97-04
Nei 97-04 Distrattori nei test
Distrattori nei test Come si propaga il calore
Come si propaga il calore Mappa concettuale sul contratto di compravendita
Mappa concettuale sul contratto di compravendita Fiabe con metamorfosi dei personaggi
Fiabe con metamorfosi dei personaggi Impianto frenante oleopneumatico
Impianto frenante oleopneumatico Tipi di sequenze
Tipi di sequenze Pressione nei fluidi
Pressione nei fluidi Elettra sepolcri
Elettra sepolcri Dipolo marconiano
Dipolo marconiano Nei botter montenegro
Nei botter montenegro Poligoni inscritti e circoscritti
Poligoni inscritti e circoscritti











































