Luku 4 Orgaanisten yhdisteiden reaktioita Hapettuminen ja pelkistyminen










- Slides: 16

Luku 4, Orgaanisten yhdisteiden reaktioita • • • Hapettuminen ja pelkistyminen Substituurio- eli korvautumisreaktiot Additio- eli liittymisreaktiot Eliminaatioreaktiot Kondensaatio- ja hydrolyysireaktiot

4. 1 Hapettuminen ja pelkistyminen • Orgaanisen yhdisteen hapettumisessa molekyyliin tulee lisää happea tai/ja vetyä lähtee pois • Pelkistymisessä vetyä lisää tai/ja happea pois • Hapettuminen voi tapahtua esim. ilmassa olevan hapen vaikutuksesta tai hapettavien aineiden (KMn. O 4 , K 2 Cr 2 O 7) avulla • Pelkistyksessä käytetään esim. metallihydridejä (Li. Al. H 4)

Hapettuminen • Primäärinen alkoholi aldehydi karboksyylihappo • Sekundäärinen alkoholi ketoni • Tertiäärinen alkoholi ei hapetu


Pelkistyminen • Karboksyylihappo aldehydi prim. alkoholi • Ketoni sekundäärinen alkoholi

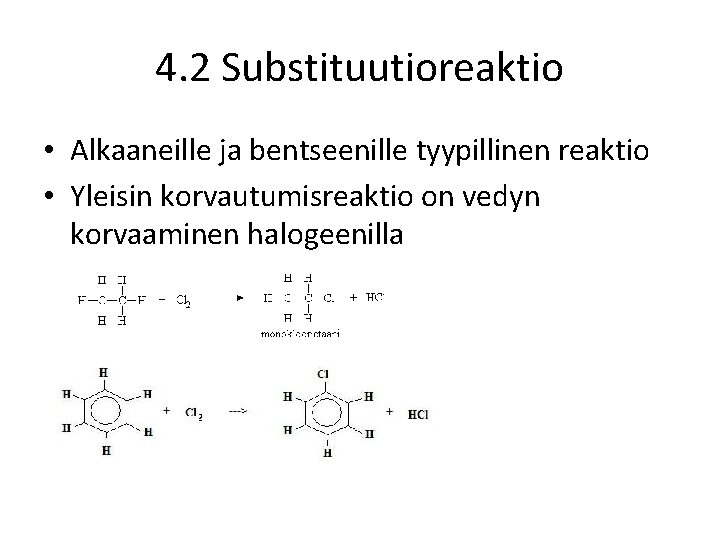
4. 2 Substituutioreaktio • Alkaaneille ja bentseenille tyypillinen reaktio • Yleisin korvautumisreaktio on vedyn korvaaminen halogeenilla

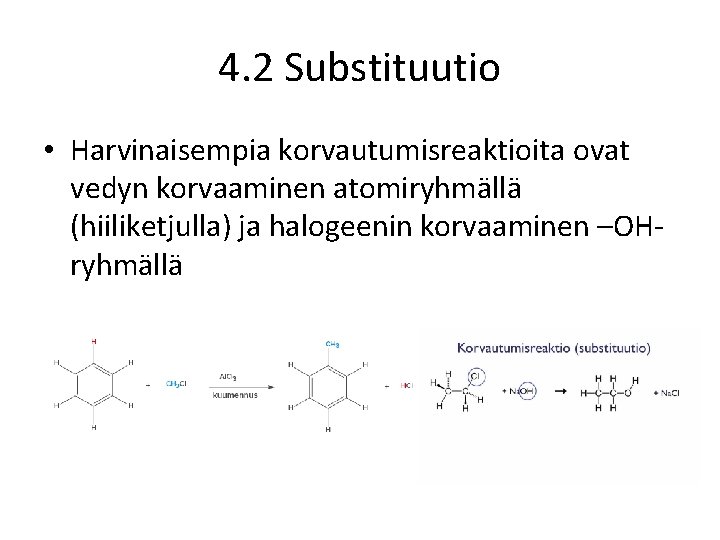
4. 2 Substituutio • Harvinaisempia korvautumisreaktioita ovat vedyn korvaaminen atomiryhmällä (hiiliketjulla) ja halogeenin korvaaminen –OHryhmällä

4. 3 Additio- ja eliminaatioreaktiot • Additioreaktio on alkeeneille ja alkyyneille tyypillinen reaktio, jossa kaksois- tai kolmoissidoksen molemmille puolille liittyy jotain. • Eliminaatio on vastakkainen reaktio, jossa molekyylistä lohkeaa jotain pois ja syntyy alkeeneja. • Additio tapahtuu helpommin kuin substituutio, koska pii-sidos katkeaa helpommin kuin sigmasidos.

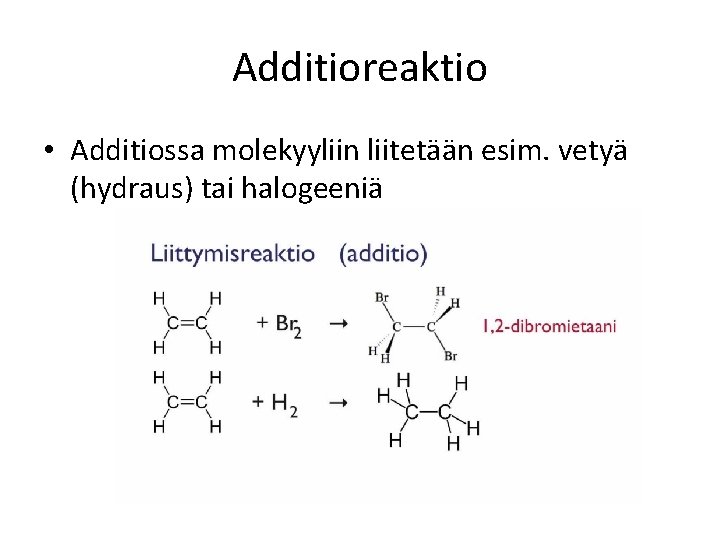
Additioreaktio • Additiossa molekyyliin liitetään esim. vetyä (hydraus) tai halogeeniä

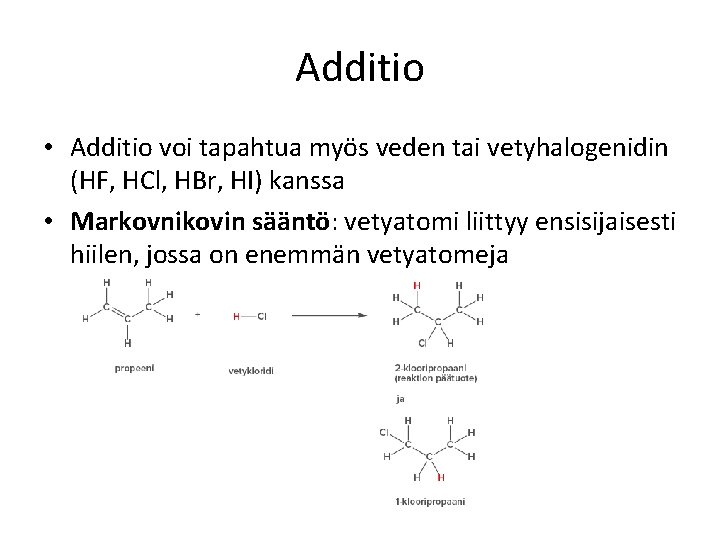
Additio • Additio voi tapahtua myös veden tai vetyhalogenidin (HF, HCl, HBr, HI) kanssa • Markovnikovin sääntö: vetyatomi liittyy ensisijaisesti hiilen, jossa on enemmän vetyatomeja

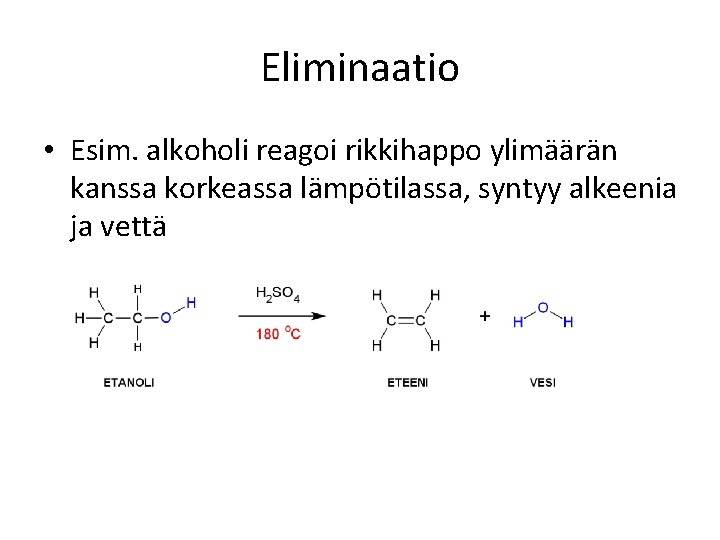
Eliminaatio • Esim. alkoholi reagoi rikkihappo ylimäärän kanssa korkeassa lämpötilassa, syntyy alkeenia ja vettä

4. 4 Kondensaatio- ja hydrolyysireaktiot • Kondensaatioreaktiossa kaksi molekyyliä liittyy yhteen ja välistä lohkeaa pois vettä (tai jokin muu pieni molekyyli) • Kondensaatioreaktioita ovat esteröityminen, eetterin muodostuminen, peptidisidoksen ja glykosidisidoksen muodostumiset ja amidin muodostuminen • Hydrolyysireaktio on kondensaation käänteisreaktio

Kondensaatio • Happo + alkoholi esteri + vesi • Eetteriä muodostuu kun kaksi alkoholimolekyyliä reagoi rikkihapon avulla (alkoholia ylimäärin ja matalampi LT kuin eliminatiossa)

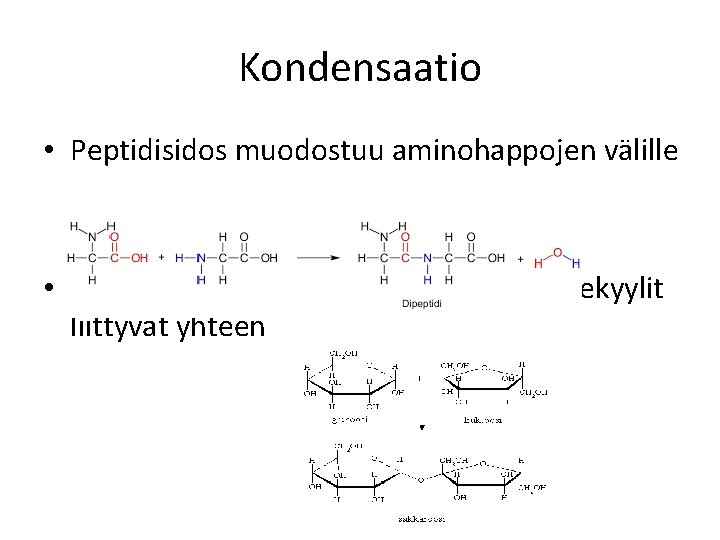
Kondensaatio • Peptidisidos muodostuu aminohappojen välille • Glykosidisidos syntyy, kun sakkaridimolekyylit liittyvät yhteen

Hydrolyysi • Hydrolyysireaktiossa kondensaatiossa muodostunut molekyyli palautuu lähtöaineiksi • Jos hydrolyysi tehdään emäksen avulla, kyseessä on emäshydrolyysi, jossa syntynyt happo reagoi emäksen kanssa suolaksi

Hydrolyysi • Myös saippuan valmistus (rasva + Na. OH) on esimerkki emäshydrolyysistä
























