LTALNOS KMIA mszaki menedzser mechatronika s gpsz szakos
























- Slides: 38

ÁLTALÁNOS KÉMIA műszaki menedzser, mechatronika és gépész szakos hallgatók számára Tananyag Horváth Attila, Sebestyén Attila, Zábó Magdolna Általános és szervetlen kémia jegyzet Feladatok Maleczkiné Szeness Márta Kémiai feladatok – kémiai gondolatok Villányi Attila Ötösöm lesz kémiából www. vegic. uni pannon. hu/education/supplementary/htm lendvay@chemres. hu otto@vegic. uni pannon. hu

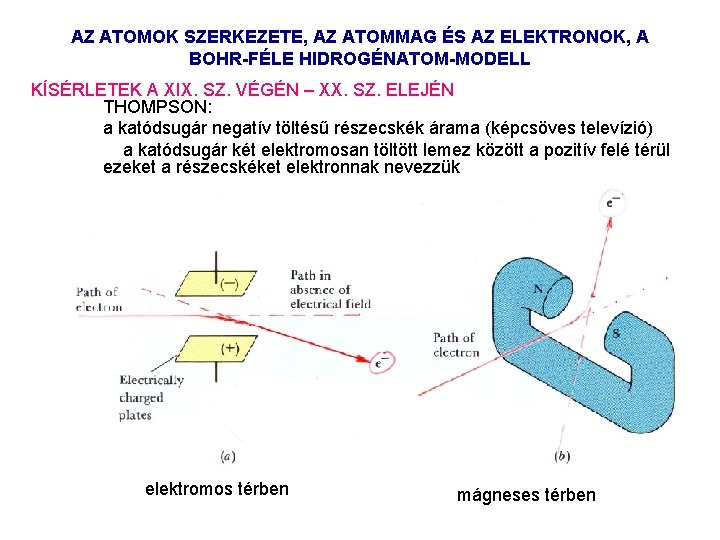
AZ ATOMOK SZERKEZETE, AZ ATOMMAG ÉS AZ ELEKTRONOK, A BOHR-FÉLE HIDROGÉNATOM-MODELL KÍSÉRLETEK A XIX. SZ. VÉGÉN – XX. SZ. ELEJÉN THOMPSON: a katódsugár negatív töltésű részecskék árama (képcsöves televízió) a katódsugár két elektromosan töltött lemez között a pozitív felé térül ezeket a részecskéket elektronnak nevezzük elektromos térben mágneses térben

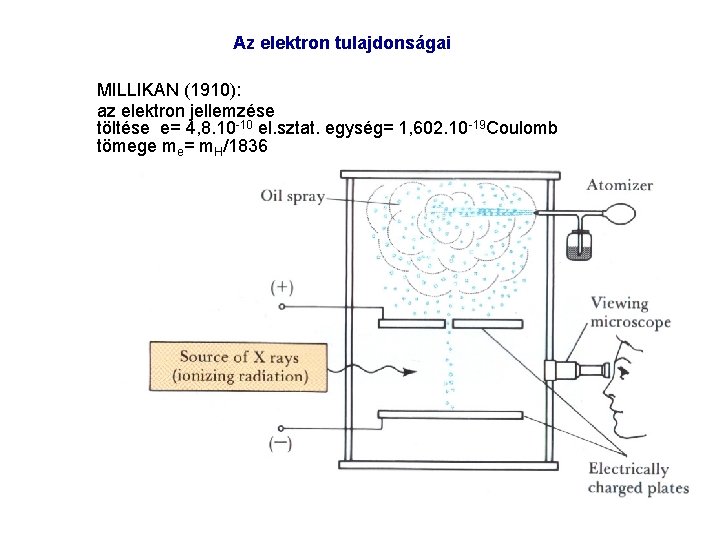
Az elektron tulajdonságai MILLIKAN (1910): az elektron jellemzése töltése e= 4, 8. 10 10 el. sztat. egység= 1, 602. 10 19 Coulomb tömege me= m. H/1836

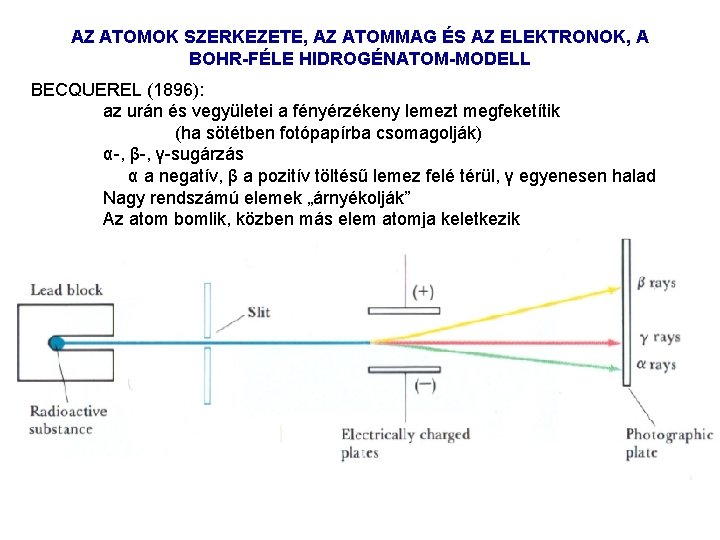
AZ ATOMOK SZERKEZETE, AZ ATOMMAG ÉS AZ ELEKTRONOK, A BOHR-FÉLE HIDROGÉNATOM-MODELL BECQUEREL (1896): az urán és vegyületei a fényérzékeny lemezt megfeketítik (ha sötétben fotópapírba csomagolják) α , β , γ sugárzás α a negatív, β a pozitív töltésű lemez felé térül, γ egyenesen halad Nagy rendszámú elemek „árnyékolják” Az atom bomlik, közben más elem atomja keletkezik

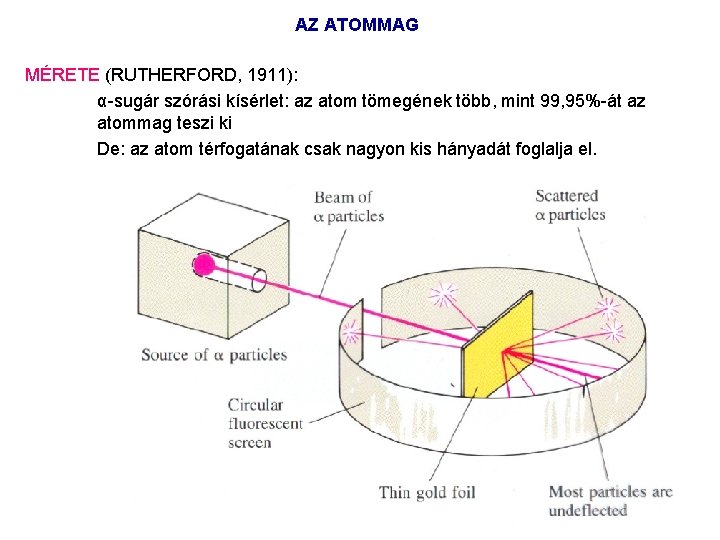
AZ ATOMMAG MÉRETE (RUTHERFORD, 1911): α sugár szórási kísérlet: az atom tömegének több, mint 99, 95% át az atommag teszi ki De: az atom térfogatának csak nagyon kis hányadát foglalja el.

AZ ATOMMAG MÉRETE (RUTHERFORD, 1911): α sugár szórási kísérlet: az atom tömegének több, mint 99, 95% át az atommag teszi ki De: az atom térfogatának csak nagyon kis hányadát foglalja el. ALKOTÓI Pozitív töltésű protonok és semleges töltésű neutronok. A proton tömege 1, 67. 10 24 gramm (atomtömeg egységben kb. 1) A neutron tömege közel azonos a protonéval: 1, 675. 10 24 gramm Az elektron tömege a protonéhoz képest elhanyagolható (1/1836). JELLEMZŐI Rendszám: a protonok száma (Z) Meghatározza, milyen kémiai elem atomjáról van szó. Tömegszám (A): a protonok száma (Z) + a neutronok (N) száma IZOTÓPok: azonos rendszámú, eltérő neutronszámú atomok IZOTONok: azonos neutronszámú atomok IZOBÁRok: azonos tömegszám (eltérő proton és neutronszám)

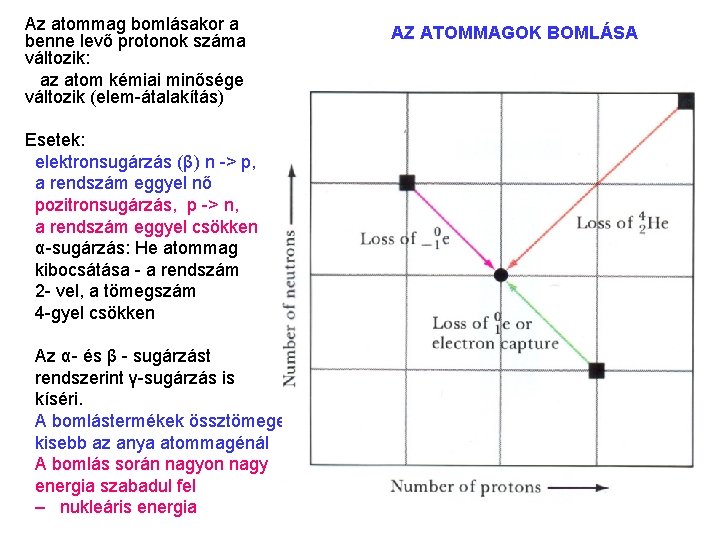
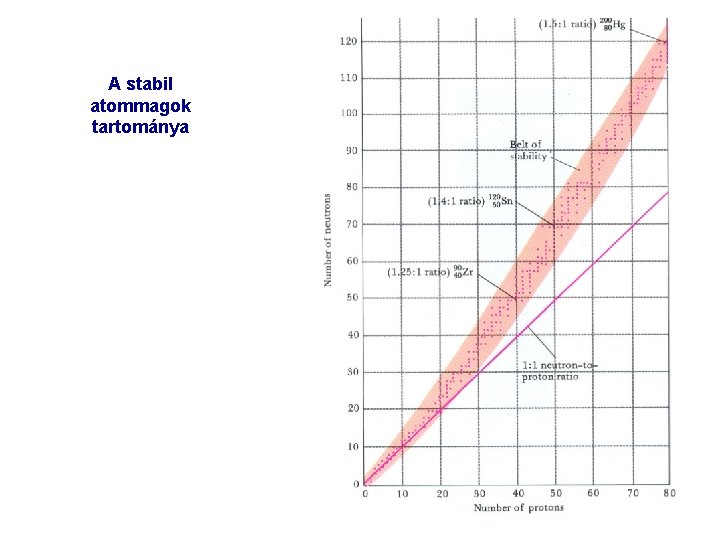
AZ ATOMMAGOK BOMLÁSA Az atommag bomlásakor a benne levő protonok száma változik: az atom kémiai minősége változik (elem átalakítás) Esetek: elektronsugárzás (β) (n > p, a rendszám eggyel nő) pozitronsugárzás (β+) (n > p, a rendszám eggyel csökken) α sugárzás: He atommag kibocsátása (a rendszám 2 vel, a tömegszám 4 gyel csökken) Az α és β sugárzást rendszerint γ sugárzás is kíséri. A bomlás során nagyon nagy energia szabadul fel. AZ ATOMMAGOK STABILITÁSA a természetben előforduló atomok atommagjai általában sokkal stabilisabbak, mint az elektronhéjaik, közönséges kémiai reakciók energetikai viszonyai alatt az atommagok átalakulása nem következik be. A mesterségesen előállított atommagok kivétel nélkül instabilak, radioaktívak. Mattauch szabály (tapasztalati) páros rendszámú elemeknek több stabilis izotópja van, mint a páratlan rendszámúaknak. (A legstabilisabb atommagokban a protonok és neutronok száma egyaránt páros). A legkisebb stabilitásúak a páratlan számú protont és páratlan számú neutront tartalmazó atommagok.

Az atommag bomlásakor a benne levő protonok száma változik: az atom kémiai minősége változik (elem átalakítás) Esetek: elektronsugárzás (β) n > p, a rendszám eggyel nő pozitronsugárzás, p > n, a rendszám eggyel csökken α sugárzás: He atommag kibocsátása a rendszám 2 vel, a tömegszám 4 gyel csökken Az α és β sugárzást rendszerint γ sugárzás is kíséri. A bomlástermékek össztömege kisebb az anya atommagénál A bomlás során nagyon nagy energia szabadul fel – nukleáris energia AZ ATOMMAGOK BOMLÁSA

A stabil atommagok tartománya

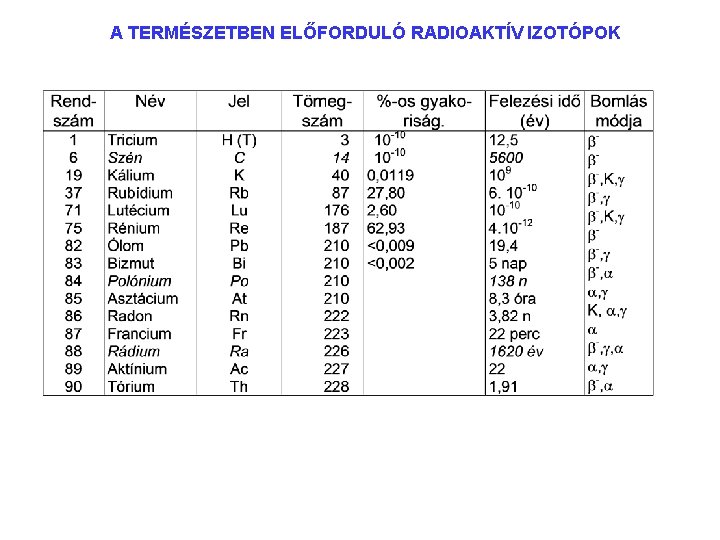
A TERMÉSZETBEN ELŐFORDULÓ RADIOAKTÍV IZOTÓPOK

ATOMMODELLEK Megpróbáljuk fizikai eszközökkel leírni, milyen az atom THOMPSON FÉLE MODELL: a negatív töltésű elektronok egy folytonos pozitív töltésű közegben helyezkednek el (mazsolás puding) a kísérletekkel ellentmondásban van RUTHERFORD FÉLE ELEKTROSZTATIKUS MODELL: Az atommag kicsi pozitív részecske, körülötte kering a negatív töltésű elektron (vagy több elektron) mint a Naprendszer Ellentmondás: az elektronnak, ha körpályán mozog, elektromágneses sugárzást kellene kibocsátania. Ekkor azonban energiát veszítene, és a lelassulna, és lassan a magba zuhanna. Valóság: az atomok nem bocsátanak ki elektromágneses sugárzást csak (ha előzőleg külön gerjesztjük) az elektron nem zuhan az atommagba KÖVETKEZTETÉS: a megszokott klasszikus fizika nem képes az atom szerkezetének leírására

TOVÁBBI KÍSÉRLETI TAPASZTALATOK 1. A fény elektromágneses sugárzás, hullámhossza, frekvenciája és sebessége közt a kapcsolat: =c/ 2. PLANCK (1900) kvantumelmélete: anyagok hevítésekor kisugárzott energia kvantumokban (foton) távozik, ezek nagysága arányos a frekvenciával E = n h h a Planck féle hatáskvantum, h = 6, 63. 10 34 J. s 3. EINSTEIN féle energia tömeg ekvivalencia elv, foton elmélet (1905): a rezgésszámú eletromágneses sugárzáshoz (fény) tömeg rendelhető: E = h = m c 2 A foton tulajdonságai: h = mc 2 / osztva c vel h /c = mc / mivel 1/ = /c mc = h/ impulzusa van mint egy valódi, m tömeggel bíró, c sebességgel haladó részecskének A fény kettős természetű: hullámtulajdonságai és részecske tulajdonságai is vannak 4. A hidrogénatom spektruma vonalas: fényelésének mértéke a hullámszám függvényében nem folytonosan változik, hanem egyes hullámhosszaknál nagy, máshol nulla a vonalak szabályosan helyezkednek el, és sorozatokat alkotnak, melyek két egész szám négyzete reciprokának különbségével jellemezhetők.

A BOHR-FÉLE ATOMMODELL Ezeket a klasszikus mechanikán alapuló Rutherford modell nem tudja leírni. BOHR JAVASLATA: Tegyük fel, hogy a klasszikus mechanika az atomi méretekben csak bizonyos megkötésekkel érvényesek, feltételezett (posztulált) ilyeneket, amiknek jóságát úgy lehet ellenőrizni, hogy egyeznek e a kísérlettel a belőlük származtatott következtetések A BOHR FÉLE POSZTULÁTUMOK 1. A STACIONÁRIUS PÁLYÁK KVANTUMELVE: az elektron csak meghatározott diszkrét pályákon mozoghat a mag körül. Ezeken sugárzás (energiaveszteség) nélkül kering. Az ilyen pályán az impulzusmomentuma a Planck állandó egésszámú többszöröse (kvantált). Minden stacionárius pályához egy rá jellemző energia tartozik. Az elektron energiája egyik pályáról a másikra csak ugrásszerűen léphet át, ekkor az atom fényt nyel el (abszorpció) vagy bocsát ki (emisszió). 2. FREKVENCIA ELV: az atom energiaváltozása az elnyelt vagy kibocsátott fénynek megfelelő foton energiájával van kapcsolatban: E = E 1 E 2 = h ha E 1 > E 2 emisszió E 1 < E 2 abszorpció E posztulátumok ellentmondanak a klasszikus elektrodinamika törvényeinek, de segítségükkel a H atom jól leírható.

m vr r mv a. ) A stacionárius pályán mozgó elektron sebessége állandó, mert a rá ható erők eredője zérus e 2/(4 or 2) – mev 2/r =0 b. ) A körpályákon az impulzusmomentum a Planck állandó egész számú többszöröse morv = n h/2 n: kvantumszám c. ) Az atom teljes energiája, a potenciális és kinetikus energia összege mindaddig állandó, amíg az elektron a kérdéses pályán mozog: E= e 2/(4 or) + mev 2/2 A sebesség, a pálya sugara és az energia a n edik állapotban: v(n) = e 2/(2 nh o) r(n) = o n 2 h 2/( mee 2) E(n) = mee 4/(8 o 2 n 2 h 2) Fényeléskor: E = E 2 – E 1 = h E = h = [mee 4/(8 o 2 h 2)](1/n 22 1/n 12)=const. (1/n 22 1/n 12) A kísérletek szerint E = Rc E (1/n 22 1/n 12) R =1, 097 x 107 m 1 a számítható konst. egyezik a kísérlettel

A BOHR-FÉLE ATOMMODELL TELJESÍTŐKÉPESSÉGE Helyesen írja le a hidrogénatom szerkezetét (egy atommag, egy elektron) a hidrogénatom energiája, az elektron pályájának sugara és kerületi sebessége a kvantumszám függvénye: r a kvantumszám négyzetével arányosan nő (r α n 2) v a kvantumszámmal fordítottan arányos (r α 1/n) E a kvantumszámmal négyzetével fordítottan arányos ( 1/n 2) A modell szerint a H atom állapotát a kvantumszám egyértelműen jellemzi Problémák: A modell alapján már a kételektronos He atom spektrumát sem lehet jól kiszámítani A H atom színképében több vonal van, mint amennyi a modellből következik: egy spektrumvonal helyett több közeli vonal észlelhető, ha mágneses térben (Zeeman effektus) vagy elektromos térben (Stark effektus) van az atom (a vonalak felhasadnak) A Bohr modell szerint az atom korong alakú. További kvantumszámok segítségével a H atom leírása javítható (SOMMERFELD, 1915), de a modellt nem lehet tökéletessé tenni.

A MIKRORÉSZECSKÉK VILÁGÁBAN ÉSZLELT TOVÁBBI KÜLÖNLEGES JELENSÉGEK ANYAGHULLÁMOK (DE BROGLIE, 1924) a v sebességgel mozgó részecskék nyalábjához is rendelhető egy hullám Az anyaghullámhossza: λ= h/p HEISENBERG féle bizonytalansági elv (1927) ( x m vx) ≥ h/2 px Az elektron helyét a térben (x, térkoordináta) és sebességét (p impulzusát) egy időben pontosan nem lehet megmérni. AZ ANYAG IS KETTŐS TERMÉSZETŰ. Valóban, a kísérletek szerint az elektron és a neutronnyaláb kristályokon elhajlik, mint a fény egy rácson, pontosan úgy, mint egy olyan Röntgen sugár, amelynek akkora a hullámhossza, mint a részecskék impulzusából a fenti képletből számítható λ.

A MIKRORÉSZECSKÉK VILÁGÁNAK LEÍRÁSA: KVANTUMMECHANIKA A szubatomi részecskék tulajdonságainak leírására a KLASSZIKUS MECHANIKA nem alkalmas. A szokatlan jelenségek a KVANTUMMECHANIKA eszközeivel írhatók le. A kvantummechanika alapfogalmai Egy mikrorendszer állapotát a helynek egy függvénye, ψ(x) jellemzi, melynek négyzete megadja, hogy a részecske mekkora valószínűséggel tartózkodik az x helyen ψ(x) neve: hullámfüggvény A hullámfüggvényből a célra kidolgozott matematikai módszerekkel a rendszer minden megmérhető tulajdonsága kiszámítható A kvantummechanika segítségével az anyaghullámok, az atomok energiájának kvantáltsága, sőt, az atommagok szerkezete is helyesen írható le (= a kiszámítható adatok megegyeznek a mérhetőekkel) Az atomok, sőt egy rezgő molekula kvantumállapotai kvantumszámokkal jellemezhetők

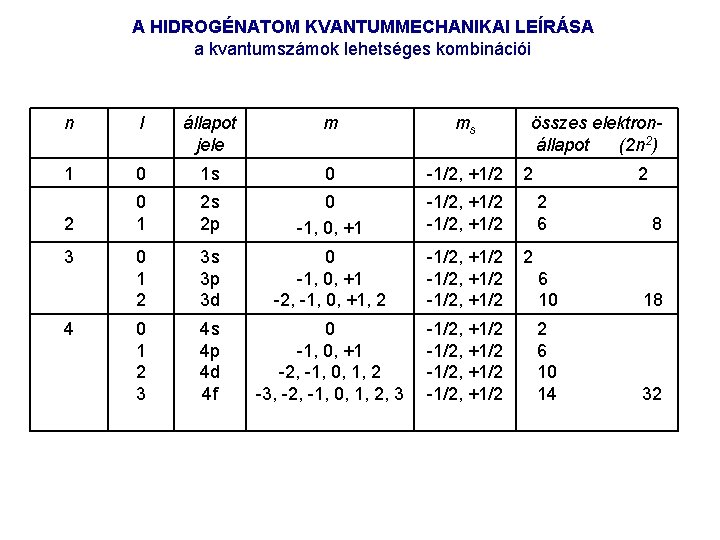
A HIDROGÉNATOM KVANTUMMECHANIKAI LEÍRÁSA – a többi atom leírásának alapja A kvantummechanika szerint – összhangban a kísérleti tapasztalatokkal – az elektron másképp mozog, mint a bolygók: nem egyetlen térbeli vonallal jellemezhető pályán halad, hanem különböző helyeken különböző valószínűséggel fordul elő, és ez az eloszlás „diffúz”, mint egy felhő. Az eloszlás térbeli alakja és az atom energiája függ az atom kvantumállapotától. A hidrogénatom kvantumállapotait 4 egész szám jellemzi, ezeket kvantumszámnak nevezzük. Főkvantumszám (jele: n) értéke természetes szám: 1, 2, 3, . . . , növekvő n nel növekszik az állapot energiája (mint a Bohr modellben), és az elektron tartózkodási valószínűségi maximuma az atommagtól egyre távolabb van; a maximumok száma n Mellékkvantumszám (jele: l ) értéke a 0 l (n 1) tartományban bármely egész szám. A megfelelő elektronállapotok sorra: s, p, d, f, (g, h, . . . ). Mágneses kvantumszám (jele: m) értéke -l m + l tartományban bármely egész szám. 2 l+1 értéke lehet. Spinkvantumszám (jele ms) két értéke lehetséges: 1/2, +1/2, az elektron spinjének térbeli beállását jelzi. Az elektron spinje egy olyan tulajdonság, amely nek makroszkopikus megfelelője nincsen: az elektron úgy viselkedik, mintha apró mágnes volna („saját” mágneses momentuma van). A hidrogénatom állapotait az (n, l, m) számsorral jellemezzük.

A HIDROGÉNATOM KVANTUMMECHANIKAI LEÍRÁSA a kvantumszámok lehetséges kombinációi n l állapot jele m ms 1 0 1 s 0 1/2, +1/2 2 0 1 2 s 2 p 0 1, 0, +1 1/2, +1/2 0 1 2 3 s 3 p 3 d 0 1, 0, +1 2, 1, 0, +1, 2 1/2, +1/2 0 1 2 3 4 s 4 p 4 d 4 f 0 1, 0, +1 2, 1, 0, 1, 2 3, 2, 1, 0, 1, 2, 3 1/2, +1/2 3 4 összes elektronállapot (2 n 2) 2 2 2 6 8 2 6 10 14 32

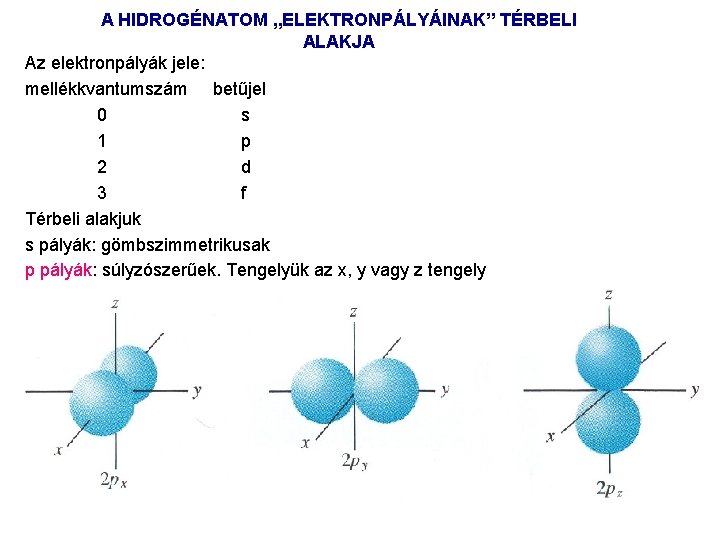
A HIDROGÉNATOM „ELEKTRONPÁLYÁI” A kvantumállapotoknak megfelelő tartózkodási valószínűségi eloszlásokat pályák nak nevezzük, de nem szabad elfelejteni, hogy diffúz térbeli eloszlásokról van szó. H atom elektronállapotainak energiáját egyedül a főkvantumszám határozza meg. Egy adott főkvantumszám esetén több „pálya” lehetséges, amelyek a többi kvantumszám értékeiben különböznek, de a H atomban mindegyikhez azonos energia tartozik (más atomokban nem). Az ilyen állapotokat elfajultnak, degeneráltnak nevezzük. Egy adott n hez 2 n 2 pálya tartozik, az elektronállapotok elfajultsága 2 n 2 szeres. A különböző l mellékkvantumszámú pályák abban térnek el, hogy más az elektroneloszlás térbeli alakja, és az irányultság független a főkvantumszámtól. Ha l=0, az elektron eloszlás gömbszimmetrikus, a tartózkodási valószínűség csak az atommagtól való távolságtól függ. A nullától különböző mellékkvantumszámú állapotokban az elektron tartózkodási valószínűsége függ a térbeli iránytól is, és l+1 lebenyből áll.

A HIDROGÉNATOM „ELEKTRONPÁLYÁINAK” TÉRBELI ALAKJA Az elektronpályák jele: mellékkvantumszám betűjel 0 s 1 p 2 d 3 f Térbeli alakjuk s pályák: gömbszimmetrikusak p pályák: súlyzószerűek. Tengelyük az x, y vagy z tengely

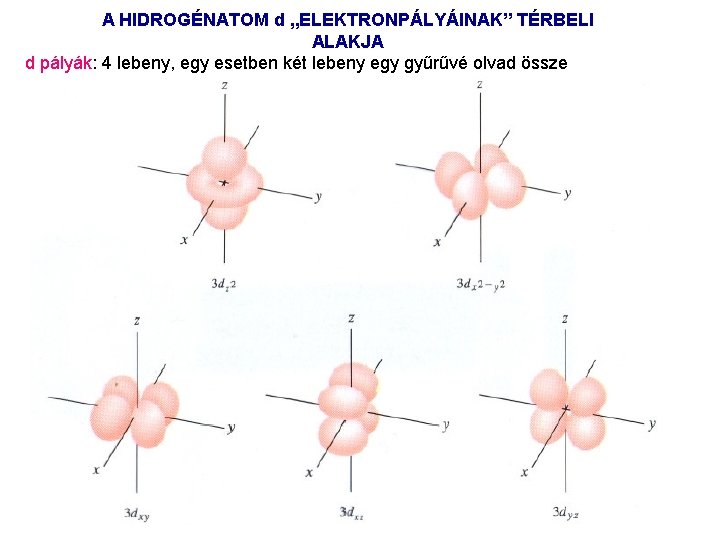
A HIDROGÉNATOM d „ELEKTRONPÁLYÁINAK” TÉRBELI ALAKJA d pályák: 4 lebeny, egy esetben két lebeny egy gyűrűvé olvad össze

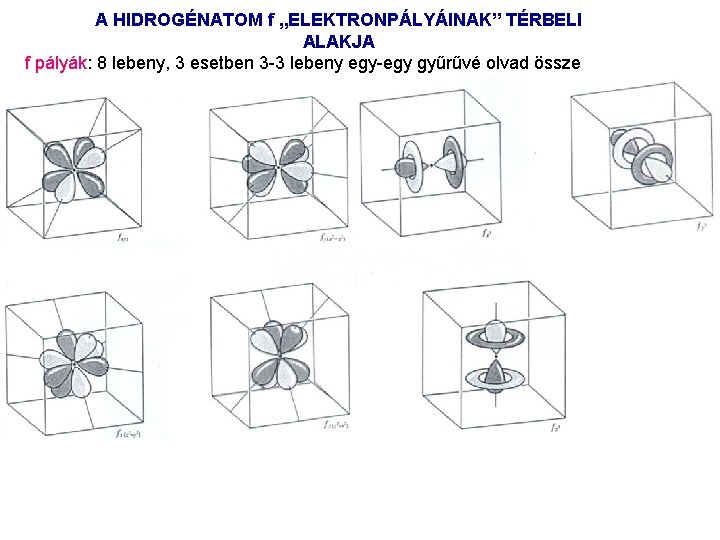
A HIDROGÉNATOM f „ELEKTRONPÁLYÁINAK” TÉRBELI ALAKJA f pályák: 8 lebeny, 3 esetben 3 3 lebeny egy gyűrűvé olvad össze

TÖBBELEKTRONOS ATOMOK ELEKTRONSZERKEZETE: KVANTUMÁLLAPOTOK ÉS TÉRBELI ELEKTRONELOSZLÁS Ha az atom rendszáma nagyobb egynél, több elektron szükséges a semlegesség biztosításához. Többelektronos atomokban az egyes elektronok tartózkodási valószínűségének térbeli eloszlása hasonlít a H atombeliéhez. Az elektronok olyan „pályákra” kerülnek, melyeket ugyanúgy az n, l, m, ms kvantumszám jellemez. Az atommag nagyobb töltése miatt (erősebb vonzás) az alacsonyabb kvantumszámú pályákon levő elektronok tartózkodási valószínűségi maximuma közelebb van az atommaghoz, mint a H atomban. A nagy főkvantumszámú pályákra „kiszoruló” elektronok viszont a mag töltését „leárnyékolva” érzékelik, távolabbra csúszhatnak ki. Egy adott n főkvantumszám esetén az l mellékkvantumszám n-féle különböző értéket vehet fel, mindegyikhez 2 l+1 mágneses kvantumszám érték tartozik. Ezek térbeli eloszlása olyan alakú, mint a H atom azonos (n, l, m) kvantumszámokkal jellemzett pályája, és az atommagtól nagyjából ugyanolyan távolságra vannak. Ezért ezeknek az – n főkvantumszámú – pályáknak az együttesét elektronhéjnak nevezzük.

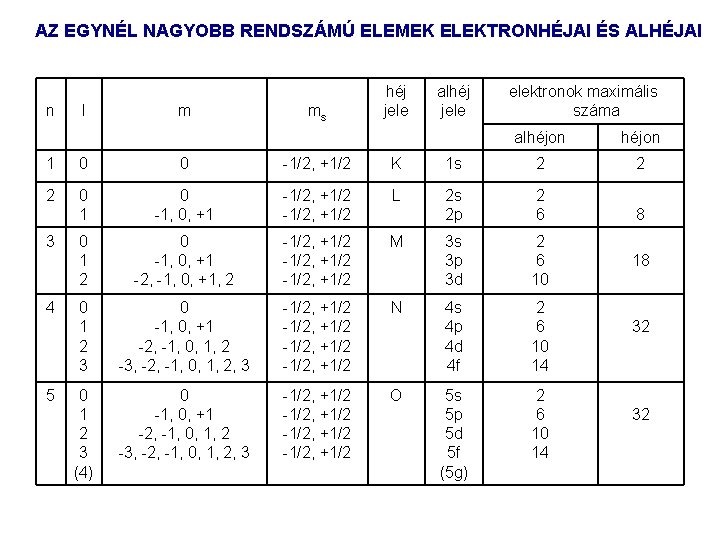
TÖBBELEKTRONOS ATOMOK ELEKTRONSZERKEZETE: ELEKTRONHÉJAK Az elektronhéjak főkvantumszám héj jele 1 K 2 L 3 M 4 N A különböző l mellékkvantumszámú „pályák” abban térnek el, hogy más az elektroneloszlás térbeli alakja, olyan, mint a H atomban, és az irányultság független a főkvantumszámtól. Adott mellékkvantumszámú pályák együttese alhéjat alkot, ezeket n és l jellemzi: 1 s, 2 s, …. 3 d, stb. A hidrogénatomtól eltérően a különböző mellékkvantumszámhoz tartozó pályák energiája különböző lesz ( az l szerinti degeneráltság megszűnik), de az m mágneses kvantumszám szerinti degeneráltság megmarad. Az l mellékkvantumszámú alhéjba 2 l+1 azonos energiájú pálya tartozik.

AZ EGYNÉL NAGYOBB RENDSZÁMÚ ELEMEK ELEKTRONHÉJAI ÉS ALHÉJAI n l m ms héj jele alhéj jele elektronok maximális száma alhéjon 1 0 0 1/2, +1/2 K 1 s 2 2 2 0 1, 0, +1 1/2, +1/2 L 2 s 2 p 2 6 8 0 1 2 0 1, 0, +1 2, 1, 0, +1, 2 1/2, +1/2 M 3 s 3 p 3 d 2 6 10 0 1 2 3 0 1, 0, +1 2, 1, 0, 1, 2 3, 2, 1, 0, 1, 2, 3 1/2, +1/2 N 4 s 4 p 4 d 4 f 2 6 10 14 0 1 2 3 (4) 0 1, 0, +1 2, 1, 0, 1, 2 3, 2, 1, 0, 1, 2, 3 1/2, +1/2 O 5 s 5 p 5 d 5 f (5 g) 2 6 10 14 3 4 5 18 32 32

TÖBBELEKTRONOS ATOMOK ELEKTRONSZERKEZETE: ALHÉJAK A degeneráltság megszűnése miatt többelektronos atomokban az alhéjak energiáját a fő és mellékkvantumszám együttesen határozza meg. A nagyobb n+l hez nagyobb energia tartozik. Ha két alhéjra n+l azonos, akkor az az alacsonyabb energiájú, amelynek a főkvantumszáma kisebb. Az elektronpályák energiájának sorrendje: alhéj: 1 s 2 s 2 p 3 s 3 p 4 s 3 d 4 p 5 s 4 d 5 p 6 s 4 f 5 d 6 p 7 s. . n+l: 1 2 3 3 4 4 5 5 5 6 6 6 7 7. . . A különböző atomokban az ugyanolyan jelű pályákon levő elektronok energiája függ az atommag töltésétől és a héj „betöltöttségétől”. A nagyobb rendszámú elemek atomjaiban az alacsony főkvantumszámú pályákon levő elektronok sokkal erősebben vannak kötve, mint a kisebb rendszámú elemekben ugyanazon pályán levők. A bemutatott energiasorrend egyes esetekben megváltozik, általában olyankor, amikor pl. egy alhéj majdnem teljesen be van töltve.

A FELÉPÍTÉSI ELV - AZ ELEKTRONHÉJAK BETÖLTÉSI SORRENDJE Az atomok semlegesek. A rendszám megadja az atommag pozitív töltéseinek számát. A semlegesség biztosításához ugyanennyi elektron szükséges. Azt, hogy az elektronok az elektronhéjakon ill. alhéjakon hogyan „helyezkednek el”, néhány tapasztalati úton felismert szabály alapján lehet megmondani: 1. az energiaminimum elve; 2. a Pauli elv; 3. a Hund szabály 1. Az energiaminimum elve Az elektronok mindig a rendelkezésre álló legalacsonyabb energiájú pályára kerülnek. A „rendelkezésre álló” kifejezés arra utal, hogy egy pályán nem lehet akármennyi elektron; számukat a többi elv szabályozza. Így nem minden elektron kerül ugyanarra a pályára. A pályák betöltődési sorrendje a pályaenergiák alapján a következő: 1 s 4 f 5 f 3 d 4 d 5 d 2 p 3 p 4 p 5 p 6 p 2 s 3 s 4 s 5 s 6 s 7 s

A PAULI-ELV ÉS AZ ELEKTRON SPINJE 2. A Pauli féle tilalmi elv egy atomban nem lehet két olyan elektron, amelyeknek mind a négy kvantumszáma azonos. Egy egy (n, l, m) pályán legfeljebb két elektron helyezkedhet el: ekkor az egyikre ms=1/2, a másikra ms= 1/2. Az elektronok megkülönböztethetlenségének következménye. Ha egy atompályán egy elektron van, párosítatlan spinűnek nevezzük, ha kettő, akkor párosított spinűek. A két ellentétes spinű elektron szívesen marad együtt, és egy elektronpárt alkot. A spint vázlatosan nyíllal jelöljük: ↑, ha ms=1/2 és ↓, ha ms= 1/2. Ha két elektron spinje ellentétes, azok kompenzálják egymást: ↑↓ a párosított spinű elektronpár eredő spinje 0, és emiatt nem mutatkozik „mágnesnek”. Ha egy atomban minden elektron párosított spinű, akkor az atomnak (és molekulák nak is) nincsen eredő mágneses momentuma, inhomogén mágneses tér „kinyomja” őket magából. Ha van párosítatlan spinű elektron, az atom mágneses momentuma nem 0, az ilyen anyagokat az inhomogén mágneses tér behúzza. (Az előbbieket diamágnesesnek, az utóbbiakat paramágnesesnek mondjuk). A vas és rokonainak makroszkopikusan megfigyelhető mágnesességét (ferromágnesesség) szintén az elektronspin okozza, itt egy szubmikroszkopikus tartományban szabályosan rendeződnek az elektronspinek.

A HUND-SZABÁLY 3. A Hund szabály v. maximális multiplicitás elve Egy állapot multiplicitását az atomban levő elektronok (előjeles) spinkvantum számainak S összegéből a 2 S+1 összefüggéssel kapjuk. A degenerált (azonos energiájú, különböző mágneses kvantumszámú) alhéjakat az elektronok úgy töltik be, hogy a multiplicitás a lehető legnagyobb legyen. Először a 2 l+1 db pályán egyenként megjelenik egy elektron, mindegyik azonos spinnel, majd, ha már mindegyiken van elektron, az újonnan felkerülő elektronok a már félig betöltött pályákra kerülnek (ahogyan a „buszt megtöltik az utasok”), a lehető legnagyobb legyen a párosítatlan spinű elektronok száma). Pl. a l=1 mellékkvantumszámú p alhéjakon 6 elektron „fér el”. Ahogy sorban egyre több elektron jut egy p alhéjra, a pályák a következő sorrendben töltődnek be: px py pz ↑ ↑↓ ↑ px ↑ ↑ py pz ↑ ↑↓ ↑↓ ↓ px py pz ↑ ↑↓ ↑↓ ↑↓

EGYES ATOMOK ELEKTRONKONFIGURÁCIÓJA - NEMESGÁZOK Az atomokban a rendszámmal azonos számú elektron helyezkedik el. Azok az atomok, amelyeknek legkülső elektronhéján az alhéjak betöltöttsége ugyanolyan, kémiailag hasonlóan viselkednek. A legkülső elektronhéjat vegyértékhéjnak, az alatta levő, teljesen betöltött héjak együttesét atomtörzsnek nevezzük. Ha egy elektronhéj teljesen be van töltve, akkor az elektroneloszlás gömbszimmetrikus. A teljesen betöltött héjak emiatt nagyon stabilak. Azok az elektronkonfigurációk, amelyekben minden betöltött elektronhéj teljesen be van töltve, különösen stabilak. Az ilyen atomok annyira „érzéketlenek” a környezetükkel szemben, hogy nem képeznek vegyületeket, egyatomos „molekula” ként fordulnak elő. Ezeket nemesgázok nak hívjuk (He, Ne, Ar, Kr, Xe, Rn), a megfelelő elektronkonfigurációt pedig nemesgáz-konfigurációnak. A nemesgázok elektronkonfigurációjának jelölése A betöltött alhéjak jelét sorban leírjuk, és jobb felső indexbe tesszük a betöltöttséget. A teljesen betöltött héjakat azok betűjelével is lehet helyettesíteni. He (Z=2): 1 s 2 Ne (Z=10): 1 s 2 2 p 6 Ar (Z=18): 1 s 2 2 p 6 3 s 2 3 p 6 Kr (Z=36): 1 s 2 2 p 6 3 s 2 3 p 6 3 d 10 4 s 2 4 p 6

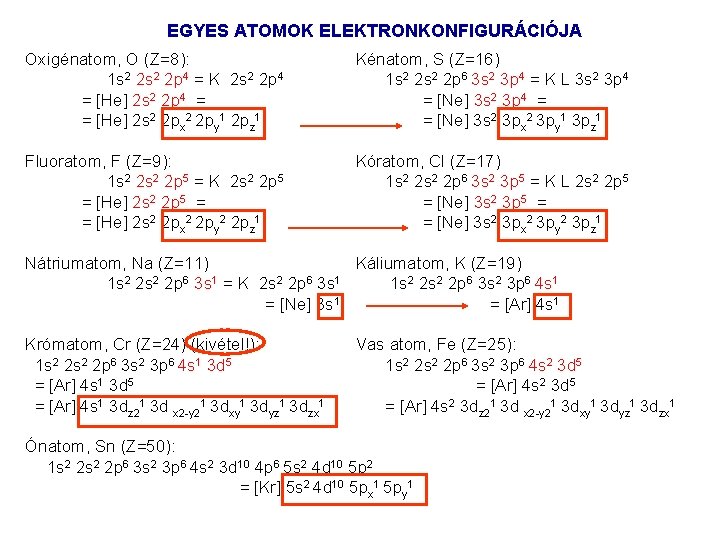
EGYES ATOMOK ELEKTRONKONFIGURÁCIÓJA Más atomok elektronszerkezetét ahhoz a nemesgáz atomhoz viszonyítjuk, amelynek a legnagyobb, de még az adott atoménál kisebb a rendszáma. Ennek vegyjelét szögletes zárójelben a vegyértékhéj alhéjainak jele elé írhatjuk. Szénatom C (Z=6) : 1 s 2 2 p 2 = [He] 2 s 2 2 p 2 = K 2 s 2 2 p 2 = 1 s 2 2 px 1 2 py 1 Az alacsonyabb fő és mellékkvantumszámú héjak pályáin két elektron van, a külső alhéjon a Hund szabály dönt. A lehetséges elektron elrendeződések (az alapállapot a legfelső): 1 s 2 s 2 p multiplicitás 1. ( ) ( )( )( ) 2 S+1=2 2. ( ) ( )( )( ) 2 S+1=1 3. ( ) ( )( ) 2 S+1=1 Nitrogénatom, N (Z=7): 1 s 2 2 p 3 = K 2 s 2 2 p 3 = [He] 2 s 2 2 p 3 = = [He] 2 s 2 2 px 1 2 py 1 2 pz 1

EGYES ATOMOK ELEKTRONKONFIGURÁCIÓJA Oxigénatom, O (Z=8): 1 s 2 2 p 4 = K 2 s 2 2 p 4 = [He] 2 s 2 2 p 4 = = [He] 2 s 2 2 px 2 2 py 1 2 pz 1 Kénatom, S (Z=16) 1 s 2 2 p 6 3 s 2 3 p 4 = K L 3 s 2 3 p 4 = [Ne] 3 s 2 3 p 4 = = [Ne] 3 s 2 3 px 2 3 py 1 3 pz 1 Fluoratom, F (Z=9): 1 s 2 2 p 5 = K 2 s 2 2 p 5 = [He] 2 s 2 2 p 5 = = [He] 2 s 2 2 px 2 2 py 2 2 pz 1 Kóratom, Cl (Z=17) 1 s 2 2 p 6 3 s 2 3 p 5 = K L 2 s 2 2 p 5 = [Ne] 3 s 2 3 p 5 = = [Ne] 3 s 2 3 px 2 3 py 2 3 pz 1 Nátriumatom, Na (Z=11) Káliumatom, K (Z=19) 1 s 2 2 p 6 3 s 1 = K 2 s 2 2 p 6 3 s 1 1 s 2 2 p 6 3 s 2 3 p 6 4 s 1 = [Ne] 3 s 1 = [Ar] 4 s 1 Krómatom, Cr (Z=24) (kivétel!): 1 s 2 2 p 6 3 s 2 3 p 6 4 s 1 3 d 5 = [Ar] 4 s 1 3 dz 21 3 d x 2 y 21 3 dxy 1 3 dyz 1 3 dzx 1 Vas atom, Fe (Z=25): 1 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 5 = [Ar] 4 s 2 3 dz 21 3 d x 2 y 21 3 dxy 1 3 dyz 1 3 dzx 1 Ónatom, Sn (Z=50): 1 s 2 2 p 6 3 s 2 3 p 6 4 s 2 3 d 10 4 p 6 5 s 2 4 d 10 5 p 2 = [Kr] 5 s 2 4 d 10 5 px 1 5 py 1

A VEGYÉRTÉKHÉJ SZERKEZETE – PERIÓDIKUS ISMÉTLŐDÉS Ha a kémiai elemek elektronszerkezetének változását megvizsgáljuk, amikor a rendszámot növeljük, kiderül, hogy a legkülső elektronhéj, a vegyértékhéj betöltöttsége periodikusan ismétlődik. Az elektronok az atomokban fokozatosan feltöltik az elektron héjakat. A vegyértékhéj alatti teljesen betöltött héjak gömbszimmetrikusak, kevéssé érzékelik a környezet hatásait, azokra az atom a legkülső elektronhéjával reagál. Amikor egy elektronhéj teljesen megtelt, és egy új elektronhéj betöltődése kezdődik, először az s, majd a p alhéjba kerülnek elektronok. A legkülső héj szerkezete pedig mindig ugyanaz, amikor ugyanannyi elektron van a vegyértékhéjban. Az ilyen atomok kémiailag nagyon hasonlóan fognak viselkedni, és egy bizonyos viselkedés újra megismétlődik, amikor az atomok tulajdonságait figyeljük, ahogy növekvő rendszám szerint sorba állítjuk őket. Lesznek olyan atomok, amelyekben a legkülső alhéjon s 1, aztán s 2 p 1 , . . . d 10, . . . f 14 a betöltöttség. 1 s 4 f 5 f 3 d 4 d 5 d 2 p 3 p 4 p 5 p 6 p 2 s 3 s 4 s 5 s 6 s 7 s

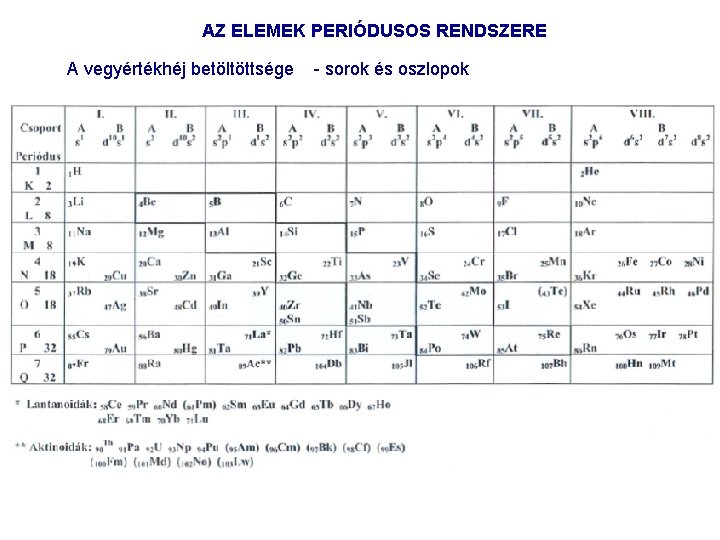
AZ ELEMEK PERIÓDUSOS RENDSZERE A vegyértékhéj betöltöttsége sorok és oszlopok

AZ ELEMEK PERIÓDUSOS RENDSZERE Kémiai tulajdonságok fémek félfémek nemfémes elemek

AZ ELEMEK CSOPORTOSÍTÁSA Főcsoportok (A oszlopok) A vegyérték héjban az s és p alhéj részben van betöltve Mellékcsoportok (B oszlopok) d héjak „feltöltődése” Az elemcsoportok elnevezése Vegyértékhéj betöltöttsége alapján s mező elemei: n s 1 2 (I A – II A) p mező elemei: ns 2 np 1 6 (III A – II A) d mező elemei: (n 1)d 1 8 ns 2 f mező elemei: (n 2)f 1 14 ns 2 A periódusos rendszerben elfoglalt hely szerint: Főcsoportbeli elemek: alkálifémek (I A), alkáliföldfémek (II A), földfémek (III A), szén csoport (IV A), pnikogének (V A), kalkogének (VI A), halogének (VII A), nemesgázok (VIII) Mellékcsoportbeli elemek: Átmenetifémek (d mező, III B – VIII B): Sc csoport, Ti csoport, V csoport, Cr csoport, Mn csoport, Fe csoport, könnyű Pt fémek, nehéz Pt fémek, ritka földfémek (f mező, lantanoidák és aktinoidák) Kémiai fizikai tulajdonságok alapján Fémek – átmenetifémek – félfémek – nemfémes elemek

A PERIÓDUSOS RENDSZER TÖRTÉNETE Dimitrij MENGYELEJEV (1869): ha az elemeket növekvő atomtömeg (≈tömegszám) szerint sorba rendezzük, a tulajdonságok periódikusan ismétlődnek. Ha az elemeket nem egy sorba írjuk, hanem úgy, hogy azok az elemek, amelyeknek a tulajdonságai hasonlóak, egymás alá kerüljenek, egy olyan táblázatot kapunk, amelyben egy oszlopot hasonló tulajdonságú elemek alkotnak. A táblázat egy sora megfelel egy periódusnak. Ezt a táblázatot periódusos táblának nevezte el. 1869 ben még sok elem ismeretlen volt. Ahhoz, hogy az oszlopokba valóban a hasonló elemek kerüljenek, egy helyet üresen kellett hagyni. Cu Zn (Ea) (Es) As Se Br rel. atomtömeg 63 65 (68) (72) 75 78 80 g/mol Ea eka alumínium (gallium), Es eka szilícium (germánium) Mengyelejev a hiányzó elemek tulajdonságait a szomszédok tulajdonságai alapján megjósolta. Az Al alatti helyen levó elemet (gallium) 5 év múlva felfedezték. tulajdonság eka-alumínium gallium jósolt mért rel. atomtöm. 68 (ate) 69, 9 (ate) oxid képlete Ea 2 O 3 Ga 2 O 3 sűrűség 5, 9 g/cm 3 5, 91 g/cm 3 olvadáspont alacsony 30, 1 o. C forráspont magas 1983 o. C